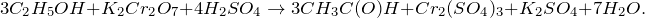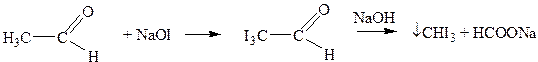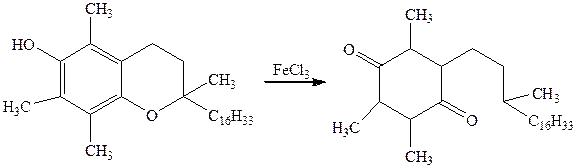C2H5OH + K2Cr2O7 + H2SO4 = ? уравнение реакции
Составьте химическое уравнение по схеме C2H5OH + K2Cr2O7 + H2SO4 = ? Относится ли данная реакция к ОВР? Охарактеризуйте соединение этанол: укажите его основные физические и химические свойства, а также способы получения.
Этиловый спирт (этанол) представляет собой бесцветную жидкость со слабым запахом, легко воспламеняется. Смешивается с водой во всех соотношениях. Этанол хорошо растворяет многие органические вещества. Безводный (абсолютный) спирт кипит при 78,370С. Получаемый в промышленности спирт-ректификат представляет собой смесь 95,5% этанола и 4,4% воды, которая кипит при 78,370С (смеси определенного состава, кипящие при постоянной температуре, называют азеотропными смесями).
Первичные спирты окисляются в альдегиды, которые в свою очередь могут окисляться в карбоновые кислоты. В ходе окисления этанола дихроматом калия в кислой среде, создаваемой серной кислотой (C2H5OH + K2Cr2O7 + H2SO4 = ?) будет происходить образование двух молекул уксусного альдегида (этаналя), средних солей – сульфатов хрома (III) и калия, а также воды. Молекулярное уравнение реакции имеет вид:
Кроме этого для этанола возможны реакции, протекающие с участием:
— атома водорода гидроксильной группы (взаимодействие с активными металлами, кислотами);
— гидроксильной группы (взаимодействие с галогенами, галогенидами фосфора, аммиаком);
— атома водорода гидроксильной группы и связи Ca-H (дегидрирование, окисление);
— гидроксильной группы и связи Cb-H (внутримолекулярная дегидратация).
Получение этилового спирта можно осуществить путем гидролиза моногалогеналканов водными растворами щелочей, при гидратации алкенов (применяется в промышленности) или гидрирование альдегидов и кетонов.
Источник
Опыт №1. Окисление этилового спирта хромовой смесью
Реакция используется для экспрессного обнаружения следовых количеств этилового спирта в выдыхаемом воздухе.
Смешивают в пробирке 2 мл раствора бихромата калия, 1 мл концентрированной серной кислоты и 0,5 мл этилового спирта и осторожно нагревают смесь.
Химизм процесс: Течение реакции обнаруживается по изменению окраски раствора, а образование ацетальдегида — по характерному для него запаху яблок. Ацетальдегид в избытке бихромата калия в дальнейшем окисляется до уксусной кислоты.
Наблюдения
Выводы__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт №2. Образование иодоформа из спирта
Смешивают в пробирке 3-4 капли исследуемого спирта и 2-3 мл воды. Полученный раствор слегка нагревают (лучше всего на водяной бане при 60°С), добавляют к нему 0,5 -1,0 мл растворя йода и затем приливают разбавленный раствор щелочи по каплям до исчезновения окраски. В случае образования иодоформа выделяется светло-желтая муть или осадок и появляется характерный запах.
Химизм процесса: В условиях опыта йод и щелочь вступают в обратимую реакцию:
Образующаяся соль иодноватистой кислоты является сильным окислителем и переводит первичные спирты в альдегиды:
Вторичные спирты окисляются до кетонов. Атомы водорода в группах -СО-СН3, -СО-СН2-, -СО-СН- легко замещаются галогенами, в частности йодом.
Ничтожно малая растворимость иодоформа в воде позволяет обнаружить по реакции его образования даже следы этилового спирта в водном растворе. Реакция широко используется в химико — токсикологическом анализе для установления алкоголя в желудке умерших людей.
Наблюдения
Выводы___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт № 3 Комплексообразование многоатомных спиртов
В пробирке получают гидроксид меди, для чего в разбавленный раствор сульфата меди вводят в небольшом избытке раствор едкой щелочи. Затем в пробирку добавляют 3-5 капель жидкого спирта (глицерина, этиленгликоля). Встряхнув пробирки, дают их содержимому отстояться и отмечают появление характерной окраски жидкости.
Химизм процесса: С увеличением числа гидроксильных групп в молекуле спирта кислотность спиртов возрастает, что определяет легкость образования с гидроксидом меди комплексных алкоголятов меди
Наблюдения
Выводы
Опыт №4 Реакция фенолов с хлоридом железа
Многие одно- и многоатомные фенолы, содержащие в молекуле один или несколько фенольных гидроксила, дают с водным раствором хлорида железа интенсивное окрашивание того или иного цвета, характерное для данного фенола.
К 5-6 каплям 1% раствора фенола добавляют 3-5 капель раствора хлорида железа (III). Аналогично проводят реакцию с катехинами чая (витамин Р).
Химизм процесса: Окрашивание появляется в результате образования сильно диссоциированных комплексных фенолятов, образующихся по уравнению:
Хлорид железа способен также окислять фенолы до хинонов.
Наблюдения
Выводы__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт №5. Обнаружение двухатомных фенолов
Двухатомные фенолы, флавоноиды, содержащие соседние гидроксильные группы, образуют с ацетатом свинца осадки, окрашенные в желто-оранжевый, красный или синий цвет.
К 1 мл спиртового 0,50% раствора кверцетина добавляют несколько капель 1% раствора ацетата свинца.
Наблюдения:
Выводы:____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт №6 Обнаружение токоферола (витамина Е)
Токоферол выделен в 1936 г из масла зародышей пшеницы. Это соединение является основным природным антиоксидантом.
К 1 мл спиртового 0,1% раствора a-токоферола добавляют 2-3 капли 0,5% раствора хлорида железа в спирте и 2-3 капли 0,5% раствора 2,2-дипиридила.
Химизм процесса: Для идентификации токоферолов используют реакции окисления. При окислении токоферолов спиртовым раствором FeCl3 происходит разрыв пиранового цикла с образованием a-токоферилхинона желтого цвета по схеме:
Реакцию ведут обычно в присутствии 2,2-дипиридила, который с образовавшимся FeCl2 дает комплексное соединение, окрашенное в интенсивно красный цвет.
Наблюдения:
Выводы:
Вопросы к защите работы.
1. Напишите уравнение реакции катехина (1,2-дигидроксибензола) с ацетатом свинца
2. Напишите уравнение реакции окисления этанола бихроматом калия в кислой среде.
3.Какое значение имеет реакция образования иодоформа?
Источник