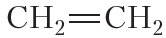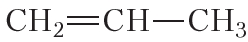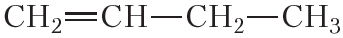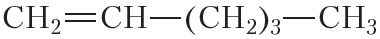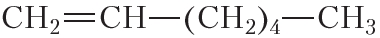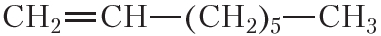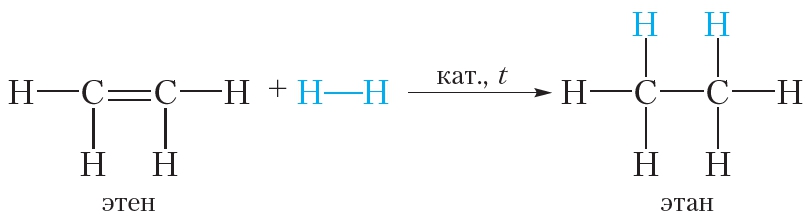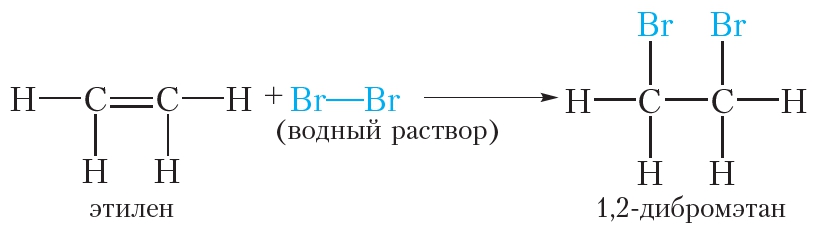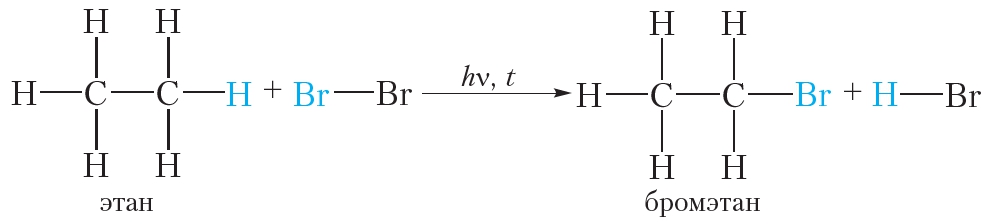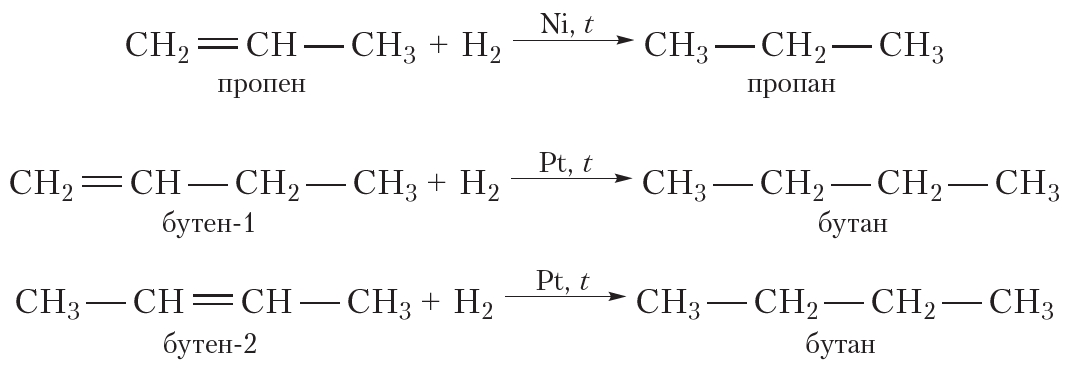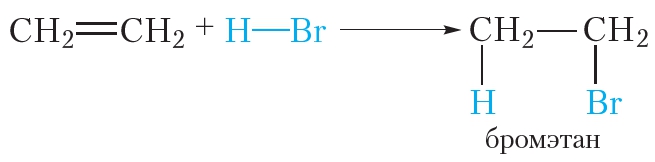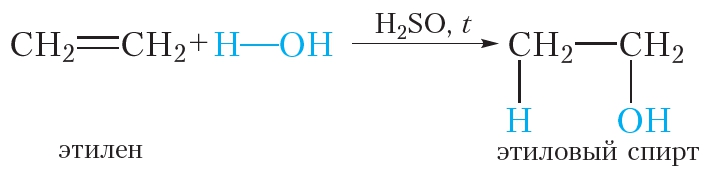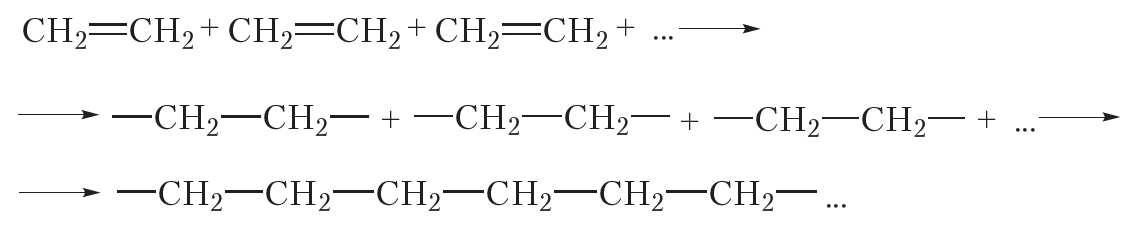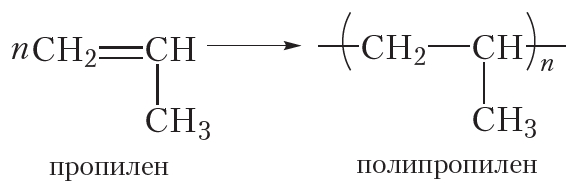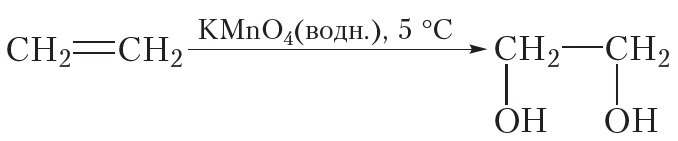- § 15. Физические и химические свойства алкенов
- Оглавление
- Физические свойства
- Химические свойства
- Реакции присоединения
- Реакция полимеризации
- Реакции окисления
- Вопросы и задания
- Химические свойства алкенов
- Химические свойства алкенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкенов
- 1.3. Гидрогалогенирование алкенов
- 1.4. Гидратация
- 1.5. Полимеризация
- 2. Окисление алкенов
- 2.1. Каталитическое окисление
- 2.2. Мягкое окисление
- 2.2. Жесткое окисление
- 2.3. Горение алкенов
- 3. Замещение в боковой цепи
- 4. Изомеризация алкенов
§ 15. Физические и химические свойства алкенов
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 15. Физические и химические свойства алкенов |
| Напечатано:: | Гость |
| Дата: | Пятница, 22 Октябрь 2021, 14:12 |
Оглавление
Физические свойства
По физическим свойствам алкены мало отличаются от алканов с тем же числом атомов углерода в молекуле. Так, алкены с числом атомов углерода в молекуле 2—4 при комнатной температуре являются бесцветными газами. Алкены с числом атомов углерода в молекуле от 5 до 17 — жидкости. Алкены с ещё бóльшим числом атомов углерода в молекуле (от 18 и более) представляют собой твёрдые вещества. Температуры кипения некоторых алкенов неразветвлённого строения приведены в таблице 15.1.
Таблица 15.1. Температуры кипения алкенов
Температура кипения (tкип, °С)
Так же, как и алканы, алкены нерастворимы в воде, но хорошо растворяются в органических растворителях.
Плотность алкенов меньше, чем у воды.
Химические свойства
Благодаря наличию в молекуле π-связи реакционная способность алкенов намного выше, чем у алканов. Напомним, что для алканов характерны реакции замещения. Для алкенов характерными являются реакции присоединения:
Эти реакции сопровождаются разрывом π-связи, так как она менее прочная, чем σ-связь.
В реакции присоединения алкены вступают в более мягких условиях, чем алканы в реакции замещения. Реакции замещения для алкенов нехарактерны.
Реакции присоединения
1. Галогенирование. Присоединение галогенов
Алкены так же, как и алканы, взаимодействуют с галогенами. Однако в случае алкенов происходит реакция присоединения, а не замещения. Сравним эти реакции.
Бромирование этилена (реакция присоединения ):
Бромирование этана (реакция замещения ):
Этилен реагирует с водным раствором брома (бромной водой) при обычных условиях, в то время как реакция этана с бромом возможна только в жёстких условиях — при нагревании или ультрафиолетовом облучении.
При пропускании этилена через бромную воду протекает реакция присоединения брома по двойной связи. В результате оранжевый раствор брома обесцвечивается.
В молекуле этана нет двойных связей, поэтому при пропускании этана через бромную воду химическая реакция не протекает и раствор брома остаётся оранжевым.
Следовательно, реакция с бромной водой является качественной реакцией на двойную связь.
Подобно этилену, другие алкены легко присоединяют бром, обесцвечивая бромную воду:
2. Гидрирование. Присоединение водорода
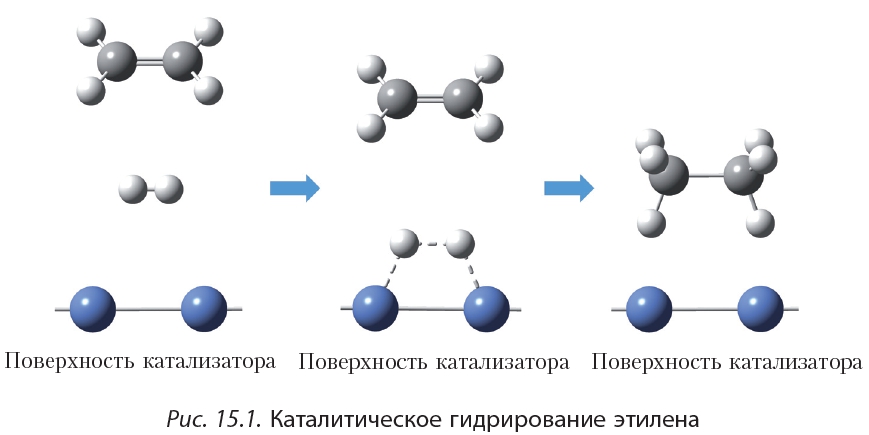
Присоединение водорода к органическому веществу называется реакцией гидрирования. При обычных условиях алкены не присоединяют водород. Для протекания реакции необходим катализатор (Pt или Ni).
В результате гидрирования алкенов образуются алканы. В начале данного параграфа приведено уравнение реакции гидрирования этена. Приведём уравнения реакций гидрирования некоторых других алкенов:
Как вы уже знаете, катализатор ускоряет протекание химической реакции, но сам при этом не расходуется. Роль катализатора в реакции гидрирования заключается в том, чтобы ослабить химическую связь в молекуле водорода и, таким образом, активировать эту молекулу для реакции присоединения:
3. Гидрогалогенирование. Присоединение галогеноводородов
Алкены могут вступать в реакции присоединения не только с простыми, но и со сложными веществами. Например, этилен легко присоединяет бромоводород:
Реакции присоединения галогеноводородов к органическим веществам называются реакциями гидрогалогенирования. Эти реакции протекают при обычных условиях.
4. Гидратация. Присоединение воды
Гидратацией называется реакция присоединения воды к органическому веществу. При нагревании в присутствии катализатора (H2SO4) этилен присоединяет воду. При этом образуется этиловый спирт:
Реакция полимеризации
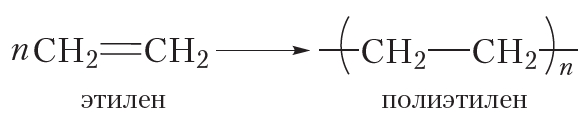
За счёт раскрытия двойных связей отдельные молекулы этилена могут соединяться друг с другом, образуя длинные цепи. Схематично этот процесс можно изобразить так:
В результате соединения сотен или даже тысяч молекул этилена образуется одна гигантская молекула — полимер. Протекающая реакция называется реакцией полимеризации.
Более кратко процесс полимеризации этилена можно выразить следующим уравнением:
Полимеризоваться могут и другие алкены, в частности пропилен:
Исходное вещество в реакции полимеризации называется мономером, а продукт — полимером. Молекулы полимера также называют макромолекулами.
Число мономерных звеньев в молекуле полимера называется степенью полимеризации. В формуле полимера степень полимеризации обозначают индексом «n».
Полиэтилен и полипропилен нам хорошо знакомы. Из полиэтилена изготавливают полиэтиленовую плёнку, посуду, предметы домашнего обихода и т. д. Полипропилен очень похож на полиэтилен и отличается от него только повышенной прочностью и термостойкостью. Из полипропилена изготавливают плёнку для теплиц, корпуса автомобильных аккумуляторов и многое другое. Со многими полимерами вы познакомитесь далее.
Реакции окисления
1. Горение. Взаимодействие с кислородом
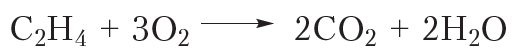
Так же, как и алканы, алкены горят с образованием углекислого газа и воды:
Приведём уравнение реакции горения алкенов в общем виде:
2. Неполное окисление. Реакция с KMnO4
Окисление алкенов может протекать и без разрушения углеродного скелета. Так, при пропускании этилена через разбавленный водный раствор перманганата калия (KMnO4) фиолетового цвета окраска исчезает. Перманганат калия расщепляет π-связь в молекуле этилена, при этом σ-связь между атомами углерода сохраняется. Протекание этой реакции отобразим не с помощью уравнения, а упрощённо в виде схемы. Схема реакции окисления этилена водным раствором перманганата калия выглядит следующим образом:
Из схемы видно, что π-связь в ходе данной реакции раскрывается, к атомам углерода присоединяются две кислородсодержащие группы — OH , то есть этилен окисляется. В результате образуется этиленгликоль, представитель многоатомных спиртов.
Написание схем часто оказывается более удобным, чем уравнений, поэтому их широко используют в органической химии.
Так же, как и реакция с бромной водой, реакция с раствором перманганата калия является качественной реакцией на двойную связь. В результате данной реакции наблюдается обесцвечивание фиолетового раствора перманганата калия.
Характерными для алкенов являются реакции присоединения по двойной связи. При этом происходит расщепление π -связи. Алкены могут присоединять галогены, водород, галогеноводороды, воду.
Реакция полимеризации — это многократно повторяющаяся реакция присоединения. В результате этой реакции образуются гигантские молекулы полимеров, широко применяемых в нашей жизни.
Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером; число мономерных звеньев в макромолекуле полимера называется степенью полимеризации.
Реакции обесцвечивания бромной воды и раствора перманганата калия являются качественными реакциями на двойную связь.
Вопросы и задания
1. Напишите уравнения реакций присоединения к этилену и пропилену: а) водорода; б) хлора. Назовите продукты реакций. Как на практике можно различить метан и этилен?
2. Напишите уравнение реакции бромоводорода с бутеном-2 . Назовите продукт реакции.
3. К бромной воде добавили избыток раствора гексена-1 в гептане. Какие явления будут наблюдаться при этом? Напишите уравнение протекающей реакции.
4. Напишите схему реакции взаимодействия пропилена с водным раствором перманганата калия.
5. В результате полимеризации этилена получен полимер массой 140 г, содержащий 1,505 ∙ 10 22 макромолекул. Вычислите: а) среднюю молярную массу полимера; б) степень полимеризации.
6. После пропускания через склянку с бромной водой (избыток) 20 дм 3 (н. у.) смеси этана и этилена масса склянки увеличилась на 20 г. Определите объём (н. у.) этана в смеси газов.
7*. Напишите схемы реакций, с помощью которых можно получить 2,2,3,3-тетраметилбутан из 2-метилбутена .

Источник
Химические свойства алкенов
Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
| Например, при гидрировании бутена-2 образуется бутан. |
| Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление. |
1.2. Галогенирование алкенов
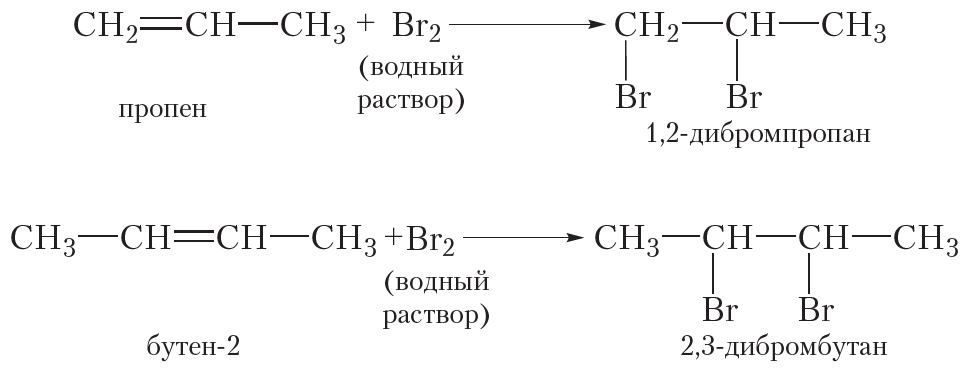
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан. |
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
| Например, при взаимодействии этилена с бромоводородом образуется бромэтан. |

При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. |
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен. |
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
| Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида) |
| Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида |
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |

2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
| Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия: |
| Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон: |
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
| Например, уравнение сгорания пропилена: |
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500 о С или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
| Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1 |
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Источник