- Практ. 1
- Получение этилена и опыты с ним методическая разработка по химии (10 класс) на тему
- Скачать:
- Предварительный просмотр:
- Cоединения йода
- Йодоводород, йодоводородная кислота (HI)
- Иодноватистая кислота (HIO)
- Иодноватая кислота (HIO3)
- Иодная кислота (HIO4)
- Пентаоксид (пятиокись) иода, йодноватый ангидрид (I2O5)
- Урок — лабораторная работа по химии на тему «Получение этилена и изучение его свойств»
Практ. 1
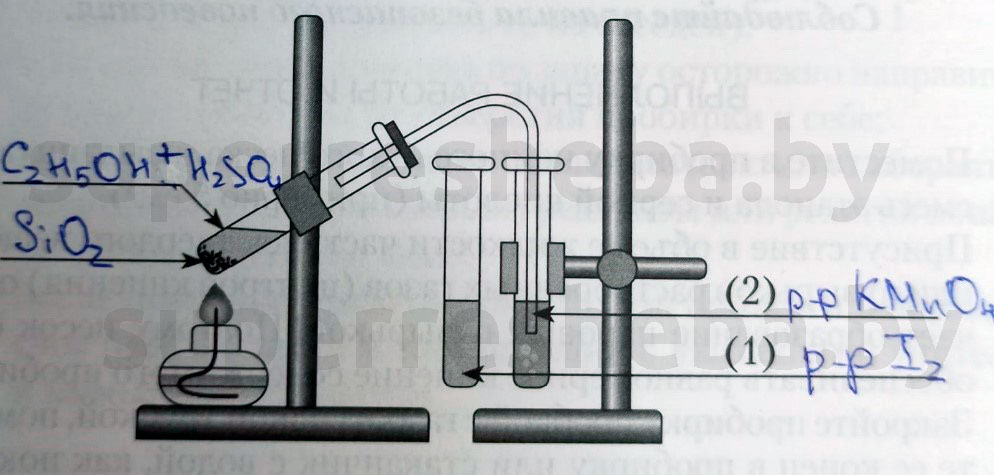
Напишите над стрелками формулы или названия веществ в пробирках.
Объясните явления, которые наблюдаются в процессе получения этилена.
В процессе получения мы наблюдали появление пузырьков газа и обесцвечивание растворов иода и перманганата калия. (Причины обесцвечивания приведены далее).
Приведите уравнение реакции получения этилена.
+ ° C 2 H 4 ↑ + H 2 O .
Объясните явления, наблюдаемые при пропускании этилена в пробирки с растворами иода (1) и перманганата калия (2).
В процессе получения этилена мы наблюдали обесцвечивание растворов иода и перманганата калия, потому что образовывались бесцветные продукты реакции. Раствор перманганата обесцвечивался, т.к. в ходе реакции перманганат переходил в щелочь и оксид марганца (IV), а раствора иода – потому что молекулы иода встраивались в молекулу этилена.
Приведите уравнения реакции этилена с раствором иода.
Приведите схему реакции этилена с раствором K M n O 4 \mathrm
Приведите уравнение реакции горения этилена.
1. Напишите, благодаря наличию какого структурного фрагмента в молекулах алкенов они вступают в реакции с иодной и бромной водой. К какому типу относятся данные реакции?
Алкены вступают в реакции с иодной и бромной водой благодаря наличию двойной связи. Эти реакции относятся к реакциям присоединения.
2. В каких условиях реагируют с бромом алканы? К какому типу относится реакция алканов с бромом?
Алканы реагируют с бромом на свету. Это реакция замещения.
3. Сравните отношение к бромной воде алканов и алкенов. Можно ли различить этан и этен при помощи бромной воды?
Да, можно. При пропускании этана через бромную воду раствор брома не будет обесцвечиваться, а при пропускании этена — будет.
Источник
Получение этилена и опыты с ним
методическая разработка по химии (10 класс) на тему
Практическая работа по химии
Скачать:
| Вложение | Размер |
|---|---|
| poluchenie_etilena_i_opyty_s_nim.doc | 197.5 КБ |
Предварительный просмотр:
«Получение этилена и опыты с ним»
Цель: уметь получать этилен в лабораторных условиях, доказывать его наличие, подтверждая химическими реакциями, пользоваться химическим оборудованием и реактивами.
Оборудование : металлический штатив, спиртовка, спички, лучинка, штатив с пробирками.
Реактивы: этиловый спирт – С 2 Н 5 ОН, H 2 SO 4 — концентрированная, раствор КМnO 4 , йодная вода, песок прокаленный.
Правила техники безопасности
Осторожно работайте с химическим оборудованием!
Осторожно обращайтесь с концентрированной серной кислотой H 2 SO 4 !
- Запрещается пробовать вещества на вкус (а);
- брать вещества руками (б);
- менять пробки и пипетки от различных банок или склянок (в);
- надо работать только над столом (г);
- смыть водой, затем нейтрализующим веществом реактив, если он попал на кожу или одежду (д);
Прежде чем выполнять работу ответьте на вопросы и используйте их в формулировке выводов:
- Почему серная кислота, применяющаяся в опыте, должна быть концентрированной?
- К какому классу углеводородов относиться этилен? Как это можно доказать?
- Почему этилен легко обесцвечивает йодную воду и раствор перманганата калия, а метан не обесцвечивает их?
Опыт 1. Получение этилена
- Рассмотрите и соберите прибор как показано на рисунке, проверьте его на герметичность.
- Отмерьте мерным цилиндром 1мл этилового спирта и перелейте в пробирку, затем осторожно добавьте 3 мл концентрированной серной кислоты.
- Поместите в смесь немного предварительно прокаленного песка (или кусочек пемзы), чтобы избежать толчков жидкости при кипении
- Закройте пробирку пробкой с газоотводной трубкой и укрепите в штативе. Конец газоотводной трубки опустите в пробирку с йодной водой (бромной водой).
- Осторожно нагревайте смесь!
- Оформите работу в соответствии с образцом (табл.1)
- Опишите физические свойства этилена:
- Агрегатное состояние
- Цвет
- Запах
Опыт 2. Взаимодействие этилена с йодной (бромной) водой
• Пропускайте этилен через 1-2 мл йодной (бромной) воды.
• Следите, чтобы нагревание смеси не прекращалось. Не допускайте переброс жидкости из пробирки в прибор.
• Какие изменения происходят с йодной (бромной) водой? Объясните наблюдаемое явление.
Опыт 3. Взаимодействие этилена с раствором перманганата калия
• Пропускайте газ через 1-2 мл раствора перманганата калия.
• Объясните, что наблюдаете?
Опыт 4. Горение этилена на воздухе
• Выньте газоотводную трубку из раствора, и повернув её отверстием к верху, подожгите выделяющийся газ.
• Каким (светящимся или несветящимся) пламенем горит этилен? Дайте объяснение.
• Потушите спиртовку. Выделение этилена постепенно прекратится.
Рисунок с соответствующими надписями. Наблюдения.
Источник
Cоединения йода
Йодоводород, йодоводородная кислота (HI)
Способы получения йодоводорода
В промышленности
- Взаимодействие йода с гидразином:
- Взаимодействие простых веществ происходит только при нагревании и протекает не до конца:
В лаборатории
- Вытеснение HI из йодидов ортофосфорной кислотой:
- гидролиз галогенидов неметаллов
- восстановление свободного йода:
Физические свойства йодоводорода
Водный раствор HI — иодоводородная кислота. Это бесцветная жидкость с резким запахом. Иодоводородная кислота является сильной кислотой.
В 100 г воды при обычном давлении и 20 °C растворяется 132 г HI, а при 100 °C — 177 г.
Химические свойства йодоводорода
Йодоводород – сильный восстановитель.
- Окисляется кислородом воздуха, приобретая бурый цвет:
- Взаимодействует с концентрированной серной кислотой с образованием сероводорода и свободного йода:
- Окисляется другими неметаллами:
- Окисляется даже слабыми окислителями:
- Присоединяется к кратным связям органических соединений (реакция электрофильного присоединения):
HI + CH3 – CH = CH2 → CH3 – CHI – CH3
- Образуют полииоды, присоединяя элементарный иод:
Кислородные кислоты и окислы иода
Иодноватистая кислота (HIO)
Иодноватистая кислота HIO — существует только в очень разбавленных растворах, окрашена в зеленоватый цвет. Очень неустойчива.
Получение йодноватистой кислоты
Образуется при взаимодействии иода с водой. Реакция обратима, а равновесие сильно сдвинуто в сторону исходных веществ:
Химические свойства йодноватистой кислоты
- Проявляет амфотерные свойства – слабая кислота и слабое основание. Диссоциирует и как кислота, и как основание:
- Разлагается при комнатной температуре с течением времени:
- Разлагается щелочами:
3HIO + 3NaOH = 2NaI + NaIO3 + 3H2O
Соли иодноватистой кислоты называют гипоиодитами.
Иодноватая кислота (HIO3)
Йодноватая кислота HIO3— белое кристаллическое вещество со стеклянным блеском и горьковато-кислым вкусом. При обычной температуре устойчива. Сильная одноосновная кислота, имеющая склонность к полимеризации в концентрированных растворах
Получение иодноватой кислоты
Получают в водных растворах при окислении иода хлором, пероксидом водорода либо дымящей азотной кислотой:
Химические свойства йодноватой кислоты
- хорошо растворима в воде:
- При медленном нагревании до 110ºС она частично плавится, частично образует ангидроиодноватую кислоту HI3O8.
При нагревании HIO3 выше 230°C образует порошок иодноватого ангидрида I2O5, при растворении в воде, которого вновь образуется иодноватая кислота:
- Нейтрализуется щелочами:
- Проявляет окислительные свойства:
- При электролизе йодноватой кислоты образуется йодная кислота:
Соли иодноватой кислоты — иодаты
- Они довольно устойчивы и разлагаются при температуре выше 400 °C.
- Обладают сильными окислительными свойствами в кислой среде:
- При электролизе раствора иодаты распадаются на водород и периодаты:
Иодная кислота (HIO4)
Иодная кислота HIO4 — белое гигроскопичное кристаллическое вещество. В водном растворе Н5IO6 является слабой кислотой. В растворах образует гидраты состава mHIO4•nН2О, например, H3IO5, H4I2O9, H5IO6 и т. д Их устойчивость зависит от концентрации раствора. Проявляет сильные окислительные свойства
Получение йодной кислоты
- При воздействии хлорной кислоты на иод в присутствии катализатора:
- Электролизом раствора иодноватой кислоты:
Химические свойства йодной кислоты
- При растворении в воде образует гидраты:
- НIO4 разлагается при нагревании выше 122ºС:
- Щелочами нейтрализуется не полностью:
- Сильные окислительные свойства:
Cоли йодной кислоты — периодаты
Йодная кислота может образовать соли, содержащие ионы, IO6 5− , IO5 3− , IO4 — и I2O9 4− — соответственно орто-, мезо-, мета- и дипериодаты.
Получение периодатов
Периодаты можно получить при окислении иодатов сильными окислителями в щелочной среде:
Химические свойства периодатов
- Периодаты — сильные окислители, при нагревании выше 300ºС разлагаются с выделением кислорода:
- Разлагаются концентрированными кислотами:
- Разлагаются концентрированными щелочами:
- Проявляют окислительные свойства:
Оксиды йода
Пентаоксид (пятиокись) иода, йодноватый ангидрид (I2O5)
Иодноватый ангидрид I2O5 – белое, гигроскопичное вещество. На свету темнеет из-за частичного разложения.
Получение пентаоксида йода
Получают при медленном нагревании йодноватой или йодной кислоты
Химические свойства пентаоксида йода
- На свету разлагается:
- Как кислотный оксид реагирует с водой, со щелочами:
- Легко фторируется:
- Восстанавливается монооксидом углерода:
Источник
Урок — лабораторная работа по химии на тему «Получение этилена и изучение его свойств»
Лабораторная работа № 3. Получение этилена и изучение его свойств.
Научиться получать этилен в лаборатории путём нагревания смеси этилового спирта с концентрированной серной кислотой и проводить качественные реакции на непредельные углеводороды этиленового ряда, изучить свойства этилена.
Реактивы и оборудование:
Прибор для получения газов, водный раствор перманганата калия, раствор брома в воде (бромная вода), реакционная смесь этилового спирта и серной концентрированной кислоты (1:3), спиртовка, спички.
1. Получение этилена дегидратацией этилового спирта.
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
В пробирку налейте 2-3 мл этилового спирта и осторожно добавьте 6-9 мл концентрированной серной кислоты. Затем всыпьте немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении). Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки (рис.53). Что вы наблюдаете?
Осторожно, равномерно нагрейте смесь.
Соблюдайте осторожность. Вы работаете с концентрированной серной кислотой.
2. Окисление этилена кислородом перманганата калия
В другую пробирку налейте 2-3 мл разбавленного раствора перманганата калия, и пропустите через него газ. Что при этом наблюдаете?
3. Взаимодействие этилена с бромной водой.
В третью пробирку налейте 2-3 мл бромной воды , опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете?
4. Окисление этилена кислородом воздуха (горение) Вынув газоотводную трубку из раствора и повернув ее отверстием кверху, подожгите выделяющийся газ. Каким пламенем горит этилен? Почему?
5. Оформите работу в тетради в виде таблицы:
Название опыта
Что делали. Ваши наблюдения
Уравнение реакции, выводы
1. Получение этилена дегидратацией этилового спирта.
Какой газ выделяется?
Закончите уравнение реакции:
Каким способом в лаборатории получают этилен?
Какую роль при этом играет серная кислота?
2. Окисление этилена кислородом перманганата калия.
Что происходит с раствором марганцовки?
Закончите уравнение реакции:
О чем свидетельствует изменение окраски раствора перманганата калия?
3. Взаимодействие этилена с бромной водой.
Что происходит с бромной водой?
Закончите уравнение реакции:
О чем свидетельствует изменение окраски раствора бромной воды?
4. Окисление этилена кислородом воздуха (горение).
Почему этилен горит более светящимся пламенем, чем метан?
Закончите уравнение реакции:
Что можно сказать о содержании углерода в этилене?
6. Общий вывод о проделанной работе: (из цели)
При взаимодействии этилена с бромной водой, красно-бурый раствор бромной воды обесцвечивается. Эта реакция является качественной на двойную связь.
При окислении этилена водным раствором перманганата калия образуется этиленгликоль. Заметно, что фиолетовая окраска раствора исчезает. Реакция является качественной на двойную связь.
В отличие от метана этилен горит светящимся пламенем, что обусловливается повышенным содержанием углерода
Урок химии проведённый в 10 классе с использованием компьютерных
Тема : «Получение этилена и опыты с ним.»
Цели урока : знать свойства этилена, способы его получения ,правила техники безопасности. Уметь получать этилен в лабораторных условиях, доказывать его наличие, подтверждая химическими реакциями, пользоваться химическим оборудованием и реактивами; продолжить работу по воспитанию патриотических чувств, гордость за достижения отечественной науки.
Оборудование: металлический штатив ,спиртовка ,спички, лучинка, штатив с пробирками, прибор для получения газа, ученические тетради ,ПК с мультимедийный проектором, CD «Виртуальная химия», презентация, инструктивные карточки.
Реактивы: этиловый спирт ,серная кислота –концентрированная, раствор перманганата калия, йодная вода, песок прокалённый.
Тип урока: практическая работа.
Организационная форма урока: комбинированный ( исследовательская работа)
Предварительно учащиеся получают домашнее задание, связанное с изучением содержания предстоящей практической работой. Для подготовки к работе необходимо использовать материал учебника 10- класса автор О.С. Габриелян (п.12); подготовить сообщение о учёном химике Е.Е. Вагнере.
1. Организационный момент. 2. Основная часть:
2. 1.Первый слайд презентации.(Сообщение темы урока, учащиеся из темы формулируют цель урока. Разбираем правила технике безопасности.
Учащиеся делаю запись темы, цели оборудования и реактивов в тетрадь.)
2.2.На основе полученной карточке приступают к практической части.
2.3.Проделав практическую часть оформляют полученные данные в тетради на основе карточки- инструкции( карточка инструкция прилагается)
2.4 Ребята вы проделали практическую работу в реальном времени ,а давайте сейчас посмотрим эту работу виртуально ( C D диск «Виртуальная химия» Получение этилена и изучение его свойств. ) сравнение результатов
2.5.Второй слайд презентации (использование этилена.)
2.6 Сообщение ученицы «Работы И.И. Вагнера» (сообщение прилагается)
3.Подведение итогов: Делаем вывод о проделанной работе, исходя из цели.
Озвучивание результатов работы учащихся
Уборка рабочего места. Сдача тетрадей на проверку.
4. Третий слайд презентации( домашнее задание)
Егор Егорович Вагнер — родился в Казани в 1849 г. Первоначальное образование получил в частном пансионе в Лифляндии. В 1867 г. поступил в казанский университет, оставался 2 года на юридическом факультете, а затем перешел на физико-математический, который и окончил в 1874 г. со степенью кандидата. Через год был командирован в Петербург, где работал в лаборатории профессора А. М. Бутлерова. С 1882 г. по 1886 г. занимал кафедру химии в институте сельского хозяйства в Новой Александрии, а с 1886 г. ту же кафедру в варшавском университете. Его научная деятельность относится к вопросам органической химии. Один из наиболее выдающихся «химических внуков» А. М. Бутлерова, родоначальника целой школы русских химиков «структуристов». В первых своих работах рассматривал те вопросы, которые наметились общим направлением Бутлеровской школы. Однако, в своих позднейших исследованиях и, главным образом, в большом труде «О реакции окисления кетонов» и затем в работах «Об окислении непредельных соединений» и «Об окислении третичных спиртов», выдвинул на первый план вопрос о зависимости продуктов данной химической реакции от условий, в которых эта реакция происходит, и таким образом перешел к вопросам, имеющим важное значение в химической механике.
Имя Вагнера одно из выдающихся не только среди русских химиков, но и среди химиков других стран. Его диссертация «Синтез вторичных спиртов и их окисление» (1885) и докторская «К реакции окисления непредельных углеродистых соединений» (1888), из которых первая представляет свод целого ряда работ, начиная с 1874 г., являются классическими трудами и дают ряд блестящих, исчерпывающих затронутые вопросы страниц органической химии. Непосредственно вслед за этими работами он перешел к исследованию химического строения терпенов, одной из труднейших задач современной органической химии, долго не поддававшейся решению, несмотря на то, что над нею работали даже такие крупные научные силы, как Флавицкий, Канонников, Валлах, Бэйер, Бредт и др. Благодаря своему замечательному дару сразу находить верные пути исследования и воспользовавшись ранее им же разработанным методом окисления непредельных соединений марганцовокалиевой солью, он очень скоро, уже в 1894 г., успел разъяснить строение терпинеола, терпина, лимонена, карвона и дигидрокарвеола, благодаря чему «совершенно просто развязывался основной узел химического вопроса». В последующие годы ему при содействии его многочисленных учеников, работавших под непосредственным его руководством, удалось выяснить взаимные отношения между собою пинена, камфена и борнеолов и тем сильно подвинуть вопрос о строении этих соединений. Совместно с А. М. Зайцевым открыл (1875) реакцию получения вторичных и третичных спиртов действием на карбонильные соединения цинка и алкилгалогенидов. Используя эту реакцию, осуществил (1874—1884) синтез ряда спиртов. Уточнил (1885) правило окисления кетонов, сформулированное А.Н. Поповым. Открыл (1888) реакцию окисления органических соединений, содержащих этиленовую связь, действием на них 1% раствором перманганата калия. Используя этот способ, доказал непредельный характер ряда терпенов.
Егор Егорович умер в 1903 г. Последние годы жизни состоял профессором органической химии и деканом химического отделения Варшавского политехнического института. В качестве члена комитета он принимал деятельное участие в постройке этого института (1898) и устроил в нем образцовую химическую лабораторию. В 1899 г. Русское физико-химическое общество присудило Вагнеру за его ученые заслуги большую премию имени А. М. Бутлерова.
Источник