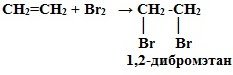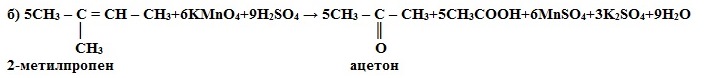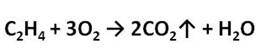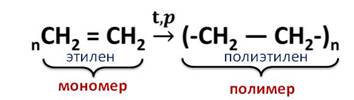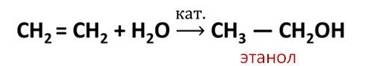- Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация.
- Практ. 1
- Алкены. Химические свойства этилена
- Урок 31. Химия 9 класс ФГОС
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Алкены. Химические свойства этилена»
Химические свойства этилена: горение, качественные реакции (обесцвечивание бромной воды и раствора перманганата калия), гидратация, полимеризация.
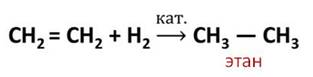
1. Гидрирование (гидрогенизация – взаимодействие с водородом):
2. Галогенирование (взаимодействие с галогенами):
Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается.
3. Гидрогалогенирование* (взаимодействие с галогенводородами):
4. Гидратация* (присоединение молекул воды):
* Присоединение галогенводородов и воды к несимметричным алкенам происходит по правилу Марковникова В.В.
Присоединение водорода происходит к наиболее гидрированному атому углерода при двойной углерод-углеродной связи.
1) Если в алкене присутствует электроноакцепторный заместитель, т.е. группа, способная оттягивать на себя электронную плотность:
2) Присоединение в присутствии Н2О2 (эффект Хараша) или органической перекиси (R-O-O-R ):
5. Реакции полимеризации:
мономер — этилен полимер – полиэтилен
Частичное окисление этилена
2. Окисление перманганатом калия (р. Вагнера) в нейтральной среде– это качественная реакция алкенов, розовый раствор марганцовки обесцвечивается.
Влияние среды на характер продуктов реакций окисления
1) Окисление в кислой среде при нагревании идёт до а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):
2) Окисление в нейтральной или слабощелочной среде на холоде (см. выше)
Применение этилена на основе свойств
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров (полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Вопросы для самоконтроля
| Задание 1 | Осуществите ряд превращений этан → этен (этилен) → этанол → этен → хлорэтан → бутан. |
| Задание 2 | Вычислите сколько литров и граммов этилена можно получить из 160 мл этанола, плотность которого равна 0,8 г/мл. |
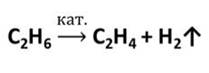
| Решение 1 | Для получения этена (этилена) из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: С2H6 →C2H4 + H2↑. Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): С2H4 + H2O = C2H5OH. Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O. Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: С2H4 + HCl → C2H5Cl. Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl. |
| Решение 2 | Этилен из этанола можно получить по реакции дегидратации, условием протекания которой является присутствие минеральных кислот (серной, фосфорной). Запишем уравнение реакции получения этилена из этанола: C2H5OH →(t, H2SO4) → C2H4 + H2O. Найдем массу этанола: m(C2H5OH) = V(C2H5OH) × ρ (C2H5OH); m(C2H5OH) = 160×0,8 = 128 г. Молярная масса (молекулярная масса одного моль) этанола, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 46 г/моль. Найдем количество вещества этанола: v(C2H5OH) = m(C2H5OH)/M(C2H5OH); v(C2H5OH) = 128/46 = 2,78 моль. Могласно уравнению реакции v(C2H5OH) : v(C2H4) = 1:1, следовательно, v(C2H4) = v(C2H5OH) = 2,78 моль. Молярная масса (молекулярная масса одного моль) этилена, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 28 г/моль. Найдем массу и объем этилена: m(C2H4) = v(C2H4) × M(C2H4); V(C2H4) = v(C2H4) ×Vm; m(C2H4) = 2,78 × 28 = 77,84 г; V(C2H4) = 2,78 ×22,4 = 62,272 л. |
| Ответ | Масса этилена – 77,84 г, объем этилена – 62,272 л. |
ПЛАН ЗАНЯТИЯ № 7
Дисциплина:Химия.
Тема:Диены и каучуки.
Цель занятия:изучить такой класс непредельных углеводородов как алкодиены, рассмотреть основные способы получения и химические свойства диеновых углеводородов, ознакомиться с такими органическими соединениями как каучуки и резина.
Предметные:владеть основополагающими химическими понятиями: непредельные углеводороды, алкадиены, натуральный и синтетический каучуки, резина, уметь давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
Метапредметные:использовать основные методов познания для выявления причинно-следственных связей;
Личностные: уметь использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности.
Норма времени:2 часа
Вид занятия:Лекция
План занятия:
1) Понятие о диенах как углеводородах с двумя двойными связями. Сопряженные диены.
2) Химические свойства бутадиена-1,3 и изопрена: обесцвечивание бромной воды и полимеризация в каучуки.
3) Натуральный и синтетические каучуки. Резина.
Оснащение:Учебник.
Литература:
13. Химия 10 класс: учеб. для общеобразоват. организаций с прил. на электрон. Носителе (DVD) / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.:Просвещение, 2014. -208 с.: ил.
14. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г. Остроумов. – 5 — изд., стер. – М.: Издательский центр «Академия», 2017. – 272с., с цв. ил.
Преподаватель:Тубальцева Ю.Н.
Тема 7. ДИЕНЫ И КАУЧУКИ.
1. Понятие о диенах как углеводородах с двумя двойными связями. Сопряженные диены.
2. Химические свойства бутадиена-1,3 и изопрена: обесцвечивание бромной воды и полимеризация в каучуки.
3. Натуральный и синтетические каучуки. Резина.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Источник
Практ. 1
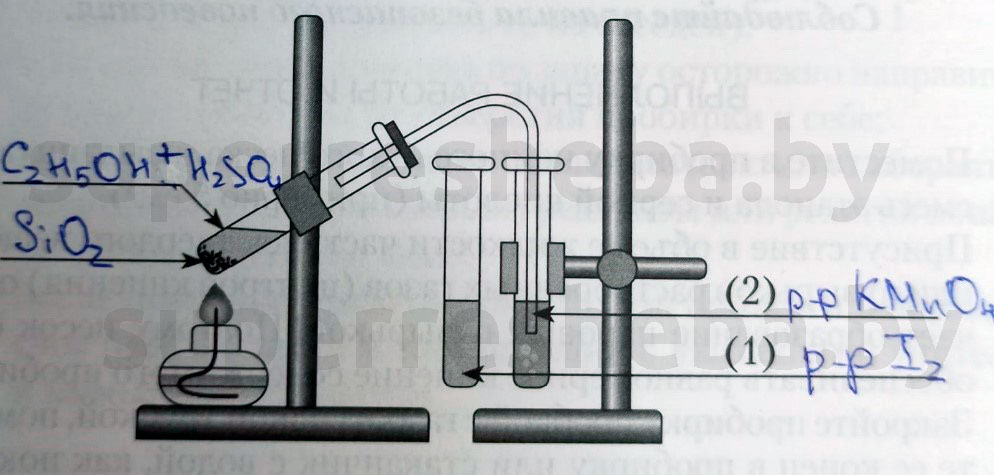
Напишите над стрелками формулы или названия веществ в пробирках.
Объясните явления, которые наблюдаются в процессе получения этилена.
В процессе получения мы наблюдали появление пузырьков газа и обесцвечивание растворов иода и перманганата калия. (Причины обесцвечивания приведены далее).
Приведите уравнение реакции получения этилена.
+ ° C 2 H 4 ↑ + H 2 O .
Объясните явления, наблюдаемые при пропускании этилена в пробирки с растворами иода (1) и перманганата калия (2).
В процессе получения этилена мы наблюдали обесцвечивание растворов иода и перманганата калия, потому что образовывались бесцветные продукты реакции. Раствор перманганата обесцвечивался, т.к. в ходе реакции перманганат переходил в щелочь и оксид марганца (IV), а раствора иода – потому что молекулы иода встраивались в молекулу этилена.
Приведите уравнения реакции этилена с раствором иода.
Приведите схему реакции этилена с раствором K M n O 4 \mathrm
Приведите уравнение реакции горения этилена.
1. Напишите, благодаря наличию какого структурного фрагмента в молекулах алкенов они вступают в реакции с иодной и бромной водой. К какому типу относятся данные реакции?
Алкены вступают в реакции с иодной и бромной водой благодаря наличию двойной связи. Эти реакции относятся к реакциям присоединения.
2. В каких условиях реагируют с бромом алканы? К какому типу относится реакция алканов с бромом?
Алканы реагируют с бромом на свету. Это реакция замещения.
3. Сравните отношение к бромной воде алканов и алкенов. Можно ли различить этан и этен при помощи бромной воды?
Да, можно. При пропускании этана через бромную воду раствор брома не будет обесцвечиваться, а при пропускании этена — будет.
Источник
Алкены. Химические свойства этилена
Урок 31. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Алкены. Химические свойства этилена»
Алкены. Химические свойства этилена
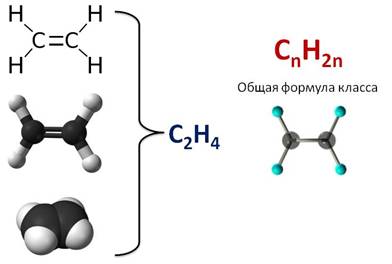
Первым представителем алкенов является этилен, или этен. Его молекулярная формула С2Н4. Из этой формулы можно выразить общую формулу этого класса – CnH2n.
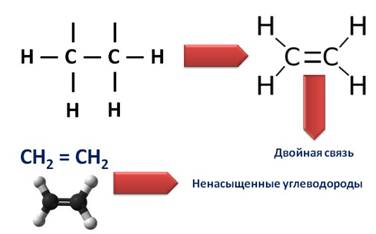
В образовании молекулы этилена участвуют два атома углерода, с каждым атомом углерода соединено два атома водорода и ещё у каждого атома углерода остаётся по одной свободной валентности, ведь атомы углерода должны быть четырёхвалентны. Поэтому между этими двумя углеродами возникает ещё одна связь. Такую связь называют двойной.
Из-за этой двойной связи этилен относят к ненасыщенным углеводородам, потому что атомы углерода не насыщены до предела атомами водорода, а образуется двойная C – C связь.
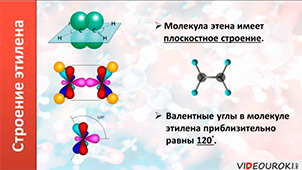
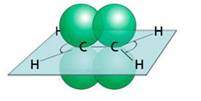
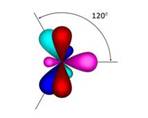
Молекула этилена плоская. Все шесть атомов молекулы лежат в одной плоскости. Экспериментально установлено, что валентные углы в молекуле этилена приблизительно равны 120 0 .
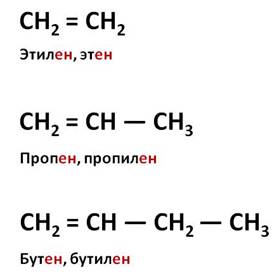
Вторым представителем гомологического ряда алкенов является пропен, или пропилен. Как вы могли заметить, в названии свех алкенов употребляется суффикс – ен. Следующим представителем алкенов является бутен, или бутилен.
По физическим свойствам этилен – газ со слабым запахом, незначительно растворяется в воде, лучше – в органических растворителях.
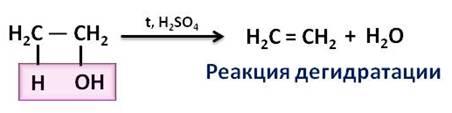
В лаборатории этилен можно получить из этилового спирта, путём отщепления от него молекулы воды. Эта реакция протекает в присутствии серной кислоты и при нагревании.
Эта реакция является реакцией дэгидратации. То есть, реакции дэгидратации – это реакции разложения, в результате которых от молекул веществ отщепляется вода.
Если поджечь выделяющийся газ, то можно заметить, что этилен горит светящимся пламенем.
Этилен в промышленности получают нагреванием при высокой температуре углеводородов, содержащихся в попутных газах нефти. Эта реакция – крекинг (от английского крэк – расщеплять).
Этилен применяют для получения пластмасс и полиэтилена.
Полиэтилен – распространённый материал, из которого изготавливают трубы, посуду, его используют как покрытие для теплиц, как упаковку для сельхозпродуктов и продуктов питания, изготовления одноразовой посуды. Этилен используют для получения этилового спирта и других растворителей.
Полиэтилен получают из этилена при высокой температуре и давлении.
Эта реакция называется реакцией полимеризации. То есть, реакции полимеризации – это реакции, в которых происходит соединение молекул исходного вещества в огромную молекулу.
Исходное вещество, которое вступает в реакцию полимеризации, называется мономером. В данном случае, это – этилен, а продукт реакции – это полимер, у нас это – полиэтилен.
Полимеризацию можно рассматривать как частный случай реакции присоединения.
Для алкенов характерны и другие реакции присоединения. Эти реакции протекают с разрывом одной из двух связей.
Например, реакция присоединения воды, которая называется реакцией гидратации.
В результате реакции гидратации этилена образуется спирт – этанол. Эта реакция протекает в присутствии катализатора.
Этанол, или этиловый спирт широко используется как растворитель, для производства каучуков, пластмасс и химических волокон.
Водород присоединяется к этилену в присутствии катализатора с образованием этана. В этой реакции разорвалась одна химическая связь в молекуле этилена и связь в молекуле водорода и образовались две новые связи Н – С в молекуле этана.
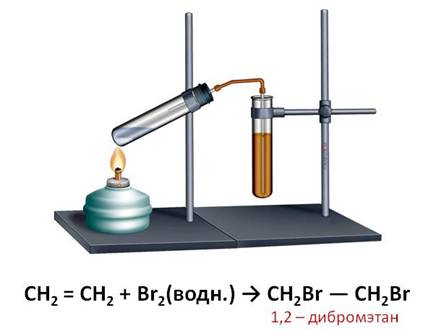
С помощью реакций присоединения можно распознать алкены. Качественными реакциями на двойную связь являются реакции обесцвечивания ими бромной воды и водного раствора перманганата калия.
Например, если пропустить через раствор бромной воды этилен, то происходит обесцвечивание бромной воды. В результате данной реакции образуется соединение – 1,2 – дибромэтан – вещество, у которого отсутствуют кратные связи.
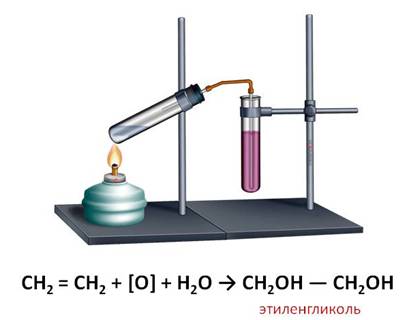
Если пропустить газ этилен через раствор марганцовки, то в данном случае, также происходит обесцвечивание этого раствора. В результате данной реакции образуется этиленгликоль.
Таким образом, молекула этилена имеет плоскостное строение, то есть все атомы находятся в одной плоскости. Валентный угол равен 120 0 . Характерными реакциями этилена являются реакции присоединения. Качественными реакциями на этилен являются реакции обесцвечивания бромной воды и водного раствора перманганата калия.
Источник