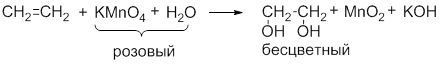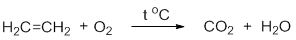- Методическая разработка практического урока по органике:ПРАКТИЧЕСКАЯ №3 Получение этилена. Взаимодействие этилена с бромной водой и с перманганатом калием
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Современные образовательные технологии в преподавании химии с учетом ФГОС
- Оставьте свой комментарий
- Подарочные сертификаты
- Этилен с бромной водой окраска
- Урок — лабораторная работа по химии на тему «Получение этилена и изучение его свойств»
Методическая разработка практического урока по органике:ПРАКТИЧЕСКАЯ №3 Получение этилена. Взаимодействие этилена с бромной водой и с перманганатом калием
ПРАКТИЧЕСКАЯ №3 Получение этилена. Взаимодействие этилена с бромной водой и с перманганатом калием
Опыт №1.Получение этилена
Р е а к т и в ы: этиловый спирт, концентрированная серная кислота
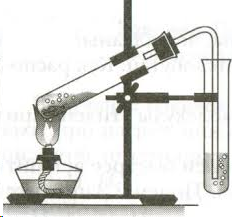
В сухую пробирку помещаем 8–10 капель концентрированной серной кислоты, 5 капель этилового спирта и несколько крупинок оксида алюминия. Пробирку закрываем пробкой с газоотводной трубкой и осторожно нагреваем в пламени горелки до начала равномерного выделения газа из реакционной смеси.
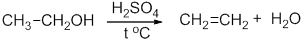
Нагревание этилового спирта с концентрированной серной кислотой сопровождается внутримолекулярной дегидратацией с образованием этилена:
Опыт №2 Взаимодействие этилена с бромной водой
и с перманганатом калием
Р е а к т и в ы: этилен, бромная вода, 1% раствор перманганата калия,
концентрированная серная кислота
Конец газоотводной трубки (предыдущий опыт) поочередно опускаем в 3 предварительно подготовленные пробирки, содержащие раствор бромной воды и 1% водный раствор перманганата калия с концентрированной серной кислотой и без неё.
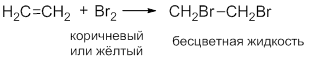
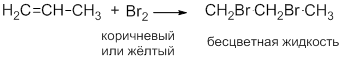
При пропускании этилена через раствор бромной воды Наблюдаем быстрое обесцвечивание желто-бурой окраски раствора:
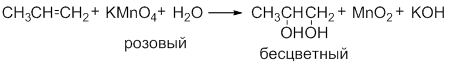
При пропускании этилена через 1% раствор перманганата калия бледно-розового цвета Наблюдаем исчезновение первоначальной окраски раствора, а в случае избытка перманганата калия – появление хлопьевидного осадка бурого цвета – оксида марганца ( IV ):
При пропускании этилена через 1% раствор перманганата калия в присутствии концентрированной серной кислоты Наблюдаем быстрое обесцвечивание раствора, бурые хлопья не образуются:
Продолжая нагревание, быстро поджигают газообразный этилен у конца газоотводной трубки. Этилен горит светящимся пламенем.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Современные образовательные технологии в преподавании химии с учетом ФГОС
Номер материала: ДБ-392883
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Российским школьникам проведут бесплатные профориентационные тесты
Время чтения: 1 минута
Рособрнадзор оставил за регионами решение о дополнительных школьных каникулах
Время чтения: 1 минута
Минобрнауки внедрит в программы вузов модуль по Великой Отечественной войне
Время чтения: 1 минута
В школе в Пермском крае произошла стрельба
Время чтения: 1 минута
РАО учредит научно-образовательный центр для подготовки научных кадров
Время чтения: 1 минута
В России объявлены нерабочие дни с 30 октября по 7 ноября
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник
Этилен с бромной водой окраска
Получение этилена и опыты с ним
Реактивы: этанол, серная кислота, бромная вода, раствор перманганата калия, речной песок.
Оборудование: штатив, спиртовка, пробирка с газоотводной трубкой, штатив с пробирками, фильтровальная бумага или вата, спички.
Схема установки:
Проведение эксперимента
В пробирку налейте 3 мл этанола и осторожно добавьте и 9 мл серной кислоты. Затем добавьте немного сухого речного песка (на кончике чайной ложки). Песок обеспечит ровное кипение жидкости, без толчков и выбросов. Вставьте в пробирку пробку с изогнутой газоотводной трубкой. Приготовьте ещё две пробирки: в первую налейте 2-3 мл разбавленного раствора перманганата калия (розовый цвет), во вторую 2-3 мл раствора брома в воде (желто-коричневый цвет). Для получения этилена пробирку с этанолом и серной кислотой осторожно нагрейте в пламени спиртовки. Продолжая нагревание, опустите конец газоотводной трубки в пробирку с перманганатом калия (трубка должна находиться ниже уровня раствора). Пропускайте этилен до полного исчезновения розовой окраски. Смените пробирку и пропустите этилен через раствор бромной воды до полного обесцвечивания раствора брома. Уберите пробирку с обесцвеченным раствором. Протрите конец газоотводной трубки ватой или фильтровальной бумагой, поверните трубку вверх и подожгите выделяющийся газ. Обратите внимание на цвет пламени.
Реакция дегидратации этанола:
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромэтан.
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-этандиол (этиленгликоль).
Получение пропилена и опыты с ним
Пропилен получают аналогично этилену.
В пробирку помещают 3-4 мл изопропилового спирта и 9-12 мл серной кислоты. Осторожно нагревают. Выделяющийся газ пропускают через растворы бромной воды и перманганата калия, наблюдают исчезновение окраски растворов. Поджигают газ у конца газоотводной трубки.
Обесцвечивание раствора Br2:
Исчезает окраска брома и образуется 1,2-дибромпропан.
Обесцвечивание водного раствора KMnO4 (без нагревания):
Исчезает окраска перманганата калия и образуется 1,2-пропандиол (пропиленгликоль).
Источник
Урок — лабораторная работа по химии на тему «Получение этилена и изучение его свойств»
Лабораторная работа № 3. Получение этилена и изучение его свойств.
Научиться получать этилен в лаборатории путём нагревания смеси этилового спирта с концентрированной серной кислотой и проводить качественные реакции на непредельные углеводороды этиленового ряда, изучить свойства этилена.
Реактивы и оборудование:
Прибор для получения газов, водный раствор перманганата калия, раствор брома в воде (бромная вода), реакционная смесь этилового спирта и серной концентрированной кислоты (1:3), спиртовка, спички.
1. Получение этилена дегидратацией этилового спирта.
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
В пробирку налейте 2-3 мл этилового спирта и осторожно добавьте 6-9 мл концентрированной серной кислоты. Затем всыпьте немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении). Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки (рис.53). Что вы наблюдаете?
Осторожно, равномерно нагрейте смесь.
Соблюдайте осторожность. Вы работаете с концентрированной серной кислотой.
2. Окисление этилена кислородом перманганата калия
В другую пробирку налейте 2-3 мл разбавленного раствора перманганата калия, и пропустите через него газ. Что при этом наблюдаете?
3. Взаимодействие этилена с бромной водой.
В третью пробирку налейте 2-3 мл бромной воды , опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете?
4. Окисление этилена кислородом воздуха (горение) Вынув газоотводную трубку из раствора и повернув ее отверстием кверху, подожгите выделяющийся газ. Каким пламенем горит этилен? Почему?
5. Оформите работу в тетради в виде таблицы:
Название опыта
Что делали. Ваши наблюдения
Уравнение реакции, выводы
1. Получение этилена дегидратацией этилового спирта.
Какой газ выделяется?
Закончите уравнение реакции:
Каким способом в лаборатории получают этилен?
Какую роль при этом играет серная кислота?
2. Окисление этилена кислородом перманганата калия.
Что происходит с раствором марганцовки?
Закончите уравнение реакции:
О чем свидетельствует изменение окраски раствора перманганата калия?
3. Взаимодействие этилена с бромной водой.
Что происходит с бромной водой?
Закончите уравнение реакции:
О чем свидетельствует изменение окраски раствора бромной воды?
4. Окисление этилена кислородом воздуха (горение).
Почему этилен горит более светящимся пламенем, чем метан?
Закончите уравнение реакции:
Что можно сказать о содержании углерода в этилене?
6. Общий вывод о проделанной работе: (из цели)
При взаимодействии этилена с бромной водой, красно-бурый раствор бромной воды обесцвечивается. Эта реакция является качественной на двойную связь.
При окислении этилена водным раствором перманганата калия образуется этиленгликоль. Заметно, что фиолетовая окраска раствора исчезает. Реакция является качественной на двойную связь.
В отличие от метана этилен горит светящимся пламенем, что обусловливается повышенным содержанием углерода
Урок химии проведённый в 10 классе с использованием компьютерных
Тема : «Получение этилена и опыты с ним.»
Цели урока : знать свойства этилена, способы его получения ,правила техники безопасности. Уметь получать этилен в лабораторных условиях, доказывать его наличие, подтверждая химическими реакциями, пользоваться химическим оборудованием и реактивами; продолжить работу по воспитанию патриотических чувств, гордость за достижения отечественной науки.
Оборудование: металлический штатив ,спиртовка ,спички, лучинка, штатив с пробирками, прибор для получения газа, ученические тетради ,ПК с мультимедийный проектором, CD «Виртуальная химия», презентация, инструктивные карточки.
Реактивы: этиловый спирт ,серная кислота –концентрированная, раствор перманганата калия, йодная вода, песок прокалённый.
Тип урока: практическая работа.
Организационная форма урока: комбинированный ( исследовательская работа)
Предварительно учащиеся получают домашнее задание, связанное с изучением содержания предстоящей практической работой. Для подготовки к работе необходимо использовать материал учебника 10- класса автор О.С. Габриелян (п.12); подготовить сообщение о учёном химике Е.Е. Вагнере.
1. Организационный момент. 2. Основная часть:
2. 1.Первый слайд презентации.(Сообщение темы урока, учащиеся из темы формулируют цель урока. Разбираем правила технике безопасности.
Учащиеся делаю запись темы, цели оборудования и реактивов в тетрадь.)
2.2.На основе полученной карточке приступают к практической части.
2.3.Проделав практическую часть оформляют полученные данные в тетради на основе карточки- инструкции( карточка инструкция прилагается)
2.4 Ребята вы проделали практическую работу в реальном времени ,а давайте сейчас посмотрим эту работу виртуально ( C D диск «Виртуальная химия» Получение этилена и изучение его свойств. ) сравнение результатов
2.5.Второй слайд презентации (использование этилена.)
2.6 Сообщение ученицы «Работы И.И. Вагнера» (сообщение прилагается)
3.Подведение итогов: Делаем вывод о проделанной работе, исходя из цели.
Озвучивание результатов работы учащихся
Уборка рабочего места. Сдача тетрадей на проверку.
4. Третий слайд презентации( домашнее задание)
Егор Егорович Вагнер — родился в Казани в 1849 г. Первоначальное образование получил в частном пансионе в Лифляндии. В 1867 г. поступил в казанский университет, оставался 2 года на юридическом факультете, а затем перешел на физико-математический, который и окончил в 1874 г. со степенью кандидата. Через год был командирован в Петербург, где работал в лаборатории профессора А. М. Бутлерова. С 1882 г. по 1886 г. занимал кафедру химии в институте сельского хозяйства в Новой Александрии, а с 1886 г. ту же кафедру в варшавском университете. Его научная деятельность относится к вопросам органической химии. Один из наиболее выдающихся «химических внуков» А. М. Бутлерова, родоначальника целой школы русских химиков «структуристов». В первых своих работах рассматривал те вопросы, которые наметились общим направлением Бутлеровской школы. Однако, в своих позднейших исследованиях и, главным образом, в большом труде «О реакции окисления кетонов» и затем в работах «Об окислении непредельных соединений» и «Об окислении третичных спиртов», выдвинул на первый план вопрос о зависимости продуктов данной химической реакции от условий, в которых эта реакция происходит, и таким образом перешел к вопросам, имеющим важное значение в химической механике.
Имя Вагнера одно из выдающихся не только среди русских химиков, но и среди химиков других стран. Его диссертация «Синтез вторичных спиртов и их окисление» (1885) и докторская «К реакции окисления непредельных углеродистых соединений» (1888), из которых первая представляет свод целого ряда работ, начиная с 1874 г., являются классическими трудами и дают ряд блестящих, исчерпывающих затронутые вопросы страниц органической химии. Непосредственно вслед за этими работами он перешел к исследованию химического строения терпенов, одной из труднейших задач современной органической химии, долго не поддававшейся решению, несмотря на то, что над нею работали даже такие крупные научные силы, как Флавицкий, Канонников, Валлах, Бэйер, Бредт и др. Благодаря своему замечательному дару сразу находить верные пути исследования и воспользовавшись ранее им же разработанным методом окисления непредельных соединений марганцовокалиевой солью, он очень скоро, уже в 1894 г., успел разъяснить строение терпинеола, терпина, лимонена, карвона и дигидрокарвеола, благодаря чему «совершенно просто развязывался основной узел химического вопроса». В последующие годы ему при содействии его многочисленных учеников, работавших под непосредственным его руководством, удалось выяснить взаимные отношения между собою пинена, камфена и борнеолов и тем сильно подвинуть вопрос о строении этих соединений. Совместно с А. М. Зайцевым открыл (1875) реакцию получения вторичных и третичных спиртов действием на карбонильные соединения цинка и алкилгалогенидов. Используя эту реакцию, осуществил (1874—1884) синтез ряда спиртов. Уточнил (1885) правило окисления кетонов, сформулированное А.Н. Поповым. Открыл (1888) реакцию окисления органических соединений, содержащих этиленовую связь, действием на них 1% раствором перманганата калия. Используя этот способ, доказал непредельный характер ряда терпенов.
Егор Егорович умер в 1903 г. Последние годы жизни состоял профессором органической химии и деканом химического отделения Варшавского политехнического института. В качестве члена комитета он принимал деятельное участие в постройке этого института (1898) и устроил в нем образцовую химическую лабораторию. В 1899 г. Русское физико-химическое общество присудило Вагнеру за его ученые заслуги большую премию имени А. М. Бутлерова.
Источник