- Этилацетат
- Содержание
- Получение
- Физические свойства
- Применение
- Лабораторное применение
- Очистка и сушка
- Безопасность
- Примечания
- Полезное
- Смотреть что такое «Этилацетат» в других словарях:
- Что такое Этилацетат и где его применяют?
- Этилацетат обладает следующими свойствами:
- Применение в фармации
- Применение в промышленности
- Acetyl
Этилацетат
| Этилацетат | |
 | |
 | |
| Общие | |
|---|---|
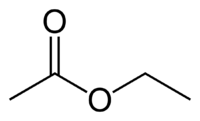
| Химическая формула | C4H8O2 |
| Физические свойства | |
| Молярная масса | 88,11 г/моль |
| Плотность | 0,902 г/см³ |
| Термические свойства | |
| Температура плавления | -84 °C |
| Температура кипения | 77 °C |
| Оптические свойства | |
| Показатель преломления | 1,3720 |
| Классификация | |
| Рег. номер CAS | 141-78-6 |
| SMILES | CCOC(C)=O |
Содержание
Получение
Лабораторный метод получения этилацетата заключается в ацетилировании этилового спирта хлористым ацетилом или уксусным ангидридом:
К промышленным способам синтеза этилацетата относятся:
- Перегонка смеси этилового спирта, уксусной и серной кислот.
- Обработке этилового спирта кетеном.
- По реакции Тищенко из ацетальдегида при 0-5 °C в присутствии каталитических количеств алкоголята алюминия:
Физические свойства
Бесцветная подвижная жидкость с приятным сладковатым запахом. Молярная масса 88.11г/моль, температура плавления −83.6 °C, температура кипения 77,1 °C, плотность 0.9001 г/см³, n 20 4 1.3724. Растворяется в воде 12 %(по массе), в этаноле, диэтиловым эфире, бензоле, хлороформе образует двойные азеотропные смеси с водой (т. кип. 70,4 °C, содержание воды 8,2 % по массе), этанолом (71,8; 30,8), метанолом (62,25; 44,0), изопропанолом (75,3; 21,0), CCl4 (74,7; 57), циклогексаном (72,8; 54,0) и тройную азеотропную смесь Э.: вода:этанол (т. кип. 70,3 °C, содержание соотв. 83,2, 7,8 и 9 % по массе). [1]
Применение
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель нитратов целлюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи. Годовое мировое производство в 1986 году составляло 450—500 тысяч тонн.
Один из самых популярных ядов, применяемых в энтомологических морилках для умерщвления насекомых. Насекомые после умерщвления в его парах гораздо мягче и податливее в препарировании, чем после умерщвления в парах хлороформа.
Применяется как компонент фруктовых эссенций. Зарегистрирован в качестве пищевой добавки E1504.
Лабораторное применение
Этилацетат часто используется для экстракции, а также для колоночной и тонкослойной хроматографии. Редко в качестве растворителя для проведения реакций из-за склонности к гидролизу и переэтерефикации. Для получения ацетоуксусного эфира [2]
Очистка и сушка
Продаваемый этилацетат обычно содержит воду, спирт и уксусную кислоту. Для удаления этих примесей его промывают равным объёмом 5%-ного карбоната натрия, сушат хлоридом кальция и перегоняют. При более высоких требованиях к содержанию воды несколько раз(порциями) добавляют фосфорный ангидрид, фильтруют и перегоняют, защищая от влаги. С помощью молекулярного сита 4А содержание воды в этилацетате можно довести до 0,003 %.
Безопасность
ЛД50 для крыс составляет 11.3 г/кг, показывая низкую токсичность. Пары этилацетата раздражают слизистые оболочки глаз и дыхательных путей, при действии на кожу вызывают дерматиты и экземы. ПДК в воздухе рабочей зоны 200 мг/м³. ПДК в атмосферном воздухе населенных мест 0.1 мг/м³ [3] .
Температура вспышки — 2 °C, температура самовоспламенения — 400 °C, концентрационные пределы взрыва паров в воздухе 2,1-16,8 % (по объему).
Безопасность при транспортировке. В соответстви с ДОПОГ (ADR) класс опасности 3, код по реестру ООН 1173.
Примечания
- ↑ Химическая энциклопедия, Москва 1998, стр. 494
- ↑ Органикум. Том 2. Москва, Мир, 1992, стр. 180
- ↑Предельно допустимые концентрации (ПДК)загрязняющих веществ в атмосферном воздухе населенных мест
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Этилацетат» в других словарях:
этилацетат — этилацетат … Орфографический словарь-справочник
ЭТИЛАЦЕТАТ — (уксусноэтиловый эфир) СН3СООС2Н5, бесцветная жидкость, tкип 77,1 .С. Растворитель, компонент пищевых эссенций, отдушка для мыла … Большой Энциклопедический словарь
этилацетат — сущ., кол во синонимов: 1 • растворитель (67) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
этилацетат — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN ethyl acetate … Справочник технического переводчика
ЭТИЛАЦЕТАТ — (этиловый эфир уксусной кислоты) (СН3СООС2Н5) бесцветная летучая жидкость с освежающим запахом, t =84°С, tкип = 77,1°С, плохо растворяется в воде и хорошо в органических растворителях. Применяется как растворитель эфиров целлюлозы, искусственной… … Большая политехническая энциклопедия
этилацетат — (уксусноэтиловый эфир), СН3СООС2Н5, бесцветная жидкость, tкип 77,1°C. Растворитель, компонент пищевых эссенций, отдушка для мыла. * * * ЭТИЛАЦЕТАТ ЭТИЛАЦЕТАТ (уксусноэтиловый эфир), СН3СООС2Н5, бесцветная жидкость, tкип 77,1 °С. Растворитель,… … Энциклопедический словарь
этилацетат — etilacetatas statusas T sritis chemija formulė CH₃COOC₂H₅ atitikmenys: angl. ethyl acetate rus. этилацетат ryšiai: sinonimas – etiletanoatas … Chemijos terminų aiškinamasis žodynas
Этилацетат — уксусноэтиловый эфир CH3COOC2H5, бесцветная легколетучая жидкость с приятным фруктовым запахом; tkип 77,1°С, tпл 82,4 °С, плотность 0,900 г/см3 (20°С); мало растворим в воде, хорошо в спирте, эфире, хлороформе и др. Горит; пределы… … Большая советская энциклопедия
ЭТИЛАЦЕТАТ — (этиловый эфир уксусной к ты) CH3COOC2H5; мол. м. 88,11; бесцв. жидкость с приятным запахом; т. пл. 84 … Химическая энциклопедия
ЭТИЛАЦЕТАТ — уксусноэтиловый эфир, CH3COOC2H6 бесцветная легколетучая жидкость с приятным фруктовым запахом; tnл 77,1 °С. Растворитель эфиров целлюлозы, синтетич. смол, хлор каучука, жиров, восков. компонент фруктовых эссенций, душистое в во в парфюмерии … Большой энциклопедический политехнический словарь
Источник
Что такое Этилацетат и где его применяют?
Этилацетат широко используется как растворитель, из-за низкой стоимости и малой токсичности, а также приемлемого запаха. В частности, как растворитель полиуретана, нитроцеллюлозы, ацетилцеллюлозы, жиров, восков, для чистки печатных плат, в смеси со спиртом — растворитель в производстве искусственной кожи.

Общие сведения
Этилацетат, Ethylis acetas (PhEur), Ethyl acetate (BP, USPNF), Ethyl acetate (CAS № 141-78-6) син: аcetic acid ethyl ester, acetic ester, acetic ether, acetoxyethane, aethylis acetas, aethylium aceticum, ethyl ethanoate, vinegar naphtha.
Прозрачная, бесцветная, летучая жидкость с приятным фруктовым и немного уксусным запахом, имеет приятный вкус при разведении.
Формула — C4H8O2. Молекулярная масса 88,1.
Физические, химические свойства Ethylis acetas.
Этилацетат получают медленной дистилляции смеси этилового спирта и уксусной кислоты при наличии концентрированной серной кислоты, а также из этилена при использовании катализатора (алкоголята алюминия).
Этилацетат обладает следующими свойствами:
- T самовоспламенения — 486,1°С;
- T кипения — 77°С;
- диэлектрическая постоянная — 6,11;
- плотность — 0,902 г/cм3 20°C;
- концентрационные пределы взрыва паров в воздухе — 2,2-11,5% (по объему)
- T возгорания +7,2°С (в открытой чашке), 5,0°C (в закрытой чашке)
- Т замерзания -83,6°C;
- коэффициент распределения Log P (октанол/вода) = 0,7; плотность пара — 3,04 (воздух = 1);
- растворим в воде (1: 10) при 25°С, более растворимый в воде при низких температурах, чем при высоких;
- смешивается с ацетоном, хлороформом, дихлорметаном, этиловым спиртом (95%), эфиром и с большинством других органических растворителей.
- известны такие азеотропные смеси этилацетата (93,9%) — вода (6,1%), t кип — 70,4°C; Э. (83,2%) — вода (7,8%) — этиловый спирт (9,0%), t кип — 70,3°C; Этилацетат (69,4%) — этиловый спирт (30,6%), t кип — 71,8°C; Е. (77%) — пропан-2-oл (23%), t кип — 74,8°С.
Субстанция медленно расщепляется при влажности и становится кислым; может абсорбировать до 3,3% воды (по массе).
Этилацетат распадается при нагревании, превращаясь в этиловый спирт и уксусную кислоту, с выделением едкого дыма и раздражающие пары. Он огнеопасен, пары могут перемещаться на значительные расстояния и стать источником воспламенения, могут вызвать «вспышку пламени». Щелочной гидролиз субстанции может замедляться полиэтиленгликолем и смешанными мицельнимы системами.
Этилацетат может вступать в реакцию с сильными окислителями, сильными щелочами, сильными кислотами и нитратами, вызывая огонь или вспышки, с хлоросульфоновой кислотой, лития-алюминиюгидридом, 2-хлорометилфураном.
Субстанция сохраняется в герметически закрытой таре в защищенном от света месте при температуре, не превышающей 30°C.
Применение в фармации
В фармацевтическом производстве этилацетата используется как растворитель, а также как вкусовая добавка, в частности в качестве растворителя в производстве растворов и гелей для повышения растворимости хлорталидону и изменения полиморфных кристаллических форм, полученных для пироксикама пивалата и мефенаменовой кислоты, а также как желатинирующее вещество в производстве взрывчатых веществ. Используется также при получении микросфер; был исследован как химический усилитель для трансдермального ионофореза инсулина.
Применение в промышленности
Этилацетат используют как растворитель для нитроцеллюлозы, целлулоида, алкидных, аллилового, виниловых, поливинилацетатных смол, хлоркаучука и др.; в смеси со спиртом — для растворения ацетилцеллюлозы и лаков. Для нужд пищевой промышленности субстанция главным образом используется как вкусовая добавка, как компонент фруктовых эссенций и экстрагент в пищевой промышленности; как отдушка в композициях с фруктовым запахом, в виде следов в композициях «Цикламен», «Яблоко», «Малина», «Земляника», «Хмель», «Слива», «Груша», «Банан» и др. В мылах неустойчив.
Этилацетат проявляет наркотическое действие, его пары раздражают слизистые оболочки глаз и дыхательных путей, при воздействии на кожу может вызвать дерматиты и экземы. ПДК в воздухе рабочей зоны — 200 мг/м3.
Ассортимент ООО «ЛДХим» насчитывает более 500 видов химического сырья, среди которых можно увидеть и этилацетат (марки А, высший сорт).
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |








