- Фенилаланин реагирует с водой
- Физические свойства
- Метаболизм фенилаланина в организме человека
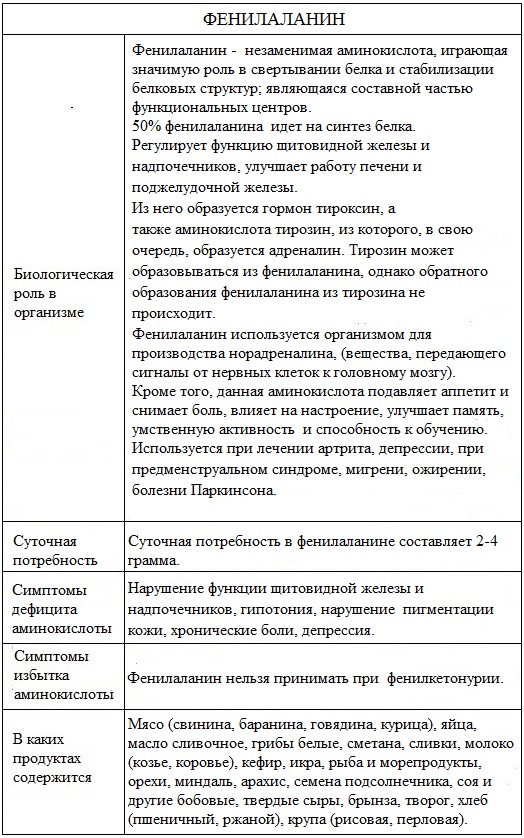
- Биологичекая роль фенилаланина для человека очень важна.
- Природные источники
- Заболевания, связанные с нарушением метаболизма фенилаланина
- Области применения
- Препараты, содержащие фенилаланин
- 3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
- Амины
- Общие особенности строения аминов
- Химические свойства предельных аминов
- Взаимодействие с кислотами
- Взаимодействие с галогеналканами
- Химические свойства анилина
- Взаимодействие анилина с кислотами
- Взаимодействие анилина с галогенами
- Взаимодействие анилина с азотистой кислотой
- Реакции алкилирования анилина
- Получение анилина
- Химические свойства аминокислот
- Кислотные свойства аминокислот
- Образование солей с щелочами и карбонатами щелочных металлов
- Этерификация аминокислот
- Основные свойства аминокислот
- Образование внутренних солей аминокислот в водном растворе
- Получение аминокислот
Фенилаланин реагирует с водой
«Великий предок» важных веществ
Фенилаланин – незаменимая ароматическая α–аминокислота.
Фенилаланин – это одна из основных 20 аминокислот, которая принимает участвие в биохимических процессах формирования протеинов и кодируется определенным геном ДНК.
Фенилаланин – 2-амино-З-фенилпропановая или α-амино-β-фенилпропионовая кислота.
Фенилаланин (Фен, Phe, F) относится к незаменимым аминокислотам, поскольку ткани животных не обладают способностью синтезировать его бензольное кольцо. Химическая формула C9H11NO2 (С6Н5СН2СН(NH2) COOH).
Фенилаланин впервые выделили из ростков люпина Э. Шульце и И. Барбиери в 1881.
Фенилаланин широко распространен в природе, встречается во всех организмах в составе молекул белков, в частности инсулина, яичного белка, гемоглобина, фибрине.
Суточная потребность в фенилаланине составляет 2-4 грамма.
Физические свойства
Фенилаланин представляет собой бесцветное кристаллическое вещество, разлагающееся при плавлении (283 0 C). Ограниченно растворяется в воде, малорастворим в этаноле.
Метаболизм фенилаланина в организме человека
В организме фенилаланин используется только в синтезе белков. Весь неиспользованный запас аминокислоты превращается в тирозин. Превращение фенилаланина в тирозин прежде всего необходимо для
удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток.
Образование тирозина не имеет большого значения, так как недостатка его в клетках практически не бывает. Тирозин полностью заменим при достаточном поступлении фенилаланина с пищей.
Фенилаланин непрерывно образуется в организме при распаде белков пищи и тканевых белков. Потребность в фенилаланине возрастает при отсутствии в пище аминокислоты тирозина.
Биологичекая роль фенилаланина для человека очень важна.
Фенилаланин является исходным сырьем синтеза другой аминокислоты – тирозина, который, в свою очередь, является предшественником адреналина, норадреналина и дофамина, а также пигмента кожи меланина.
Фенилаланин образуется в организме при распаде синтетического сахарозаменителя – аспартама, активно используемого в пищевой промышленности.
Фенилаланин обеспечивает мозг необходимым количеством вещества для биохимических процессов, которые запускаются в случае возрастания нагрузки. Происходит автоматическая стимуляция умственной деятельности, повышается обучаемость человека.
Фенилаланин связан с функцией щитовидной железы и надпочечников, участвует в образовании тироксина – основного гормона щитовидной железы. Этот гормон регулирует скорость обмена веществ, например, ускоряет «сжигание» питательных веществ, имеющихся в избытке. Фенилаланин нормализует работу щитовидной железы.
Фенилаланин играет значительную роль в синтезе таких белков, как инсулин, папаин и меланин, а также способствует выведению почками и печенью продуктов метаболизма.
Он способствует улучшению секреторной функции поджелудочной железы и печени.
Фенилаланин участвует в синтезе веществ, действие которых аналогично адреналину.
Фенилаланин входит в состав белков, выполняет функцию строительного блока белков и является важным «кирпичиком» в «строительстве» организма.
Фенилаланин входит в состав белков организма, которые составляют мышцы, сухожилия, связки и другие органы. Кроме того, он входит в состав жиросжигателей.
Это важно для тех, кто желает набрать мышечную массу. В первую очередь это касается бодибилдеров. При недостатке фенилаланина невозможно добиться хороших результатов в бодибилдинге.
Поэтому многие пищевые добавки в спортивном питании, созданные для увеличения интенсивности и максимального подъема энергии, содержат фенилаланин.
В организме фенилаланин может превращаться в другую аминокислоту – тирозин, из которого синтезируются два основных нейромедиатора: дофамин и норадреналин, которые непосредственно участвуют в передаче нервного импульса.
Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, усиливает половое влечение.
Фенилаланин стимулирует выработку меланина, поэтому принимает участие в регуляции цвета кожных покровов.
Нарушение нормального пути превращения фенилаланина приводит к развитию болезни фенилкетонурия.
Природные источники
Натуральными источниками фенилаланина являются мясо (свинина, баранина и говядина), куриное мясо и яйца, икра, рыба и морепродукты, орехи, миндаль, арахис, семена подсолнечника соя и другие бобовые, твердые сыры, брынза, творог, молоко и молочные продукты, в которых он содержится в больших количествах.
Усвоение фенилаланина повышают витамин C, B6, железо, медь и ниацин (никотиновая кислота, витамин В3, витамин РР).
Заболевания, связанные с нарушением метаболизма фенилаланина
Депрессия
Фенилаланин – важнейший «стройматериал» для нейромедиаторов, способствующих бодрости, хорошему настроению, позитивному мировосприятию и даже избавлению от боли, депрессии, апатии, вялости.
Фенилаланин является основой синтеза эндорфинов, которых называют «гормонами счастья».
Эти гормоны и нейромедиаторы вызывают положительную активацию психики, ясность и остроту мышления, приподнятое настроение, оптимистический взгляд на мир и собственную личность. Человек испытывает ощущение радости, благополучия и умиротворенности.
Более того, эндорфины облегчают хронические и острые боли, способствуют более скорому выздоровлению при различных заболеваниях.
Фенилаланин – единственное вещество, из которого может быть синтезирован фенилэтиламин, содержащийся в шоколаде и обладающий легким стимулирующим действием и одновременно оказывающим успокаивающее воздействие на психику.
Ежедневный прием фенилаланина в сочетании с витамином В6 приводил к быстрому улучшению состояния.
Хронические боли
Фенилаланина, обладает обезболивающим действием при артритах, болях в спине и болезненных менструациях.
Фенилаланин уменьшает воспаление и способен усиливать действие обезболивающих препаратов.
Витилиго
Фенилаланин способен содействовать восстановлению пигментации кожи и уменьшать обесцвеченные пятна при витилиго. При этом заболевании фенилаланин почти так же эффективен, как и тирозин.
Хорошо зарекомендовали себя кремы с фенилаланином, но для достижения лучшего результата необходимо использовать фенилалалин в сочетании с медью, необходимой организму для выработки меланина – естественного пигмента кожи.
Неврологические заболевания
Фенилаланин существенно уменьшает проявление ряда симптомов болезни Паркинсона (в частности, депрессии, расстройства речи, трудностей при ходьбе и ригидности конечностей).
Отвыкание от кофеина
Фенилаланин является хорошей заменой кофеину и помогает окончательно проснуться и стать бодрее.
Фенилкетонурия
Это распространенное наследственное заболевание, связанное с нарушением белкового обмена в организме человека.
Одно из наиболее тяжелых последствий фенилкетонурии это поражение головного мозга и сопутствующие ему нарушения психического и физического развития детей. При заболевании нарушаются обменные процессы, особенно важные для развивающегося мозга ребенка.
Общими нарушениями при наследственных дефектах обмена аминокислот являются выделение аминокислот с мочей и ацидоз тканей.
Дети, больные фенилкетонурией, нередко рождаются от здоровых родителей, которые являются носителями измененного (мутантного) гена.
При раннем выявлении болезни и правильном соблюдении диеты ребенок с фенилкетонурией может вырасти совершенно здоровым.
Фенилаланин вреден при фенилкетонурии.
Области применения
В отличие от искусственных стимуляторов (кофе, алкоголя), которые истощают запас энергии и, в последствии, приводят человека в состояние опустошенности и раздражения, эта аминокислота позволяет успешно справляться с раздражением и чувством тревоги.
Фенилаланин помогает человеку снять напряжение без применения алкоголя, тем самым делая человека менее зависимым от приема алкоголя и препаратов опия.
Фенилаланин способствует регуляции природного цвета кожи путем образования пигмента меланина. Он является необходимым при витилиго, когда происходит частичная потеря пигментации кожи. Фенилаланин помогает восстановить цвет кожи на месте бледных пятен.
Фенилаланин полезен при болезни Паркинсона (снижает тяжесть симптомов — депрессия, расстройства речи, ригидность конечностей).
Препараты, содержащие фенилаланин
L-Фенилаланин
Применяется при заболеваниях щитовидной железы, синдроме хронической усталости, депрессии, расстройстве внимания и/или гиперактивности, алкоголизме, ожирении, артрите, предменструальном синдроме, мигрени, хронических и острых болях (в том числе при онкологических заболеваниях), зависимости (от кофеина, алкоголя, наркотические), витилиго, болезни Паркинсона.
Он улучшает интеллектуальные способности, подавляет аппетит, восстанавливает пигментацию кожи.
Необходимыми для метаболизма фенилаланина веществами, стимулирующими его действие, являются витамин B6, витамин С, медь, железо и ниацин.
DL-фенилаланин
Действует как естественное болеутоляющее средство при некоторых повреждениях шейного отдела позвоночника (как от сотрясения при аварии), остеоартрите, ревматоидном артрите, болях в пояснице, мигрени, судорогах мышц рук и ног, болях после операции, невралгии.
Источник
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
| первичные | вторичные | третичные |
| R-NH2 |
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н + .
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H + .
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
2. Взаимодействие с азотистой кислотой
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Источник