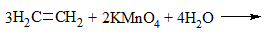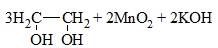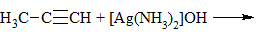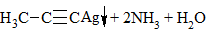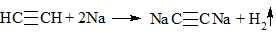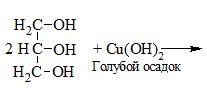- Некоторые темы органической химии для подготовки к ЕГЭ
- Задание 25. Качественные реакции (подробно)
- 4.1.5. Качественные реакции органических соединений.
- Фенол бромная вода анилин бромная вода
- Фенол бромная вода анилин бромная вода
- Органическая химия
- Качественные реакции в органической химии
- Качественные реакции на алканы
- Качественные реакции на алкены
- Качественные реакции на алкины
- Качественные реакции на альдегиды
- Качественные реакции на спирты
Некоторые темы органической химии для подготовки к ЕГЭ
Задание 25. Качественные реакции (подробно)
1. Как распознать алкены и стирол (в случае стирола в реакции вступает только двойная связь боковой цепи, а не бензольное кольцо)
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях)
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
Раствор перманганат калия фиолетового цвета. В результате реакции окраска исчезает, образуется осадок MnO2 бурого цвета.
2. Как распознать алкины
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях):
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
3C2H2 + 8KMnO4 → 3K2C2O4 + 8MnO2 + 2KOH + 2H2O (K2C2O4 — соль щавелевой кислоты)
3) + [Ag(NH3)2]OH → выпадение осадка в случае концевой тройной связи:
4) + Металл → выпадение осадка и выделение водорода в случае концевой тройной связи
3. Как распознать бензол
1) Бензол горит коптящим пламенем из-за большого содержания углерода.
Благодаря устойчивой ароматической системе бензол не вступает в реакции с водным раствором Br2 и раствором KMnO4.
4. Как распознать одноатомные спирты
1) + CuO → наблюдаем выделение металлической меди:
CH3-CH2-OH + CuO → CH3-CHO + Cu + H2O (t, окисление спиртов до альдегидов)
С основаниями одноатомные спирты не взаимодействуют.
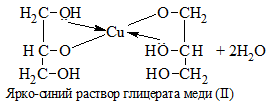
5. Как распознать многоатомные спирты
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора:
С щелочами многоатомные спирты не взаимодействуют.
6. Как распознать фенолы
1) + Br2 → выпадение белого осадка 2,4,6-трибромфенола
2) + FeCl3 → раствор фиолетового цвета
7. Как распознать альдегиды
1) + [Ag(NH3)2]OH → восстановление металлического серебра
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета
8. Как распознать карбоновые кислоты
1) раствор лакмуса → изменение окраски на красную
2) + Na2CO3/NaHCO3  → выделение газа CO2
9. Как распознать соли высших карбоновых кислот
1) + HCl (любая сильная кислота) → появление хлопьев нерастворимых высших кислот
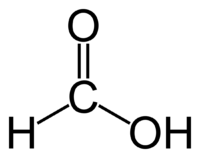
10. Как отличить муравьиную кислоту от уксусной
Муравьиная кислота содержит и альдегидную группу тоже, следовательно, возможны реакции, характерные альдегидам:
1) + [Ag(NH3)2]OH → восстановление металлического серебра и выделение газа (так как кислота окисляется до CO2)
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета и выделение газа (так как кислота окисляется до CO2).
11. Как распознать низшие амины
1) раствор лакмуса → изменение окраски на синюю (так как среда раствора щелочная)
1) раствор фенолфталеина → изменение окраски на малиновую
12. Как распознать анилин
1) + Br2 → выпадение белого осадка 2,4,6-триброманилина
13. Как распознать белок
1) + HNO3 → желтое окрашивание (ксантопротеиновая реакция)
2) + Cu(OH)2 → фиолетовое окрашивание (биуретовая реакция)
14. Как распознать глюкозу C6H12O6
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора (реакция на несколько гидроксильных групп)
2) + Cu(OH)2 → при нагревании образуется осадок Cu2O красного цвета (реакция на альдегидную группу)
3) + [Ag(NH3)2]OH → восстановление металлического серебра
15. Как распознать крахмал
1) + I2 → появление синей окраски.
Источник
4.1.5. Качественные реакции органических соединений.
| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции | ||
| Фенол | Бромная вода | |||
| Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | ||||
| Анилин | Бромная вода | |||
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) | |||
| Лакмус | Окрашивание лакмуса в красный цвет | |||
| Карбонаты, например, K2CO3 | Любая сильная неорганическая кислота или кислота средней силы H2SO4 (разб.) HCl HI HBr HNO3 (разб.) H3PO4 |
| ПРИЗНАКИ РЕАКЦИИ | ВЕЩЕСТВА |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) При взаимодействии фенола с бромной водой обесцвечивается бромная вода (исчезает окраска раствора) и выпадает белый осадок 2,4,6-трибромфенола (2).
Б) При окислении алкенов (этилен) водным раствором перманганата калия он обесцвечивается (исчезает окраска раствора) и образуется бурый осадок оксида марганца (IV) (1).
В) Алкены (пропен) обесцвечивают бромную воду (4).
Г) Многоатомные спирты (этиленгликоль) взаимодействуют с гидроксидом меди(II), образуя с ним раствор интенсивной синей окраски (5).
Бурый осадок марганца IV? Но вообще то он не бурый, а практически чёрный, бурый это тот же коричневый. (тут произошло тоже самое что рыжий и оранжевый, для цвета меха — рыжий и бурый, для всего остального оранжевый и коричневый) Вот медь, кстати, выпавшая в растворе — очень походит на бурый, а при выпадении MnO2 в осадок — я никогда бы не сказал что он бурый, он чёрный. По крайней мере при осаждении в растворе он выглядит чёрным.
как говорится, «На вкус и цвет. «
При восстановлении перманганата в нейтральной среде (образовании оксида марганца (IV)) образуется именно бурый (коричневый) осадок.
Источник
Фенол бромная вода анилин бромная вода
Органическая химия
Качественные реакции в органической химии
Качественные реакции на алканы
Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
Качественные реакции на алкены
а) Обесцвечивание перманганата калия (реакция Вагнера).
При этом этилен окисляется в двухатомный спирт этиленгликоль .
СН2=СН2 + [О] 
б) Обесцвечивание бромной воды:
Качественные реакции на алкины
а) Обесцвечивание перманганата калия (реакция Вагнера).
б) Обесцвечивание бромной воды:
в) Взаимодействие с с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса)
Получившийся ацетиленид серебра (I) выпадает в осадок.
Алкины, у которых тройная связь в середине (R-C≡C-R) в эту реакцию не вступают.
Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогащается электронной плотностью и протон становится подвижным.
Качественные реакции на альдегиды
а) Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала)
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
б) Взаимодействие с гидроксидом меди (II) (реакция медного зеркала)
Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CH 3 -CHO + 2Cu(OH) 2 —> CH 3 -COOH + Cu 2 O↓ + 2H 2 O (реакция идет при нагревании)
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
в) Взаимодействие с раствором фуксинсернистой кислоты.
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных спиртов реакции различны.
а) Окисление спирта оксидом меди.
Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
б) Взаимодействие с натрием.
Качественные реакции на многоатомные спирты
а) Взаимодействие с гидроксидом меди (II).
В отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания.
К примеру, при приливании глицерина образуется глицерат меди (II) ( хелатный комплекс темно-синего цвета):
Источник