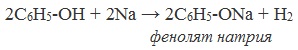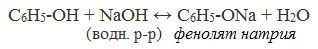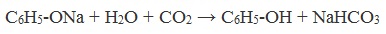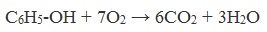Фенолы
Фенолы — кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу.
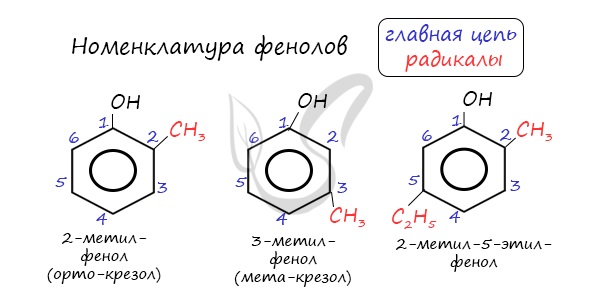
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название «фенол».
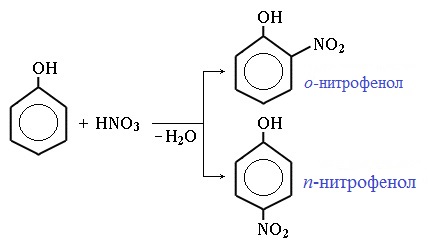
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях.
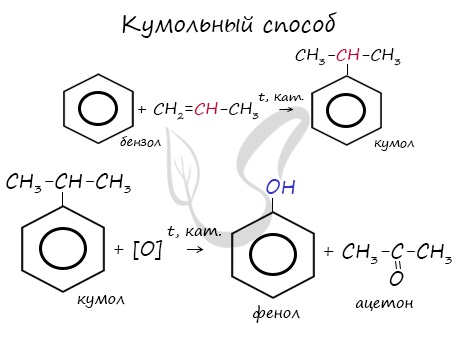
Получение фенолов
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.
Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.
Химические свойства фенолов
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей — фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)
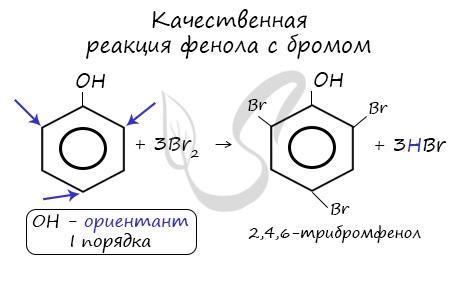
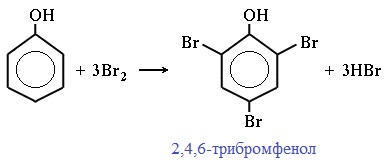
Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь — осадок трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал — нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.
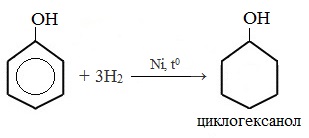
При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.
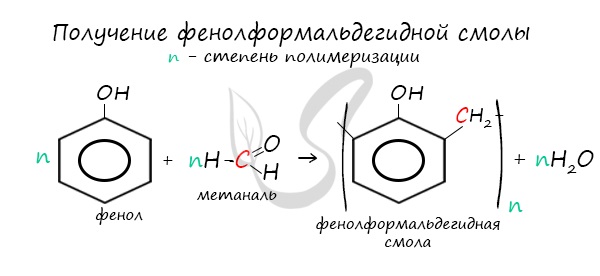
В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Фенол обесцвечивает бромную воду или
Установите соответствие между признаками качественной химической реакции и веществами, которые дают эту реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРИЗНАКИ РЕАКЦИИ | ВЕЩЕСТВА |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) При взаимодействии фенола с бромной водой обесцвечивается бромная вода (исчезает окраска раствора) и выпадает белый осадок 2,4,6-трибромфенола (2).
Б) При окислении алкенов (этилен) водным раствором перманганата калия он обесцвечивается (исчезает окраска раствора) и образуется бурый осадок оксида марганца (IV) (1).
В) Алкены (пропен) обесцвечивают бромную воду (4).
Г) Многоатомные спирты (этиленгликоль) взаимодействуют с гидроксидом меди(II), образуя с ним раствор интенсивной синей окраски (5).
Бурый осадок марганца IV? Но вообще то он не бурый, а практически чёрный, бурый это тот же коричневый. (тут произошло тоже самое что рыжий и оранжевый, для цвета меха — рыжий и бурый, для всего остального оранжевый и коричневый) Вот медь, кстати, выпавшая в растворе — очень походит на бурый, а при выпадении MnO2 в осадок — я никогда бы не сказал что он бурый, он чёрный. По крайней мере при осаждении в растворе он выглядит чёрным.
как говорится, «На вкус и цвет. «
При восстановлении перманганата в нейтральной среде (образовании оксида марганца (IV)) образуется именно бурый (коричневый) осадок.
Источник
Фенол обесцвечивает бромную воду или
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
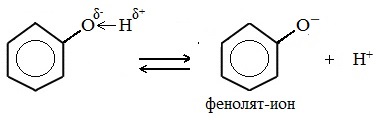
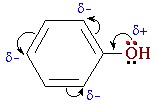
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
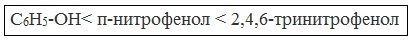
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
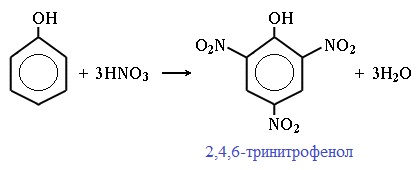
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
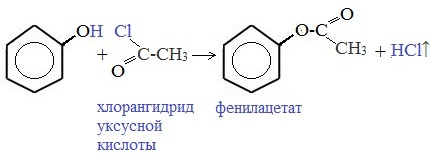
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
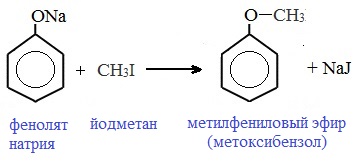
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: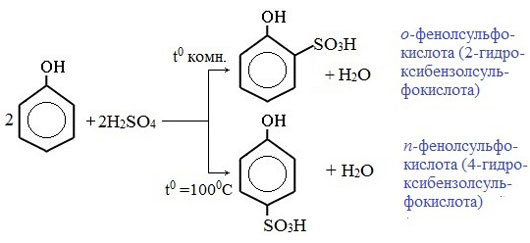
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
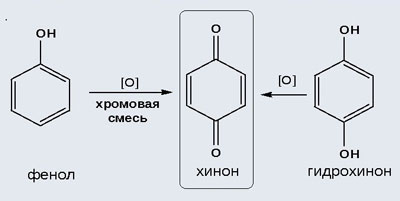
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
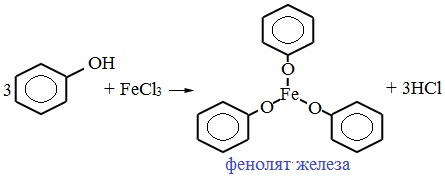
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Источник
Опыты по химии. Фенолы
Взаимодействие фенола с бромной водой
К раствору фенола в воде прильем немного бромной воды. В растворе появляется белая взвесь — выпадает осадок трибромфенола. В результате взаимного влияния атомов в молекуле фенола происходит замещение не одного, а трех атомов водорода бромом. Эта реакция является одной из качественных реакций на фенол.
Оборудование: пробирки, штатив для пробирок, шпатель.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Фенол вызывает ожог кожи. Не допускать попадания фенола на кожу.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие фенола с металлическим натрием
Также как и спирты, фенол взаимодействует со щелочными металлами. В пробирку поместим немного фенола. Нагреем фенол до плавления. При контакте металлического натрия с расплавленным фенолом происходит энергичное взаимодействие. В результате реакции образуется фенолят натрия, и выделяется водород. Эта реакция доказывает сходство фенола с одноатомными спиртами.
2С6Н5ОН + 2Na = 2C6H5ONa + H2
Оборудование: пробирка, скальпель, пинцет, фильтровальная бумага, горелка.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Фенол вызывает ожог кожи. Не допускать попадания фенола на кожу. Соблюдать правила работы со щелочными металлами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие фенола с раствором щелочи
Фенол по сравнению с одноатомными спиртами проявляет большие кислотные свойства. Он способен реагировать с растворами щелочей. К водной эмульсии фенола прильем несколько капель раствора гидроксида натрия. Образуется прозрачный раствор фенолята натрия.
С6Н5ОН + NaOH = C6H5ONa + H2О
Оборудование: пробирки, штатив для пробирок, шпатель.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Фенол вызывает ожог кожи. Не допускать попадания фенола на кожу. Соблюдать правила работы со щелочами и их растворами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Изучение физических свойств фенола
Чистый фенол – бесцветные кристаллы с характерным запахом. При хранении фенол частично окисляется и приобретает розовую или красную окраску. Проверим растворимость фенола в воде. Для этого к нескольким кристалликам фенола прибавим немного воды. Фенол мало растворим в воде. При взбалтывании образуется суспензия фенола в воде.
Оборудование: пробирки, штатив для пробирок, горелка, шпатель.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Фенол вызывает ожог кожи. Не допускать попадания фенола на кожу.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция на фенол
Качественной реакцией на фенол является реакция с хлоридом железа (III). К сильно разбавленному раствору фенола добавляем раствор хлорида железа. Жидкость в пробирке окрашивается в темно-фиолетовый цвет. С помощью этой реакции можно определить фенол даже при очень малых его концентрациях.
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Соблюдать правила работы с ядовитыми веществами. Не допускать попадания фенола на кожу.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Источник