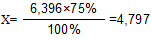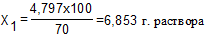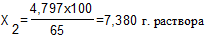Построение диаграммы растворимости системы вода-фенол



Приборы и реактивы: Фенол 75%, термометр (0-100ºС), пробирки, водяная баня, стаканчики.
Готовится 70% раствор фенола в воде. Наливаем его в широкую пробирку, опускаем термометр.
70% раствор фенола готовится из 75% раствора фенола, разбавлением его водой. Т.к. плотность 75% раствора фенола равна 1,066, то 6 мл раствора весят 6,396 г.(6х1,066=6,396г.). В 6 мл 75% раствора содержится чистого фенола 4,797 г.
Х – 75%
Количество воды, которое необходимо добавить для получения 70% раствора, рассчитывается следующим образом: 70 г. фенола содержится в 100 г раствора,
(общая масса раствора)
6,853 – 6,396 = 0,457 г. (масса воды), т.е. для получения 70% р-ра фенола необходимо к 6 мл 75% р-ра добавить 0,457 мл воды
В приготовленном 70% растворе определяем температуру гомогенизации. Для этого нагреваемпробирку с раствором на водяной бане, при помешивании и отмечаем температуру исчезновения мути. После этого пробирку вынимаем из бани и охлаждаем на воздухе, также помешивая. Теперь отмечаем температуру появления мути. (Нагревание и охлаждение раствора фенола проводят 2-3 раза, для получения точного значения температуры).
Далее готовят 65% раствор фенола разбавляя 70% раствор. Необходимое количество воды рассчитывается следующим образом:
65 г. фенола содержится в 100 г. раствора
7,380 – 6,852 = 0,527 г. воды
Следовательно, в пробирку нужно добавить 0,527 мл воды. Приготовив таким образом, раствор фенола 65% раствор фенола, определяем аналогичным образом температуру гомогенизации. Затем готовим последовательно 60%, 50% и 35% растворы фенола в воде и находим температуру гомогенизации для каждого раствора.
Для получения значений температуры гомогенизации на второй ветви кривой, готовим сначала 20% раствор фенола в воде. Наливаем в пробирку 1,5 мл 75% раствора и добавляем к нему такое количество воды, чтобы получился 20% раствор. Расчеты проводим таким образом, как было описано выше. После этого определяем для 20% раствора температуру гомогенизации. Затем последовательно готовим 14%, 10% и 8,5% растворы фенола, каждый раз добавляя необходимое количество воды, и находим температуры гомогенизации для каждого раствора.
По полученным данным строим диаграмму фенол-вода, откладывая на оси ординат температуру гомогенизации, а на оси абсцисс – состав. После этого по графику находим температуру и состав критической точки.
- Кратко описать содержание работы.
- Рассчитать количество воды, которое необходимо добавить к исходному 75% раствору фенола в воде для 70%, 65%, 60%, 50%, 35%, 20%, 14%,10% и 8,5% растворов.
- Записать значения температур гомогенизации для растворов фенола в таблицу:
1. Понятия: системы (гомогенная, гетерогенная), фаза, компонент, термодинамические параметры, термодинамическая степень свободы?
2. Правило фаз Гиббса. Вывод. Анализ.
3. Диаграмма состояния воды. Анализ диаграммы.
4. Физико-химический анализ. Суть. Принцип непрерывности, принцип соответствия.
5. Система с эвтектикой. Анализ. Кривые охлаждения.
6. Диаграмма состояния с химическим соединением, плавящимся конгруэнтно. Анализ. Кривые охлаждения.
7. Правило рычага.
8. Диаграмма состояния системы с химическим соединением, плавящимся инконгруэнтно. Анализ. Кривые охлаждения.
9. Диаграмма состояния системы с неограниченной растворимостью компонентов в твердом состоянии.
10. Ограниченно растворимые жидкости:
а) с верхней критической температурой растворения, анализ.
б) с нижней критической температурой растворения, анализ.
в) с верхней и нижней критическими температурами растворения,
11. Правило Алексеева.
Список литературы
1. Киреев В. А. Курс физической химии. 1975г.
2. Стромберг А. Г. , Семченко И. К. Практикум по физической

3. Шаталов А. Я. , Маршаков И. К. Практикум по физической
4. Краткий справочник физико-технических величин. /Под.ред.
А А. Равделя и А. М. Пономаревой. 1983г.
5. Евстратова К. И.. Купина И. А. . Малахова Е. Е.
Физическая к коллоидная химия. 1980г.
6. Голиков Г. А. Руководство по физической химии. 1998г.
7. Глазов В. М. Основы физической химии. 1982г.
Источник
Занятия 4 — 5. Определение критической температуры растворения системы «фенол-вода»
Цель работы: Определение критической температуры растворения (КТР) системы «фенол — вода».
Целевые задачи : Овладение техникой термического анализа; построение фазовой диаграммы системы «фенол — вода»; графическое определение КТР; выяснение прикладных возможностей фазовых диаграмм.
Домашнее задание к занятию 4
Занятие 4 — Фенол вода_1
Оснащение рабочего места:
Навеска фенола (отметьте точный вес)
Пробирка на 20 мл
Ртутный термометр (до 100 о С)
Пипетка на 1 мл (фото 1)

(фото 1, оснащение рабочего места)
Техника безопасности:
Во время работы будьте предельно внимательны! Фенол – летучее и токсичное вещество.
Фото 2 — Вы готовы к работе

Фото 3 — Как держать пробирку и термометр во время работы

Фото 4 — Расположение термометра

Фото 5 – Моем руки с мылом

Фото 6 – Протираем руки спиртом

Фото 7 — Слив фенола
Ход работы:

Фото 8 — Включаем водяную баню в розетку

Фото 9 — Включённая водяная баня

Фото 10 — Установка термометра

Фото 11 — Процесс плавления чистого фенола

Фото 12 — Расплавленный фенол, нагретый до температуры 50°C

Фото 13 — При помощи секундомера фиксируем температуру каждые 0,5 минут
Обратите особое внимание на точность количества воды! Ошибившись в отмеривании, вы испортите опыт, и придётся начинать всё сначала.
В пипетку при помощи груши (только не ртом!) насасывается ровно 1 мл дистиллированной воды. При внесении воды в пробирку, сливаем столько воды, сколько указанно в таблице (в первый раз — 0,25 мл).
Очень важно — не перепутайте 0,05 мл и 0,5 мл. Разница, как вы видите, очень большая. (фото 14, 15, 16, 17, 18, 19)

Фото 14 — В пипетке 1 мл дистиллированной воды

Фото 15 — В пипетке 0,25 мл

Фото 16 — В пипетке 0,5 мл

Фото 17 — В пипетке 0,05 мл – ещё раз сравните с 0,5

Фото 18 — В пипетке 0,1 мл

Фото 19 — В пипетке 0,2 мл

Фото 20 — Приоткрываем пробирку

Фото 21 — Вносим в пробирку воду
(пусть, один студент так же держит термометр с пробиркой, а другой вносит воду)
После гомогенизации (взаимного растворения воды и фенола) вынимаем её из воды и охлаждаем на воздухе до гетерогенизации (помутнения). (фото 23, 24, 25)
Для равномерного охлаждения жидкости её можно перемешивать термометром.

Фото 22 — Пробирка снова в горячей воде

Фото 23 — Гомогенная система — прозрачная

Фото 24 — Постепенно возникает помутнение
(Перемешивая раствор, придерживайте резиновую прокладку)

Фото 25 — Гетерогенная система — мутная
Сверяем результаты у преподавателя и заносим их в таблицу.

Фото 26 — Сливаем раствор с фенолом в специальный слив

Фото 27 — Моем пустую пробирку и термометр под проточной водой

Фото 28 — Чистое рабочее место
Благодарим за внимание!
Лабораторную работу выполнили студенты 1 курса 29 группы:
Источник
фенол
Фенол 99%-ной чистоты считается чистым для анализа и отвечающим требованиям фармакопеи (USP); примесь (в количестве 1%) представляет собой в основном воду. Фенол, содержащий 10-12% воды, является жидкостью. Такой фенол бывает различной степени чистоты, включая (USP). Гораздо целесообразнее приобрести фенол марки , чем заниматься очисткой загрязненных препаратов. Если необходим препарат с содержанием фенола, близким к 99.99%, то его легко можно приготовить из реактивов марки и годных для целей фармакопеи. Подвергнутый действию света, фенол становится сначала розовым, а затем красным.
Бурмен, Добни и Мартин показали, что в зависимости от способа получения фенол содержит те или иные специфические примеси. Так, например: 1) фенол, полученный сплавлением бензолсульфоновой кислоты со щелочью, содержит о- и п-оксидифенилы; 2) фенол, полученный гидролизом хлорбензола при высокой температуре, содержит дифениловый эфир; 3) фенол, выделенный из каменноугольного дегтя, содержит нафталин. Для определения чистоты и идентификации получающихся препаратов были предложены следующие методы: а) . Фенол, полученный по способу (1), дает остаток, весящий от 0.3 до 10 г, при применении же способов (2) и (3) остаток получается почти невесомым. Взвешенный остаток фенола, полученного по способу (1), был идентифицирован с помощью инфракрасных спектров, б) «500 г испытуемого препарата фенола растворяют в 800 мл раствора едкого натра (30 вес/об %) и перегоняют с водяным паром до получения 200 мл дистиллата. К дистилляту добавляют 80 мл щелочи, после чего раствор вновь перегоняют с водяным паром до тех пор, пока не будет собрано 100 мл дистиллата; к концу перегонки холодильник должен нагреться. Полученный дистиллат экстрагируют 20 мл четыреххлористого углерода и исследуют инфракрасный спектр раствора».
Ямамото и Охара получали фенол сульфированием продажного хлорбензола (т. кип. 127-133°) серной кислотой. Продукт сульфирования обрабатывали едким натром, подкисляли серной кислотой и нагревали до 230°. После охлаждения фенол-сырец всплывал на поверхность. Его экстрагировали эфиром и перегоняли. Выход составлял 54-58% от теоретического.
Дэвисон очищал фенол, о-крезол, n-крезол и нитробензол перегонкой на небольшой колонке с последующей дробной кристаллизацией дистиллата до получения препарата с постоянной температурой плавления. Препараты сохраняли в эксикаторе и перед применением вновь перегоняли с целью удаления следов воды и продуктов окисления, которые могли образоваться во время хранения.
Дрейпер и Поллард очищали фенол, добавляя к нему 12% воды, 0.1% алюминия и 0.05% бикарбоната натрия и перегоняя смесь при атмосферном давлении до удаления азеотропной смеси. Чистый фенол перегоняли затем при давлении 25 мм до тех пор, пока в перегонной колбе не оставалось приблизительно 20 мл черного остатка.
Вильяме и Огг определяли диэлектрическую постоянную и дипольный момент фенола, очищенного кристаллизацией и фракционированной перегонкой; температура кипения составляла 179.5-180.0°.
Критерии чистоты. Согласно данным Розина, препарат фенола должен удовлетворять следующим техническим требованиям:
Содержание фенола. не менее 99%
Содержание нелетучих примесей не более 0.02%
Температура застывания. не ниже 39°
Воду в феноле можно определять по способу К. Фишера.
Долик предложил использовать в качестве критерия чистоты критическую температуру растворения в воде.
Наиболее точным критерием чистоты является температура замерзания. Для определения чистоты весьма чистых препаратов фенола (99.96%) Дрейсбах и Мартин использовали кривую замерзания.
Токсикология. Жидкий фенол и пары фенола легко поглощаются кожей и слизистыми оболочками. При попадании на кожу концентрированные растворы фенола могут причинить тяжелые ожоги. Дейхман и Витерап показали, что количество поглощенного кожей фенола зависит от концентрации раствора. Действие на кожу может привести как к острому, так и к хроническому отравлению. Поражение больших участков кожи фенолом часто приводит к острому отравлению, а иногда даже к летальному исходу. Неоднократное попадание малых количеств фенола в виде паров или жидкости на кожу приводит к хроническому отравлению. У многих людей фенол вызывает аллергическое состояние.
Концентрация паров фенола в воздухе не должна превышать 0.0005%. Такая и даже более низкая концентрация фенола может быть обнаружена большинством людей и в настоящее время принята в качестве максимально допустимой.
Источник