 Химическая кунсткамера
Химическая кунсткамера
Самые эффектные и красивые опыты
5.3. Ферратный вулкан
Чтобы показать эффектный опыт – «извержение ферратного вулкана», смешивают 1 г железного порошка или железной пудры с 2 г сухого нитрата калия KNO3, предварительно растертого в ступке. Смесь помещают в углубление горки, сделанной из 4–5 столовых ложек сухого просеянного речного песка, смачивают этиловым спиртом или одеколоном и поджигают.
Начинается бурная реакция с выделением искр, буроватого дыма и сильным разогревом – почти полная картина вулканической деятельности!
При взаимодействии нитрата калия с железом образуется феррат(VI) калия K2FeO4 и газообразный монооксид азота NO, который окисляется на воздухе и дает красно-бурый газ – диоксид азота NO2:
Если твердый остаток после окончания реакции поместить в стакан с холодной кипяченой водой, получится красно-фиолетовый раствор феррата(VI) калия K2FeO4. При подкислении этого раствора происходит выделение кислорода и превращение ферратного аниона FeO4 2- в катион гексаакважелеза(III) [Fe(H2O)6] 3+ :
Ферраты – соли не существующей в индивидуальном состоянии «железной» кислоты – тетраоксоферрата(VI) водорода H2FeO4, – окрашивающей водный раствор в красно-фиолетовый цвет. Водные растворы H2FeO4 неустойчивы и при хранении постепенно разлагаются, особенно при нагревании, с выделением метагидроксида железа FeO(OH) и кислорода O2:
Соли ферраты – кристаллические вещества, окрашенные в красный или красно-фиолетовый цвет. Ферраты щелочных металлов хорошо растворимы в воде, а ферраты щелочно-земельных и других металлов малорастворимы.
Все ферраты – сильнейшие окислители, более агрессивные, чем даже перманганаты.
5.4. Угольный вулкан
Похоже на вулкан и то, что наблюдается при проведении следующего опыта. В фарфоровой чашке расплавляют 2–3 г нитрата калия KNO3 и в расплав бросают кусочек древесного угля. Уголь начинает ярко гореть, подпрыгивая над расплавом, а иногда может в очередном прыжке даже вылететь из чашки. Поэтому надо после начала опыта отойти от чашки подальше, на расстояние 1,5–2 м, а перед началом опыта нужно надеть защитные очки.
Реакция заканчивается образованием нитрита калия KNO2 и выделением диоксида углерода CO2:
Этот «вулканический» опыт будет выглядеть особенно эффектно, если показывать его в вечернем полумраке на открытом воздухе. Показывая этот и другие подобные опыты, позаботьтесь о безопасности зрителей, усадив их подальше. Помните: нельзя наклоняться над «вулканом» и прикасаться к нему, пока процесс не закончится и все вещества не остынут!
5.5. Дымящийся вулкан
На дно высокого химического стакана насыпают слой песка толщиной 3–4 см и ставят фарфоровую чашку, в которую из пипетки наливают по 10 мл концентрированной азотной кислоты HNO3 (плотность 1,50 г/мл) и концентрированной серной кислоты H2SO4 (плотность 1,84 г/мл).
Стакан с чашкой помещают в вытяжной шкаф и из пипетки приливают по каплям только что перегнанный скипидар. Каждая капля, попадая на поверхность смеси двух кислот, воспламеняется и сгорает с выделением густого черного дыма с большим количеством копоти.
Азотная кислота является окислителем скипидара, а серная кислота действует как обезвоживающее средство, ведь при сгорании скипидара образуются вода и диоксид углерода CO2.
Скипидар – бесцветная или желтоватая жидкость, смесь углеводородов сложного строения, кипящая при 155–165 °С. Несмотря на высокую температуру кипения, скипидар летуч даже при комнатной температуре. Из-за легкости его окисления кислородом воздуха скипидар полагается хранить в хорошо закупоренных сосудах.
Скипидар практически нерастворим в воде, но хорошо растворяется в этиловом спирте C2H5OH, ацетоне (CH3)2CO, диэтиловом эфире (C2H5)2O. Он прекрасный растворитель смол, масел, жиров и каучука. Скипидар – вещество с высокой реакционной способностью. Он реагирует с озоном O3, галогенами (например, с хлором Cl2), с концентрированной азотной кислотой HNO3, оксидом хрома(III) Cr2O3. Последние два вещества вызывают самовоспламенение скипидара.
Скипидар получают из природного сырья, например, путем отгонки летучей части живицы – смолы, вытекающей из надрезов коры хвойных деревьев. Твердый остаток после удаления скипидара из живицы – это канифоль.
5.6. Вулкан Шееле
В 1779 г. шведский аптекарь-химик Карл Шееле впервые получил из оливкового масла глицерин. До этого никто не подозревал о существовании подобного вещества. Шееле назвал полученную жидкость «сладким маслом». Изучая свойства глицерина, он однажды смешал его с кристаллическим перманганатом калия. Внезапно произошла вспышка смеси, которая обожгла ему лицо.
Теперь этот эффектный опыт с выбросом огня, похожий на поведение внезапно проснувшегося вулкана, осуществляют следующим образом. В фарфоровую чашку или на керамическую плитку насыпают в виде горки тщательно растертый в ступке перманганат калия KMnO4. В вершине горки делают небольшое углубление, вносят туда несколько капель глицерина C3H5(OH)3, не содержащего примеси воды, и сразу же отходят в сторону: сейчас «вулкан» проснется!
Через 1–2 мин происходит вспышка фиолетового цвета из-за разбрызгивания небольшой части KMnO4; глицерин при этом воспламеняется.
Реакция, вызвавшая вспышку, соответствует уравнению:
и сопровождается большим выделением энергии в виде теплоты и газообразных продуктов (CO2, пары воды), которые увлекают за собой раскаленные твердые частицы диоксида марганца MnO2 и карбоната калия K2CO3. Полная иллюзия извержения вулкана!

Пятнадцатилетним юношей он покинул родительский дом и поступил учеником к аптекарю Бауху из Гётеборга. В совершенстве овладев профессией аптекаря и изучив химию, Шееле перебирается в Стокгольм, затем – в Упсалу и наконец в маленький и тихий городок Чёпинг. Он посвящает себя научным изысканиям, открывая все новые и новые вещества и химические элементы. Французский химик Ж.Дюма позднее писал, что Шееле «не мог прикоснуться к какому-либо телу без того, чтобы не сделать открытия».
Шееле уже в 32 года был удостоен звания члена Королевской шведской академии наук, а по уровню знаний, приобретенных путем самообразования, превосходил многих академиков того времени. Ему неоднократно предлагали занять профессорскую должность по химии в том или ином университете Швеции, но Шееле предпочел остаться до конца своей жизни аптекарем.
Обостренная наблюдательность, богатая химическая интуиция, талант аналитика позволили Шееле обнаружить семь химических элементов: кислород O, хлор Cl, фтор F, барий Ba, молибден Mo, вольфрам W. Никто из химиков ни до, ни после не открыл так много новых элементов.
Шееле первым получил и исследовал перманганат калия KMnO4, разработал способ получения фосфора из золы костей животных, открыл сероводород H2S, впервые выделил множество неорганических и органических кислот – плавиковую (фтороводородную) HF, мышьяковую H3AsO4, синильную (циановодородную) HCN, винную C2H2(OH)2(COOH)2, щавелевую H2C2O4, молочную C2H4(OH)COOH, лимонную C3H4(OH)(COOH)3, яблочную С2H3(OH)(COOH)2 и другие вещества.
В 1775 г. Шееле стал управляющим аптекой, принадлежавшей вдове Маргарите Полер, которая позднее стала его женой буквально за два дня до его смерти.
Годы упорного самоотверженного труда подорвали здоровье этого поразительно целеустремленного человека: он прожил всего 44 года. Одни считают, что смерть его была вызвана прогрессирующей подагрой, другие – трагической попыткой определить вкус полученной им циановодородной кислоты HCN (химики того времени, получив новое вещество, всегда пробовали его на вкус). Никто тогда не знал, что HCN – один из сильнейших ядов. Шееле описал ее запах, похожий на запах миндаля, и, вероятно, погиб, определяя вкус HCN.
Источник
Феррат калия
| Структурная формула | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
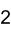 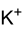  | ||||||||||||
| Общий | ||||||||||||
| Фамилия | Феррат калия | |||||||||||
| Другие названия | ||||||||||||
| Внешние идентификаторы / базы данных | ||||||||||||
| ||||||||||||
| характеристики | ||||||||||||
| Молярная масса | 198,04 г · моль -1 | |||||||||||
| Физическое состояние | ||||||||||||
| Инструкции по технике безопасности | ||||||||||||
| ||||||||||||
| Насколько это возможно и общепринято, используются единицы СИ . Если не указано иное, приведенные данные относятся к стандартным условиям . | ||||||||||||
Феррат калия (VI) — это химическое соединение от пурпурно-красного до фиолетового , которое стабильно в чистом виде .
Ион феррата (VI) (Fe VI O 4 2− ) содержит тетраэдрический атом железа, окруженный четырьмя атомами кислорода . Это комплекс с переносом заряда , который объясняет интенсивный цвет.
В этом соединении железо находится в самой высокой степени окисления . Таким образом, феррат калия является мощным окислителем , более сильным, чем перманганат калия .
Оглавление
Добыча
Для представления в лаборатории используют раствор гидроксида натрия сначала преобразуется в гипохлорит путем окисления с газообразным хлором . Затем он реагирует с раствором нитрата железа (III), и полученный раствор феррата (VI) насыщается гидроксидом натрия. Наконец, феррат калия осаждают из этого раствора концентрированным раствором гидроксида калия . Соединение может быть получено с чистотой> 98% путем переосаждения из концентрированного раствора гидроксида калия:
NaCl + NaOCl + H2O>>>»> 2 NaOH + Cl 2 ⟶ NaCl + NaOCl + ЧАС 2 О <\ displaystyle <\ ce <2 naoh + cl2 ->NaCl + NaOCl + H2O>>> 


В других методах в качестве окислителя вместо хлора используется пероксодисульфат калия или вообще не используются химические окислители, а для этой цели применяется электролиз.
характеристики
Феррат калия кристаллизуется в ромбической кристаллической структуре с пространственной группой Pnam (пространственная группа № 62, позиция 6) . Постоянные решетки : a = 769 пм, b = 1033 пм и c = 586 пм. Структура изоморфна тому из сульфата калия и хромата калия . Соединение прочно только в сухом состоянии. Очень разбавленные растворы можно хранить в течение некоторого времени, в то время как концентрированные растворы быстро разлагаются. Шаблон: room group / 62.6
Источник
Технология получения ферратов, предусматривающая использование методов низкотемпературного и высокотемпературного окисления соединений железа
Рубрика: Технические науки
Дата публикации: 15.06.2015 2015-06-15
Статья просмотрена: 3575 раз
Библиографическое описание:
Яхкинд, М. И. Технология получения ферратов, предусматривающая использование методов низкотемпературного и высокотемпературного окисления соединений железа / М. И. Яхкинд, С. Ю. Андреев, М. А. Сафронов, В. А. Князев. — Текст : непосредственный // Молодой ученый. — 2015. — № 12 (92). — С. 366-371. — URL: https://moluch.ru/archive/92/20364/ (дата обращения: 21.10.2021).
Приведен литературный обзор первых работ по получению ферратов. Показано, что ферраты могут быть получены тремя основными группами методов: высокотемпературным окислением, химическим окислением и электрохимическим окислением. Для промышленного получения феррата, предпочтительным является способ электрохимического окисления железа, отличающийся высокой экологичностью, простотой, надежностью и безопасностью.
Ключевые слова: ферраты, степень окисления, реагенты-окислители, электрохимическое окисление, высокотемпературное окисление.
В настоящее время в технологиях водоподготовки и очистки сточных вод широкое применение нашли реагенты-окислители. Одним из наиболее активных реагентов-окислителей является феррат натрия. Феррат натрия обладает окислительным потенциалом, превышающим окислительный потенциал озона. Его окислительный потенциал является наибольшим в ряду потенциалов реагентов-окислителей, используемых в настоящее время. Внедрение в практику очистки природных и сточных вод ферратов в настоящее время препятствует отсутствие экологически безопасных, простых и надежных технологий, позволяющих получить эти реагенты окислители в промышленных масштабах.
Феррат калия впервые был описан французским ученым Фреми в 1841 г. [1]. Фреми исходил из предположения, что у железа могут быть соединения со степенью окисления более высокой, чем обычная +3, по аналогии с марганцем, для которого к тому времени уже были известны манганаты и перманганаты. В своих исследованиях он использовал методы, которые, по его мнению, должны были привести к получению таких соединений железа.
В своих работах [1–3] Фреми описал несколько методов получения феррата калия, которые он отнес к двум группам:
— высокотемпературное окисление оксида железа(III) и железа в твердом виде («сухой способ» в терминологии Фреми);
— химическое окисление гидроксида железа(III) в щелочных растворах («мокрый способ»).
Для высокотемпературного окисления Фреми описал четыре варианта проведения процесса:
1) взаимодействие оксида железа(Ш) с оксидом калия в токе воздуха или, лучше, кислорода:
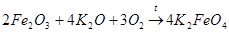
2) взаимодействие оксида железа(Ш) с пероксидом калия также в присутствии воздуха или кислорода:
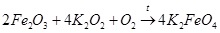
3) взаимодействие оксида железа(Ш) с оксидом калия и нитратом калия:
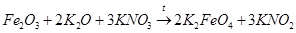
4) взаимодействие металлического железа с нитратом калия:
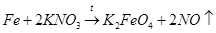
Проведя синтез по варианту 1, Фреми предположил, что эта реакция идет через пероксид калия. Поэтому далее он получил пероксид калия, провел синтез по варианту 2 и нашел, что в этом случае процесс идет лучше.
Вариант 3 отличается от варианта 1, по существу, только тем, что источником кислорода является нитрат калия, и процесс также идет лучше, чем по первому варианту, вероятно, потому, что не надо подавать кислород извне.
Предложив вначале три варианта высокотемпературного окисления [1], немного позже Фреми добавил к ним еще один [2], причем считал его наилучшим, поскольку синтез по вариантам 1–3 не всегда проходил успешно [3].
Следует отметить, что в то время химикам уже была известна реакция взаимодействия железа с нитратом калия, дающая оксид железа (III) (с выделением тепла, обычно со взрывом):
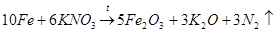
Фреми предположил, что при действии на образующийся оксид железа(III) оксида калия и кислорода может получаться феррат калия (как в варианте 1):
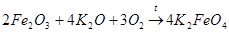
Фреми удалось подобрать условия, чтобы получить именно феррат калия. Для этого он нагревал железные опилки до красного каления, а потом добавлял к ним в нужной пропорции высушенный и мелко растертый нитрат калия.
По-видимому, механизм реакции взаимодействия железа и нитрата калия не такой, как предполагал Фреми (с выделением N0, что у него не было отмечено), но для получения феррата калия это не имеет значения.
Ферраты достаточно легко распознаются по характерной окраске — темные красно-фиолетовые кристаллы, соответствующую окраску имеют и растворы.
Другими учеными была описана реакция оксида железа (III) с нитратом калия без оксида калия, что следует считать модификацией варианта 3 [4, 5] (вероятная схема процесса, протекающего с выделением газа):
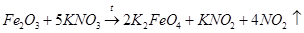
Для низкотемпературного химического окисления Фреми предложил «мокрый способ» — действие газообразного хлора на суспензию гидроксида железа (III) в концентрированном растворе гидроксида калия, по аналогии с уже известным в то время процессом получения перманганата [1–3]:
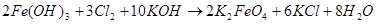
Процесс, по мнению Фреми, идет через гипохлорит калия [2]:
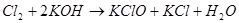
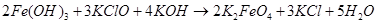
Если гидроксид калия взят в избытке, происходит осаждение феррата калия. Для получения чистого продукта Фреми растворял феррат калия в воде и осаждал его концентрированным раствором гидроксида калия [3].
Кроме того, Фреми получил феррат натрия химическим окислением, однако ему не удалось осадить его в твердом виде из-за более высокой растворимости этой соли. Получить феррат натрия высокотемпературным окислением по 4-му варианту ему не удалось из-за меньшей реакционной способности нитрата натрия. Также им были получены некоторые другие соли обменными реакциями с ферратом калия [3].
Дополнительно можно отметить, что позже был получен феррат натрия действием пероксида натрия на железо в воздухе, процесс в этом случае, скорее всего, идет через оксид железа(Ш), т. е. по варианту 2 высокотемпературного окисления [6].
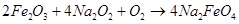
В том же 1841 г. немецкий ученый Поггендорф (знакомый с работой Фреми [1]) предложил принципиально иной метод получения ферратов — электрохимическое окисление [7] (что считают третьей группой методов). Он проводил эксперименты, в которых использовал гальваническую цепь, включающую платиновую пластину, погруженную в раствор азотной кислоты (катод), и пластины из различных материалов, погруженные в концентрированный раствор гидроксида калия (анод). Для ряда материалов на аноде просто наблюдалось выделение кислорода (графит, платина, никель и др.), Для других этот процесс сопровождался окислением материала анода — потускнением и образованием покрытия на его поверхности (серебро, медь, сурьма и др.). И только чугун растворялся, давая раствор с характерной винно-красной окраской (с попутным выделением кислорода). Из полученного раствора со временем выпадал осадок оксида железа(Ш). По этим признакам Поггендорф сделал вывод, что в данном случае идет процесс окисления железа с образованием феррата калия.
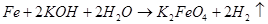
При этом процесс получения феррата калия шел только для двух видов чугуна, с которыми он работал. Еще один вид чугуна давал незначительное количество этого продукта, а другой не давал его вообще. Обычная сталь того времени также давала незначительное количество феррата калия, а кованое железо (самое чистое железо того времени) не давало вообще. Сила тока в этих случаях имела близкое значение, и Поггендорф объяснил это явление присутствием в реагирующем чугуне частиц углерода. Он считал, что этот способ синтеза лучше предложенных Фреми, однако не выделил феррат калия в осажденном виде.
Фреми также показал, что оксид железа, соответствующий железной кислоте, имеет формулу FеОз [3]. Его метод анализа включал термическое разложение феррата калия в растворе, определение количества выделившегося кислорода и количества выпавшего в осадок оксида железа(Ш) (состав которого в то время был уже известен). Сопоставление этих количеств подтвердило формулу FеОз.
Независимо от Фреми подобный анализ с теми же результатами выполнил Смит [4], причем он использовал феррат калия, полученный высокотемпературным окислением.
Другой метод анализа использовал Розе [8]. Он включал восстановление в растворе феррата калия, полученного электрохимическим окислением, газообразным диоксидом серы до оксида железа(Ш), отделение выпавшего осадка (и удаление остатков газа) и осаждение из раствора образовавшегося сульфата добавлением хлорида бария. Количество полученного сульфата бария было пропорционально количеству кислорода, высвободившегося из феррата калия. Сопоставление количества оксида железа(Ш) и количества сульфата бария также подтвердило формулу FеОз.
Эти исследования показали, что при всех указанных способах получения феррата калия образуется один и тот же продукт.
Долгое время ферраты оставались чисто лабораторными продуктам, которые исследователи получали сами. Ситуация изменилась только после 1950 г., когда был предложен метод химического окисления, в котором вместо хлора использовали гипохлорит натрия (как было указано, еще Фреми предполагал, что окисление хлором идет через гипохлорит [2]):
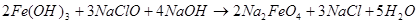
Согласно первоначальному варианту [9], к щелочному раствору гипохлорита натрия добавляли пасту гидроксида железа(Ш), полученную из хлорида железа(Ш) и гидроксида натрия в воде. Процесс проводили при 50–55°С с добавлением твердого гидроксида натрия. Продукт высаждали в виде феррата калия (эта соль менее растворима) твердым гидроксидом калия при охлаждении и переосаждали из раствора гидроксида калия с промывкой этанолом. Этот лабораторный вариант давал выход до 15 %.
Согласно модифицированному варианту [10], к щелочному раствору гипохлорита натрия просто добавляли твердый нитрат железа(Ш), процесс проводили при 25–30°С с добавлением твердого гидроксида калия. Далее процесс вели подобно первоначальному варианту, выходом по основному продукту до 76 %.
Насколько нам известно, именно по этому методу было начато производство феррата калия, что сделало возможным его практическое применение [11].
На основании этой информации можно сделать вывод, что, по существу, еще Фреми и Поггендорф определили три основные группы методов получения ферратов, которые используются и в наше время:
химическое окисление соединений железа(II) и (III) в щелочных растворах; электрохимическое окисление железа в щелочных растворах; высокотемпературное окисление железа, соединений железа (II) и (III) в твердом виде.
Химическое окисление требует применения газообразного хлора или гипохлорита натрия, что неудобно с экологической точки зрения. Для реализации высокотемпературного окисления необходимы высокие температуры, а также твердые окислители, что делает этот процесс взрывоопасным.
Таким образом, проведенный обзор технологических процессов синтеза высокоэффективных реагентов-окислителей позволяет сделать вывод, что предпочтительным методом промышленного получения ферратов является электрическое окисление металлического железа в щелочной среде.
1. Fremy, E. Recherches sur faction des peroxides alcalins sur les oxides metalliques / E. Fremy // Compt. Rend. Acad. Sci. 1841. 12, 23–24.
2. Fremy, E. Recherches sur les acides metalliques / E. Fremy // Compt. Rend. Acad. Sci.1842, 14,442–446.
3. Fremy, E. Recherches sur les acides metalliques / E. Fremy // Ann. Chim. Phys. 1844, 12,361–382.
4. Smith, J. D. On the composition of an acid oxide of iron (ferric acid) / J. D. Smith // Phil. Mag. 1843,23,217–225.
5. Wittstein, G. C. Beitrag zur Bildung und Darstellung der Eisensaure / G.C Wittstein // Repertor. Pharm. 1845, 89 (39), 176–179.
6. Wallace, T. Some properties of fused sodium hydroxide / T. Wallace, A. Fleck // J. Chem. Soc. Trans. 1921, 119, 1839–1860.
7. Poggendorff, J. С Ueber die Frage, ob es wirksame galvanische Ketten ohne primitive chemische Action gebe, und uber die Bildung der Eisensaure auf galvanischem Wege / J. С Poggendorff//Ann. Phys. Chem. 1841, 130 (54), 353–377.
8. Rose H. Ueber die Zusammensetzung der Eisensaure / H. Rose // Ann. Phys. Chem. 1843, 135 (59), 315–325.
9. Hrostowski, H. J. The magnetic susceptibility of potassium ferrate / H. J. Hrostowski, A. B. Scott//J. Chem. Phys. 1950, 18, 105–107.
10. Thompson, G. W. Preparation and purification of potassium ferrate VI / G. W. Thompson, L. T. Ockerman, J. M. Schreyer// J. Amer. Chem. Soc. 1951,73,1379–1381.
11. Андреев, СЮ. Интенсификация очистки производственных сточных вод с использованием окислителя на основе феррата натрия / СЮ. Андреев, И. А. Гарькина, Н. Н. Ласьков, В. А. Князев // Региональная архитектура и строительство. — 2014. -№ 2.-С. 152–156.
Источник
 Химическая кунсткамера
Химическая кунсткамера






