- ВОДА, ЛЕД И ПАР
- Историческая справка.
- Распространенность.
- Морская вода.
- Минеральная вода.
- Мягкая и жесткая вода.
- Молекулярная структура.
- Физические свойства.
- Давление паров.
- Химические свойства.
- Каталитическое действие.
- Гидраты.
- Гидролиз.
- Сольватация.
- Тяжелая вода.
- Учебники
- Журнал «Квант»
- Общие
- Содержание
- Вопросы и задачи
- Микроопыт
- Любопытно, что…
- Что читать в «Кванте» о льде, воде и паре
- Ответы
- Микроопыт
ВОДА, ЛЕД И ПАР
ВОДА, ЛЕД И ПАР, соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Историческая справка.
Идея древних философов о том, что все в природе образуют четыре элемента (стихии): земля, воздух, огонь и вода, просуществовала вплоть до Средних веков. В 1781 Г.Кавендиш сообщил о получении им воды при сжигании водорода, но не оценил в полной мере важности своего открытия. Позже (1783) А.Лавуазье доказал, что вода вовсе не элемент, а соединение водорода и кислорода. Й.Берцелиус и П.Дюлонг (1819), а также Ж.Дюма и Ж.Стас (1842) установили весовой состав воды, пропуская водород через оксид меди, взятый в строго определенном количестве, и взвешивая образовавшиеся медь и воду. Исходя из этих данных, они определили отношение Н:О для воды. Кроме того, в 1820-х годах Ж.Гей-Люссак измерил объемы газообразных водорода и кислорода, которые при взаимодействии давали воду: они соотносились между собой как 2:1, что, как мы теперь знаем, отвечает формуле Н2О.
Распространенность.
Вода покрывает 3/4 поверхности Земли. Тело человека состоит из воды примерно на 70%, яйцо – на 74%, а некоторые овощи – это почти одна вода. Так, в арбузе ее 92%, в спелых томатах – 95%.
Вода в природных резервуарах никогда не бывает однородной по составу: она проходит через горные породы, соприкасается с почвой и воздухом, а потому содержит растворенные газы и минеральные вещества. Более чистой является дистиллированная вода.
Морская вода.
Состав морской воды различается в разных регионах и зависит от притока пресных вод, скорости испарения, количества осадков, таяния айсбергов и т.д. См. также ОКЕАН.
Минеральная вода.
Минеральная вода образуется при просачивании обычной воды сквозь породы, содержащие соединения железа, лития, серы и других элементов.
Мягкая и жесткая вода.
Жесткая вода содержит в больших количествах соли кальция и магния. Они растворяются в воде при протекании по породам, сложенным гипсом (СaSO4), известняком (СаСО3) или доломитом (карбонаты Mg и Са). В мягкой воде этих солей мало. Если вода содержит сульфат кальция, то говорят, что она обладает постоянной (некарбонатной) жесткостью. Ее можно умягчить добавлением карбоната натрия; это приведет к осаждению кальция в виде карбоната, а в растворе останется сульфат натрия. Соли натрия не вступают в реакцию с мылом, и расход его будет меньше, чем в присутствии солей кальция и магния.
Вода, обладающая временной (карбонатной) жесткостью, содержит бикарбонаты кальция и магния; ее можно умягчить несколькими способами: 1) нагреванием, приводящим к разложению бикарбонатов на нерастворимые карбонаты; 2) добавлением известковой воды (гидроксида кальция), в результате чего бикарбонаты превращаются в нерастворимые карбонаты; 3) с помощью обменных реакций.
Вода, содержащая в большом количестве растворенный диоксид углерода, просачиваясь через известняковые породы, растворяет их, что приводит к образованию пещер. При повышении температуры начинается обратный процесс: бикарбонат разлагается и вновь образуется известняк. Именно из него состоят сталактиты и сталагмиты.
Молекулярная структура.
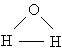
Анализ данных, полученных из спектров поглощения, показал, что три атома в молекуле воды образуют равнобедренный треугольник с двумя атомами водорода в основании и кислородом в вершине:
Валентный угол НОН равен 104,31 ° , длина связи О–Н составляет 0,99 Å (1 Å = 10 –8 см), а расстояние Н–Н равно 1,515 Å. Атомы водорода так глубоко «внедрены» в атом кислорода, что молекула оказывается почти сферической; ее радиус – 1,38 Å.
Физические свойства.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0 ° С) и кипения (100 ° С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества, ее удельная электропроводность равна 1,5 Ч 10 –8 Ом –1 Ч см –1 при 0 ° С. Сжимаемость воды очень мала: 43 Ч 10 –6 см 3 на мегабар при 20 ° С. Плотность воды максимальна при 4 ° С; это объясняется свойствами водородных связей ее молекул.
Давление паров.
Если оставить воду в открытой емкости, то она постепенно испарится – все ее молекулы перейдут в воздух. В то же время вода, находящаяся в плотно закупоренном сосуде, испаряется лишь частично, т.е. при определенном давлении водяных паров между водой и воздухом, находящимся над ней, устанавливается равновесие. Давление паров в равновесии зависит от температуры и называется давлением насыщенного пара (или его упругостью). Когда давление насыщенного пара сравнивается с внешним давлением, вода закипает. При обычном давлении 760 мм рт.ст. вода кипит при 100 ° С, а на высоте 2900 м над уровнем моря атмосферное давление падает до 525 мм рт.ст. и температура кипения оказывается равной 90 ° С.
Испарение происходит даже с поверхности снега и льда, именно поэтому высыхает на морозе мокрое белье.
Вязкость воды с ростом температуры быстро уменьшается и при 100 ° С оказывается в 8 раз меньше, чем при 0 ° С.
Химические свойства.
Каталитическое действие.
Очень многие химические реакции протекают только в присутствии воды. Так, окисление кислородом не происходит в сухих газах, металлы не реагируют с хлором и т.д.
Гидраты.
Многие соединения всегда содержат определенное число молекул воды и называются поэтому гидратами. Природа образующихся при этом связей может быть разной. Например, в пентагидрате сульфата меди, или медном купоросе CuSO4 Ч 5H2O, четыре молекулы воды образуют координационные связи с ионом сульфата, разрушающиеся при 125 ° С; пятая же молекула воды связана так прочно, что отрывается лишь при температуре 250 ° С. Еще один стабильный гидрат – серная кислота; она существует в двух гидратных формах, SO3 Ч H2O и SO2(OH)2, между которыми устанавливается равновесие. Ионы в водных растворах тоже часто бывают гидратированы. Так, Н + всегда находится в виде иона гидроксония Н3О + или Н5О2 + ; ион лития – в виде Li (H2O)6 + и т.д. Элементы как таковые редко находятся в гидратированной форме. Исключение составляют бром и хлор, которые образуют гидраты Br2 Ч 10 H2O и Cl2 Ч 6H2О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2 Ч 2H2O, английская соль (сульфат магния) MgSO4 Ч 7H2O, питьевая сода (карбонат натрия) Na2CO3 Ч 10 H2O, глауберова соль (сульфат натрия) Na2SO4 Ч 10 H2O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4 Ч 5H2O, CuSO4 Ч 3H2O и CuSO4 Ч H2O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду. Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.
Гидролиз.
Гидролиз – это реакция двойного разложения, в которой одним из реагентов является вода; трихлорид фосфора PCl3 легко вступает в реакцию с водой:
Аналогичным образом гидролизуются жиры с образованием жирных кислот и глицерина.
Сольватация.
Вода – полярное соединение, а потому охотно вступает в электростатическое взаимодействие с частицами (ионами или молекулами) растворенных в ней веществ. Образовавшиеся в результате сольватации молекулярные группы называются сольватами. Слой молекул воды, связанный с центральной частицей сольвата силами притяжения, составляет сольватную оболочку. Впервые понятие сольватации было введено в 1891 И.А.Каблуковым.
Тяжелая вода.
В 1931 Г.Юри показал, что при испарении жидкого водорода его последние фракции оказываются тяжелее обычного водорода вследствие содержания в них в два раза более тяжелого изотопа. Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды.
В природе на каждые 5000 массовых частей Н2О приходится одна часть D2O. Это соотношение одинаково для речной, дождевой, болотной воды, подземных вод или кристаллизационной воды. Тяжелая вода используется в качестве метки при исследовании физиологических процессов. Так, в моче человека соотношение между Н и D тоже равно 5000:1. Если дать пациенту выпить воду с большим содержанием D2O, то, последовательно измеряя долю этой воды в моче, можно определить скорость выведения воды из организма. Оказалось, что около половины выпитой воды остается в организме даже спустя 15 сут. Тяжелая вода, вернее, входящий в ее состав дейтерий – важный участник реакций ядерного синтеза.
Третий изотоп водорода – тритий, обозначаемый символом Т. В отличие от первых двух он радиоактивен и обнаружен в природе лишь в малых количествах. В пресноводных озерах соотношение между ним и обычным водородом равно 1:10 18 , в поверхностных водах – 1:10 19 , в глубинных водах он отсутствует. См. также ВОДОРОД.
Лед, твердая фаза воды, используется в основном как хладагент. Он может находиться в равновесии с жидкой и газообразной фазами или только с газообразной фазой. Толстый слой льда имеет голубоватый цвет, что связано с особенностями преломления им света. Сжимаемость льда очень низка.
Лед при нормальном давлении существует только при температуре 0 ° С или ниже и обладает меньшей плотностью, чем холодная вода. Именно поэтому айсберги плавают в воде. При этом, поскольку отношение плотностей льда и воды при 0 ° С постоянно, лед всегда выступает из воды на определенную часть, а именно на 1/5 своего объема. См. также АЙСБЕРГИ.
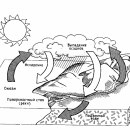
Пар – газообразная фаза воды. Вопреки общепринятому мнению, он невидим. Тот «пар», который вырывается из кипящего чайника, – это на самом деле множество мельчайших капелек воды. Пар обладает свойствами, очень важными для поддержания жизни на Земле. Хорошо известно, например, что под действием солнечного тепла вода с поверхности морей и океанов испаряется. Образующиеся водяные пары поднимаются в атмосферу и конденсируются, а затем выпадают на землю в виде дождя и снега. Без такого круговорота воды наша планета давно превратилась бы в пустыню.
Пар имеет множество применений. С одними мы хорошо знакомы, о других только слышали. Среди наиболее известных устройств и механизмов, работающих с применением пара, – утюги, паровозы, пароходы, паровые котлы. Пар вращает турбины генераторов на тепловых электростанциях. См. также КОТЕЛ ПАРОВОЙ; ДВИГАТЕЛЬ ТЕПЛОВОЙ; ТЕПЛОТА; ТЕРМОДИНАМИКА.
Эйзенберг Д., Кауцман В. Структура и свойства воды. Л., 1975
Зацепина Г.Н. Физические свойства и структура воды. М., 1987
Источник
Учебники
Журнал «Квант»
Общие
А так ли хорошо знакомы вам лед, вода и пар? // Квант. — 2007. — № 1. — С. 32-33.
По специальной договоренности с редколлегией и редакцией журнала «Квант»
Морская вода даже при самом сильном холоде не замерзает до твердого и чистого льда.
Михаил Ломоносов
Я предположил, что во время кипения теплота поглощается водой и проникает
в состав пара, образующегося из нее, тем же способом, как она поглощается
льдом при таянии и проникает в состав образующейся воды.
Джозеф Блэк
Облако — туман в высоте.
Владимир Даль
Можно, как известно, расплавить посредством трения друг о друга
в безвоздушном пространстве два куска льда; теперь делают попытки
превратить воду в лед посредством неслыханно большого давления.
Юлиус Роберт Майер
. чтобы наблюдать насыщенный пар выше обыкновенной точки
кипения воды, приходилось кипятить ее в замкнутых котлах,
под искусственной атмосферой из сжатого воздуха и пара.
Александр Столетов
Содержание
Еще как знакомы, ответят очень многие. Вода — это самое распространенное на Земле вещество. Все живое, в том числе и мы сами, в основном состоит из воды. Ее физические свойства изучены-переизучены, они даже используются в качестве эталонов.
Все это так, однако вода в своих различных агрегатных состояниях и по сей день преподносит множество сюрпризов. Особенности этого вроде бы простого вещества до конца еще не поняты, и поведение воды не всегда можно прогнозировать. Смириться с таким положением дел ученые, безусловно, не желают и упорно продолжают разбираться со все более тонкими деталями строения воды и ее участия в загадочных эффектах.
А стимулирует исследователей понимание исключительной важности воды для жизни на Земле. Ведь более полные знания о ней необходимы и для решения экологических проблем, и для создания новых лекарств и методов лечения, и для противостояния глобальным климатическим изменениям, и для совершенствования производственной деятельности человека.
Масштабы этих задач побуждают и нас обратиться к разговору о физических свойствах одной из четырех основных стихий. Посмотрите, ведь и среди школьных вопросов и задач найдется немало таких, которые заставят вас засомневаться в простоте этого простого вещества — воды.
Вопросы и задачи
- Останется ли целой доверху заполненная водой закупоренная стеклянная бутылка, если ее опустить в тающий лед?
- Ко дну сосуда с водой изнутри приморожен шарик изо льда. Изменится ли уровень воды в сосуде, когда лед растает?
- Можно ли расплавить олово в горячей воде? А заморозить воду расплавленным металлом?
- Капельки тумана могут оставаться жидкими и при температуре -30 °С. Почему?
- При первых морозах водоемы легче замерзают, если идет снег. Как это объяснить?
- Какая физическая ошибка допущена в стихотворении о капле: «Она жила и по стеклу текла, но вдруг ее морозом оковало, и неподвижной льдинкой капля стала, а в мире поубавилось тепла»?
- Почему превращение в воду плавающих в море льдов не приводит к наводнениям, тогда как растопление льда, покоящегося на острове Гренландия, вызвало бы катастрофический подъем уровня океана?
- Удельная теплота плавления меди значительно меньше, чем у льда. Значит ли это, что для плавления медной пластинки в зимних условиях потребуется меньше энергии, чем для плавления льдинки той же массы?
- Почему ожоги паром опаснее ожогов кипятком?
- Что быстрее потушит пламя — кипяток или холодная вода?
- В кастрюле с тяжелой крышкой вскипятили воду. Сняв кастрюлю с плиты, ей дали слегка остыть, затем в спокойную воду насыпали чайную заварку, и вода бурно закипела. Почему?
- Желая ускорить процесс варки, хозяйка усилила огонь под кастрюлей, в которой кипела вода. Верно ли поступила хозяйка?
- Одинаковы ли показания термометров, один из которых помещен у поверхности кипящей воды, а другой — в ее толще?
- Стакан с небольшим количеством воды поставили под колокол воздушного насоса и стали откачивать воздух. Почему вода сначала закипела, а потом замерзла?
- Воду вскипятили в круглодонной колбе, колбу закупорили и перевернули. Если теперь на дно колбы положить немного снега или облить ее холодной водой, то вода в колбе закипит. Как это объяснить?
- В каком случае «точка росы» становится «точкой инея»?
- Иногда поверхности окон запотевают. Какие это поверхности — внешние или внутренние?
- При критической температуре удельная теплота парообразования любой жидкости, в том числе и воды, равна нулю. Почему?
- Какого цвета водяной пар?
Микроопыт
Выпустите из яйца его содержимое через маленькое отверстие в остром конце. Залепите дырочку воском или пластилином, к которому прикрепите на нитке грузик. Массу грузика надо подобрать так, чтобы он удерживал скорлупу почти у дна высокой банки с водой комнатной температуры.
Если вынести банку на мороз, то через некоторое время ваш «прибор» всплывет, но вскоре опустится. Если теперь внести банку в комнату, то скорлупа вновь проделает свой путь вверх-вниз. Объясните это.
Любопытно, что…
. расширение воды при замерзании и ее закипание при пониженном давлении были открыты лишь в семнадцатом столетии искусным английским экспериментатором Робертом Бойлем.
. из морской воды образуется исключительно прочный полярный лед. Иная точка зрения, разделявшаяся, судя по эпиграфу, Ломоносовым, «не позволила» пробиться к Северному полюсу ни одной из экспедиций XVII—XIX веков, так как парусники всякий раз застревали в мощных льдах.
. способ приготовления мороженого поначалу охраняли как большой секрет. Напрасно опытные повара при многих европейских дворах пытались заморозить смесь из взбитых сливок и фруктовых соков, пользуясь льдом в обычных погребах. Оказывается, дело было в добавлении соли — перемешивая ее с колотым льдом, можно было значительно понизить температуру, вплоть до полного замерзания смеси.
. одна из особенностей льда заключается в том, что температура его плавления, в отличие от большинства веществ, понижается с увеличением давления. Однако этот эффект не отвечает за появление водяной смазки под лезвием коньков, чем долгие годы пытались объяснить их легкое скольжение по льду.
. знаменитый сказочник Андерсен упомянул в «Снежной королеве» десятиконечные снежинки, хотя много раньше астроном Кеплер установил их шестиконечную форму. Правда, Декарту удалось наблюдать крайне редкие двенадцати- и восемнадцатиконечные кристаллики снежинок.
. недавно была обнаружена пятая форма плотного аморфного льда, образующегося под действием высокого давления при температуре около -200 °С. Заметим, что все виды льдов, кроме обычного, тонут в воде. Иначе говоря, лед, получающийся при нормальных условиях, ведет себя аномально.
. в годы второй мировой войны для восстановления потерь флота английские ученые предложили морскому ведомству построить непотопляемые авианосцы изо. льда. Для этого предполагалось использовать айсберги, за которыми в Арктику была даже направлена специальная экспедиция. Проект, правда, так и не был осуществлен, однако внимание к разного рода ледяным сооружениям неизмеримо возросло.
. большая теплоемкость воды объясняется тем, что ее молекулы объединяются в так называемые кластеры, (супермолекулы) и при поступлении к воде тепла заметная его часть тратится на разрыв связей между входящими в состав кластера соседками-молекулами.
. на Марсе жидкой воды нет, так как при марсианском атмосферном давлении, в 160 раз меньшим, чем на Земле, вода может существовать лишь в твердом и газообразном состояниях. А на Венере вода в жидкой фазе не могла бы находиться потому, что температура поверхности этой планеты около 480 °С, что заметно выше критической температуры воды. Правда, исследователи не потеряли надежды обнаружить замерзшую воду на Луне, где она могла бы сохраниться на дне глубоких полярных кратеров.
. как известно, в скороварке пищу можно приготовить гораздо быстрее, чем в обычной кастрюле. Однако открывать эту посуду следует очень осторожно: после разгерметизации давление падает, и жидкость оказывается заметно перегретой, что приводит к взрывному вскипанию во всем объеме кастрюли, выплескиванию горячей воды и. ожогам.
. английский физик Чарльз Вильсон, предложивший в 1912 году применяемый и поныне способ регистрации заряженных частиц с помощью камеры, заполненной пересыщенным паром, до этого занимался исследованием происхождения дождей и туманов.
. феномен «памяти воды», т.е. ее способность длительное время хранить информацию, так активно обсуждался в последние годы, что заставил ученых провести специальные эксперименты. Увы, результат отрицателен: вода обладает нестабильной, постоянно меняющейся структурой и, скорее, является одним из самых «забывчивых» веществ на свете.
Что читать в «Кванте» о льде, воде и паре
- «Наглядный способ регистрации заряженных частиц» — 2001, № 6, с. 11;
- «Водяные пары» — 2002, № 2, с. 26;
- «Тепловые свойства воды» — 2002, № 3, с. 10;
- «Снежинки и ледяные узоры на стекле» — 2002, № 5, с. 29;
- «О структуре льда» — 2002, Приложение № 6, с. 19;
- «О физике на приусадебном участке» — 2003, № 1, с. 27;
- «Вода внутри нас» — 2003, № 2, с. 2;
- «Насыщенные и ненасыщенные водяные пары» — 2004, № 2, с. 23;
- «Костры в поле и русская баня» — 2004, Приложение № 4, с. 60;
- «Калейдоскоп «Кванта» — 2005, № 3, с. 32;
- «Метастабильные капли и обледенение самолета» — 2005, № 4, с. 8;
- «Задачи с жидкостями» — 2006, № 1, с. 40.
Ответы
- Да. Стекло треснуло бы под действием воды, расширяющейся при превращении в лед, однако вода в бутылке лишь охладится до 0 °С, но не замерзнет.
- Уровень воды в сосуде понизится, поскольку объем ледяного шарика больше объема образовавшейся из него воды.
- Можно. Вода, находящаяся под давлением 40 атм, кипит при температуре около 250 °C, что выше температуры плавления олова. На поверхности расплавленной ртути, температура плавления которой ниже 0 С, можно, охладив ртуть, заморозить, например, каплю воды.
- Если вода раздроблена на мелкие капли, то лишь в некоторых из них будут иметься центры кристаллизации, в большинстве же капель вода окажется в переохлажденном состоянии.
- Снежинки служат центрами кристаллизации, вокруг которых начинается образование льда.
- На самом деле, убавилась внутренняя энергия капли, которая была передана во внешний мир — воздуху и стеклу — как раз в виде тепла.
- Таяние плавающих льдов не изменяет уровня Мирового океана, а растопление континентальных льдов было бы равноценно добавлению в океан огромных объемов воды.
- Нет. Следует учесть количество теплоты, необходимое для нагревания твердых тел до температуры плавления.
- При попадании на кожу человека одинаковых количеств пара и кипятка за счет конденсации пара выделяется примерно в 5 раз большее количество теплоты, чем за счет охлаждения кипятка.
- Кипяток, так как он превращается в пар быстрее, чем холодная вода, а образующийся пар обволакивает горящее тело и прекращает доступ к нему кислорода.
- Чаинки сыграли роль центров парообразования в перегретой воде.
- Нет. Температура кипящей воды не будет повышаться, пока вся вода не превратится в пар.
- Нет. Чем глубже в воде находится пузырек, тем больше должно быть давление насыщенного пара в пузырьке, чтобы он не схлопывался, а этому соответствует и более высокая температура.
- Кипение воды при пониженном давлении сопровождается поглощением тепла у остающейся в стакане воды, что приводит к ее охлаждению и замерзанию.
- При охлаждении дна колбы давление над водой становится меньше давления насыщенного пара.
- В случае, если «точка росы» ниже 0 °C .
- Естественно, запотевают внутренние поверхности стекол.
- При критической температуре жидкость и ее пар неразличимы.
- Водяной пар совершенно прозрачен, невидим и, следовательно, вовсе не имеет цвета. Белый туман, пар изо рта и облака — это не пар в физическом смысле слова, а скопление мельчайших водяных капелек.
Микроопыт
Вода имеет наибольшую плотность при +4 °C . При охлаждении (или нагревании) воды до этой температуры скорлупа будет всплывать, а при дальнейшем понижении (или повышении) температуры — погружаться.
Источник