- Формула бромной воды
- Определение и формула бромной воды
- Химическая формула бромной воды
- Электронная формула бромной воды
- Примеры решения задач
- Большая Энциклопедия Нефти и Газа
- Насыщенный водный раствор — бром
- Бромная вода — водный раствор брома
- Бромная вода: что это такое и чем опасна для человека, химическая формула брома, методы очистки, взаимодействие с другими веществами
- Определение
- Формула
- Формула бромной воды в химии
- Электронная формула
- История открытия
- Приготовление бромной воды: получение, применение, цвет
- Чем отличается бромная вода от брома: состав
- Химические свойства
- Физические свойства
- Применение
- Способы получения
- Методы очистки воды от брома
- Примеры реакций, при которых бромная вода обесцвечивается
- Значение Br для организма человека
- Как сказывается недостаток Br на человеческом здоровье
- Передозировка Br
Формула бромной воды
Определение и формула бромной воды
Она является водным раствором брома, в котором присутствуют бромоводородная и бромноватистая кислоты. При длительном нахождении на свету бромная вода начинает выделять кислород, что происходит из-за частичного разложения бромноватистой кислоты. Является сильным окислителем.
Рис. 1. Бромная вода. Внешний вид.
Химическая формула бромной воды
Химическая формула бромной воды соответствует формуле молекулярного брома Br2. Она показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества:
Электронная формула бромной воды
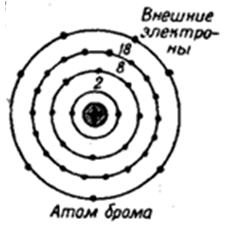
В ядре атома брома содержится 35 протонов и 45 нейтронов (массовое число равно 80), 35 протонов и 45 нейтронов, а вокруг, по четырем орбитам движутся 35 электронов (рис. 2).
Рис. 2. Строение атома брома.
Распределение электронов по орбиталям в атоме брома выглядит следующим образом:
Примеры решения задач
| Задание | Определите простейшую формулу вещества, в котором массовые доли натрия, фосфора и кислорода составляют 34,59, 23,31 и 42,10% соответственно. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим число атомов натрия в молекуле через «х», число атомов фосфора через «у» и число атомов кислорода за «z».
Найдем соответствующие относительные атомные массы элементов натрия, фосфора и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(Na) = 23; Ar(P) = 31; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y:z = m(Na)/Ar(Na) : m(P)/Ar(P) : m(O)/Ar(O);
x:y:z = 34,59/23 : 23,31/31 : 42,10/16;
x:y:z = 1,5 : 0,75 : 2,63 = 2: 1 : 3,5 = 4 : 4: 7.
Значит простейшая формула соединения натрия, фосфора и кислорода имеет вид Na4P4O7.
| Задание | В некотором соединении массовая доля азота составляет 30,4%, кислорода – 69,6%. Выведите простейшую формулу соединения. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим число атомов азота в молекуле через «х», а число атомов кислорода через «у»
Найдем соответствующие относительные атомные массы элементов азота и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(N) = 14; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y = ω (N)/Ar(N) : ω (O)/Ar(O);
x:y = 30,4/14 : 69,6/16;
x:y: = 2,17 : 4,35 = 1 : 2.
Значит простейшая формула соединения азота и кислорода имеет вид NO2. Это оксид азота (IV).
Источник
Большая Энциклопедия Нефти и Газа
Насыщенный водный раствор — бром
Насыщенный водный раствор брома приготовляют встряхиванием 4 мл брома с 100 мл воды. [1]
ЫОВг в насыщенном водном растворе брома значительно меньше, a HOI только в очень незначительном количестве содержится в насыщенном водном растворе иода. [3]
НОВг в насыщенном водном растворе брома значительно меньше, a HOI только в очень незначительном количестве содержится в насыщенном водном растворе иода. [5]
Бромная вода — насыщенный водный раствор брома : 11 мл брома растворяют в I л воды; для повышения растворимости брома можно добавлять 10 г бромида калия. [6]
Приготовление бромной воды — дистиллированную воду взбалтывают с бромоы готовя насыщенный водный раствор брома — бромную воду. Воду отделяют от иг бытка брома декантацией. [7]
В капле нейтрального или слабокислого раствора соли таллия ( I) добавляют 1 каплю насыщенного водного раствора брома . Избыток брома связывают каплей 10 % — ного водного раствора сульфосалициловой кислоты. Добавляют 1 каплю 0 05 % — ного раствора родамина С в концентрированной соляной кислоте и 6 — 8 капель бензола. [8]
Растворим в соляной и бромистоводородной кислотах и растворах КВг. Насыщенный водный раствор брома ( бромная вода) не замерзает даже при — 20 С. При нагревании бром выделяется из раствора. [10]
Определенный объем с содержанием 0 2 до 2 0 мг аспарагиновой кислоты разбавляют водой до 20 мл, вносят 3 мл HiSOi ( 1: 1) и слегка кипятят 8 — 10 мин. После охлаждения добавляют 1 мл насыщенного водного раствора брома . Реакция проходит при комнатной температуре за 5 мин. Раствор фильтруют и фильтр промывают водой. К фильтрату добавляют 2 мл 1 мол. KMnOi и выдерживают при 20 — 22 в течение 10 мин. Затем охлаждают до 5 — 10 и обесцвечивают 3 ШОз, добавляя ее по каплям. [11]
К 20 мл препарата прибавляют 1 мл 1 % — ного раствора карбоната натрия и выпаривают до объема 5 мл. Затем прибавляют 0 25 мл бромной воды ( насыщенный водный раствор брома ), выпаривают досуха и остаток высушивают. Сухой остаток растворяют в 20 мл воды. К раствору приливают 1 мл соляной кислоты ( уд. [12]
После хроматографирования и удаления растворителя с пластинки ее опрыскивают насыщенным водным раствором брома до слабого увлажнения слоя. После 15 мин экспозиции при комнатной температуре избыточный бром удаляется легким опрыскиванием пластинки 2 5 % — ным раствором тиосульфата натрия. [13]
Раствор BrCN должен быть свежеприготовленным, его можно применять в течение 24 — 48 час. В колбу с притертой пробкой вливают 10 — 15 мл насыщенного водного раствора брома , охлажденного до 4 — 5, к нему по каплям приливают охлажденный 10 % — ный раствор KCN до тех пор, пока при энергичном взбалтывании окраска брома исчезнет. Полученный таким образом раствор нужно хранить в хорошо закрытой склянке. [14]
Бром растворим в спирте, эфире, бензоле, хлороформе, сероуглероде, четыреххлористом углероде, четыреххлористом титане. Взаимодействие органических веществ с бромом сопровождается сильным разогревом, а в отдельных случаях самовоспламенением. Насыщенный водный раствор брома имеет желто-бурую окраску и называется бромной водой. При стоянии на свету из бромной воды выделяется кислород, а при нагревании — бром. Бром — сильный окислитель: он окисляет сульфиты и тиосульфа-ты в водных растворах до сульфатов, нитриты до нитратов, аммиак до свободного азота. Бром вытесняет иод из его соединений, но сам вытесняется из своих соединений хлором и фтором. Свободный бром выделяется из водных растворов хромидов также под действием сильных окислителей ( I C Cv, КМпО4 и др.) в кислой среде. При растворении брома в щелочах на холоду образуется бромид и гнпобромиг, а при повышении температуры ( около 100 С) — бромид и бромат. [15]
Источник
Бромная вода — водный раствор брома
Бромная вода представляет собой разведенный водой бром. Ее в уравнениях реакции принято записывать через такую формулу — Br2, хотя она в растворе находится в виде смеси двух кислот — HBrO (бромноватистая кислота) и HBr (бромоводородная кислота). Данное соединение имеет желто-оранжевый цвет и довольно низкую температуру замерзания. Является сильным окислителем, который способен в щелочной среде окислять катионы таких металлов — Сг +3 , Мп +3 , Fe +2 , Co +2 , Ni +3 . Добавление Br2 уменьшает водородный показатель раствора (рН), т.к. бромная вода содержит свободные кислоты.
Это химически активное вещество, которое может вступать во взаимодействие как с неорганическими, так и с органическими веществами. Рассмотрим некоторые химические процессы с данным соединением.
Обесцвечивание бромной воды служит качественной реакцией на все непредельные углеводороды. Для проведения такого эксперимента необходимо небольшое количество любого алкена или алкина смешать в пробирке с Br2. В ходе данной реакции происходит присоединение атомов брома по месту разрыва двойной или тройной связи. Исчезновение желто-оранжевой окраски при таком взаимодействии является доказательством непредельности взятого углеводорода.
Бромная вода в лаборатории готовится так: к 1 мл брома добавляют 250 мл дистиллированной воды, при этом интенсивно перемешивают. Приготовленный раствор хранят в плотно закрытой емкости из темного стекла. Если приготовленную Br2 хранить на свету или в светлой склянке, то будет происходить выделение кислорода из-за содержания бромноватистой кислоты. Работу по приготовлению реактива проводят в вытяжном шкафу. Так как сам бром ядовит, а бромная вода его содержит, то при работе с ней необходимо соблюдать осторожность.
Бромная вода широко используется в химическом анализе и синтезе органических препаратов. Так, ее используют при производстве бромсодержащих лекарственных средств. И здесь необходимо быть осторожными, т.к. длительное их употребление может привести к заболеванию – бромизм. Основные симптомы – апатия, вялость, появление кожной сыпи. Для более быстрого выведения ионов брома из организма соблюдают диету с повышенным содержанием соли и обильное питье. Еще бромную воду применяют на промежуточных этапах производства антипиренов – веществ, которые защищают органические соединения от воспламенений. Ими пропитывают ткани, древесину, строительный материал.
Источник
Бромная вода: что это такое и чем опасна для человека, химическая формула брома, методы очистки, взаимодействие с другими веществами
Рассмотрим раствор, активно используемый в промышленности. В фокусе внимания – бромная вода: что это такое, состав, как выглядит, структурная химическая формула и свойства, чем опасен бром для человека – пройдемся по всем этим вопросам, чтобы вы имели полное представление.
Сразу отметим, что особенно важна и востребована оно в лабораториях, где используется для выявления алкенов, которые она идентифицирует, изменяя свой цвет. И развеем один старый миф: что ее якобы давали советским солдатам для снижения потенции. Вряд ли, потому что для этого не было поводов, она не уменьшает либидо и не оказывает отрицательного влияния на мужскую силу. Если ее и подливали в напитки, то лишь в качестве мягкого снотворного, хотя и этому нет никаких доказательств. Ну а теперь сосредоточимся на более специфических моментах.
Определение
Это раствор, состав которого можно записать по схеме:
«бром плюс вода и кислоты» (бромоводородная и бромноватистая)
В обычных условиях это желто-оранжевая по своему цвету жидкость с высокой степенью прозрачности. Является достаточно активным веществом, успешно сочетающимся как с органикой, так и с неорганическими соединениями. Довольно сильный окислитель, быстро воздействующий в щелочной среде на катионы Mn+3, Ni+3, Cr+3, Co+2, Fe+2, а также в отдельном порядке на фенолы.
Формула
Записывается максимально просто – Br2, – не только соответствуя встречающейся в природе молекуле элемента, но и отражая ее количественный и качественный состав.
Но также содержит HBr и HBrO, которые тоже заслуживают внимания, так как определяют особенности хранения. За счет наличия этих свободных кислот значительно снижает pH-уровень той технологической среды, в которую добавлена (и эта ее особенность имеет ключевое значение при фильтрации, естественно, при соблюдении должной дозировки). И является важным компонентом при проведении целого ряда анализов и при изготовлении многих органических препаратов.
Формула бромной воды в химии
Br2 позволяет определить молекулярную массу – из следующих уравнений:
Mr(Br2) = 2 х Ar(Br), то есть Mr(Br2) = 2 х 80 = 160
Одна из наиболее частых реакций:
Br2 + H2O ⇌ HBr + HBrO
Если развернуть это описание и осветить его более подробно, система уравнений приобретет вид:
Br2(K) + nH2O ⇌ Br2 x nH2O(P),
что, в свою очередь, можно преобразовать в:
Br2 x nH2O ⇌ HBr + HBrO + (n – 1) x H2O,
из этого вырастает:
HBr + H2O → Br- + H3O+,
HBrO + H2O ⇌ BrO- + H3O+
К тому, как взаимодействуют оксид брома и вода, нужно добавить, что массовая доля элемента в составе в норме не превышает 3,5%, но при наличии бромидов степень растворимости увеличится благодаря появлению следующих комплексов:
которые подвергаются постепенному разложению под воздействием света:
2HBrO → 2HBr + O2
MBFT-75 Мембрана на 75GPD
SF-mix Clack до 0,8 м3/ч
SF-mix Runxin до 0,8 м3/ч
Последний процесс запускает бромноватистая кислота и, чтобы его предупредить, следует держать вещество в затемненной таре или хотя бы не подвергать его воздействию прямых лучей. При должном хранении с соблюдением всех норм оно сбережет свои полезные в условиях лаборатории свойства в течение долгого срока.
Электронная формула
Оставим на время в стороне вещества, которые взаимодействуют с бромной водой, и посмотрим на строение атома Br. При массовом числе 80 у него 4 орбиты, по которым вокруг ядра вращаются 35 электронов. Также у него есть 45 нейтронов и 35 протонов.
Распределение можно записать так:
История открытия
Сам Br был впервые описан в 1826 году Антуаном Баларом – препаратором из Монпелье. Молодой ученый получил темно-бурую жидкость из сожженных морских водорослей и назвал ее муридом (по аналогии с латинским muria, то есть «рассол»). Хотя немногим раньше, в 1825м, ассистент профессора Гмелина, студент Левиг с помощью хлора выделил элемент из кройцнахского источника. Правда, пока немец собирал достаточное количество материала для проведения исследований, француз его опередил, заявив о своем открытии.
В любом случае заседатели специально собранной комиссии (среди которых был и знаменитый Гей-Люссак) из Парижской академии наук посовещались и признали название Балара неудачным. Дело в том, что в то время семейству солей хлороводородной кислоты было дано имя муриаты. Вот ученые и посчитали, что слишком созвучные термины вызовут путаницу, и вместо этого предложили вариант Brome (с греческого переводится как «зловонный»), потому что открытие неприятно пахло. Его и ввели в употребление по всему миру, естественно, с поправкой на языковые особенности.
Приготовление бромной воды: получение, применение, цвет
Сначала – несколько слов о самом Br. При стабильно комнатной температуре он является жидким (и это единственный неметалл с таким состоянием) и обладает теми же характеристиками, что и галогены. По своей реакционной способности он находится между хлором и йодом. Визуально он тягучий и красно-коричневый, прямо как NO2, но спутать их невозможно из-за запаха, ярко выраженного и негативно воспринимаемого обонянием.
Элемент повсеместно распространен и сегодня, причем наивысшее его содержание фиксируется в соленых озерах и морях (откуда он может попадать и в пресные источники). За счет более высокой плотности бром растворяется в воде очень легко, делая ее оранжевой.
Есть два способа приготовления – рассмотрим каждый. Согласно первому методу, нужно:
- взять 4 мл Br и 1 л дистиллированной H2O;
- интенсивно перемешать их в закрытой колбе.
При всей кажущейся простоте действия важно соблюдать предельную осторожность и работать только в защитной одежде и в вытяжном шкафу. Все потому, что при соединении двух компонентов выделяются ядовитые испарения.
Более безопасный, а значит и удобный вариант – расщепление порошка NaBr и помощью отбеливателя (с хлором, но без добавок и ароматизаторов) и HCl. Происходит следующим путем:
- ингредиенты соединяются в стакане;
- полученный раствор отправляют в чистую емкость (бутылку), в которую вливают средство бытовой химии;
- резервуар закрывают крышкой, проверяя плотность ее прилегания, и аккуратно встряхивают;
- результат смешивают с дистиллятом H2O.
Чем отличается бромная вода от брома: состав
Растворяясь, рассматриваемый нами элемент запускает реакции оксидации, которые приводят к диспропорциональному выделению бромида и гипобромита – в соответствии с представленной ниже закономерностью:
Br2 + H2O → BrO- + Br- + 2H+
Это продолжается таким же неравным образованием бромата и бромида – следующим образом:
3Br2 + 6OH → BrO3- + 5 Br- + 3H2O
Поведение присутствующих кислот определяет условия хранения. Содержать данный продукт необходимо в затемненной стеклянной посуде и не вынося на свет. Если пренебречь этими правилами и поднести жидкость под прямые солнечные лучи (или в тепло), это спровоцирует выделение кислорода. Что происходит с бромной водой в этом случае? Она не только теряет свои полезные характеристики, но и начинает испускать газ HBr, пары которого ядовиты и очень неприятно пахнут.
SF-mix ручной до 0,8 м3/ч
АМЕТИСТ — 02 М до 2 куб.м./сут.
Аэрационная установка AS-1054 VO-90
Химические свойства
Подобно галогеновым смесям является замечательным оксидантом, хотя и немного проигрывает в этом плане хлорному раствору. Эффективно окисляет марганец, железо, никель, кобальт, хром, другие металлы. Отдельной строкой идут фенолы, при добавлении которых замещенные соединения выпадут в осадок. Эта операция выполняется с небольшим вливанием H2O в роли катализатора (иначе она протекала бы несколько дней).
Важнейшей особенностью является качественная реакция взаимодействия с бромной водой: если она обесцветится при введении органического соединения, значит, в добавке есть как минимум одна двойная связь СС, и взятый в качестве образца углеводород непредельный.
В каждом из случаев происходит именно радикальная замена, поэтому обязательным условием для эффективного течения эксперимента является наличие катализаторов и/или яркий свет.
Все объясняется электрофильным сложением, и особенно четко эта закономерность видна по пропусканию через среду любого алкина или алкена, допустим, этилена. По местам разрыва начнут присоединяться атомы Br, продолжая цепи. А если в качестве примера взять муравьиную кислоту, то будет также выделяться H и CO2 (диоксид серы, бром, вода – характерная комбинация).
Физические свойства
Тягучая желто-оранжевая жидкость, возможно, с красновато-коричневым оттенком с явным и сразу узнаваемым неприятным запахом. Внимание, ее пары ядовиты, поэтому хранить ее следует не просто в темноте, а в герметично закрытой емкости.
Также необходимо избегать ее попадания на кожу. В случае непродолжительного контакта пораженное место будет достаточно сильно зудеть, а вот длительное воздействие уже грозит болезненными ожогами или даже появлением язвочек. Поэтому, если вы вдруг допустите неосторожность, как можно скорее промойте поврежденный участок, а если рана еще и глубокая, смажьте ее мазью с NaHCO3.
Применение
1. Актуальна в лабораторных условиях, при проведении анализов на наличие непредельных углеводородов и масел. Используется ключевая особенность – делается ставка на то, что раствор брома в воде обесцветится при добавлении алкинов или алкенов. Например, при взаимодействии с этиленом (эффективном и в ситуации с перманганатом калия) будут образованы двойные и тройные связи ионов Br с p-электронами и выделится дибромэтан.
2. В медицинской сфере на основе данной жидкости изготавливают широкий ряд препаратов, применять которые необходимо строго по предписанию врача. Почему? Из-за накопительного эффекта элемента, при передозировке вызывающего целый ряд неприятных последствий (их мы отдельно разберем ниже).
3. Еще одна ниша – производство антипиренов, востребованных в строительстве. Br2 входит в состав многих пропиток, которыми обрабатывают древесину, ткани и другие материалы для придания им огнеупорных свойств.
Отдельно отметим, что ракетное топливо часто подвергается процедуре окисления бромной водой, что помогает сократить его расход, а соли рассматриваемого вещества востребованы при выпуске инсектицидов и пестицидов.
Способы получения
По характеру использования оборудования их можно разделить на два вида – рассмотрим оба.
Механический – мы уже описывали его раньше, но для закрепления предоставим еще один пример с другими концентрациями. Итак, потребуется:
- 1 мл Br и на каждые 250 мл дистиллированной H2O;
- закрытая колба для перемешивания компонентов;
- вытяжной шкаф и спецодежда для безопасности проведения процесса.
В числе минусов, напоминаем, ядовитые испарения. После приготовления жидкость необходимо хранить в непрозрачной и герметичной стеклянной емкости.
Электрохимический – в данном случае схема такая:
- на электролизер направляется водный раствор KBr, NaBr или другого щелочного металла с концентрацией 60 г/л;
- под током плотностью 1 кА/м2 поток подают на мембрану МФ-4СК-100;
- этот фильтр улавливает частицы Na и пропускает Br, который, при взаимодействии с H2O, образует Br2 и сопутствующие кислоты (HBr, HBrO).
Преимущество данной технологии в том, что все ее этапы можно проводить, не находясь в непосредственной близости с веществами, а значит и не вдыхая ядовитые испарения и не рискуя получить ожог от капли, случайно попавшей на кожу. Еще один плюс – в промышленных масштабах, ведь при производстве жидкости объем не ограничен размером колбы.
Методы очистки воды от брома
Каждый из них представляет собой комплекс последовательно осуществляемых воздействий: аэрирование, удаление углекислот, фильтрование, регенерацию и воплощается в жизнь на специализированном оборудовании. Поэтому рассмотрим их тезисно.
- обработка адсорбентом, например, сильноосновным анионитом, смолой AB-17-8 – актуальна для стоков фармацевтических производств;
Примеры реакций, при которых бромная вода обесцвечивается
Все они являются качественными, то есть сопровождающимися ощутимым эффектом.
Диспенсер магистральный настольный AquaPro 919H/RO (горячая и холодная вода)
Диспенсер магистральный настольный AquaPro 929CH/RO (охлаждение/нагрев)
Диспенсер напольный AquaPro 311 (пустой, без охлаждения)
Первый случай – с алкеном, но также можно провести и другие аналогии:
CH2=CH2 – Br2 → Br – CH2–CH2 – Br
Второй – уже с алкином:
CH≡CH + Br2 → CHBr=CHBr
Есть еще одна показательная ситуация и связана она с этиленом, который нужно пропустить через рассматриваемую жидкость; тогда получим:
CH2=CH2 + Br2 → CH2Br–CH2Br
Алкадиены отличаются только тем, что у них сразу пара двойных связей, но взаимодействие будет таким же, как в примере №1. С кратными и тройными та же история.
Особняком стоит соединение, через которое зачастую пропускают изопрен, технический карбид кальция, нитраты алюминия и хрома. Это избыток бромной воды, формула которого записывается как 3Br2, и сочетание с ним приводит к самым разным результатам, в том числе и к выпадению осадка, и к образованию производных.
Значение Br для организма человека
Данный биогенный элемент оказывает важное влияние на здоровье, так как задействован в ряде реакций и входит в состав большинства тканей (мышечной, костной, зубной), содержится в крови, щитовидке, почках, а выводится с естественными выделениями.
У него комплексная роль:
- Способствует улучшению переваривания белка (за счет активации пепсина), регулирует кислотность желудочного сока.
- Оказывает влияние на катаболизм, улучшая выработку амилазы (расщепляет крахмал) и липазы (сложные жиры), снижает уровень сахара.
- Уменьшает потребление йода и концентрацию его радиоактивного изотопа, используется при профилактике эндемического зоба.
- Вытесняет хлор и позитивно воздействует на нервную систему, являясь отличным помощником при истерии, стрессах, бессоннице, эпилепсии, гипертонии.
- Улучшает работу гипофиза, надпочечников, желез внутренней секреции.
Отдельно отметим, как бромная вода реагирует с эякулятом: она повышает количество сперматозоидов. Таким образом, она не просто не снижает половое влечение – этот миф мы развенчали в самом начале обзора, – а даже способствует сохранению мужской силы и укреплению либидо.
Как сказывается недостаток Br на человеческом здоровье
- О его дефиците говорят такие признаки:
- раздражительность и общая нервозность, нарушения сна;
- проблемы с пищеварением;
- малое содержание гемоглобина в крови;
- понижение уровня кислотности желудочного сока.
У детей также может наблюдаться отставание в росте. Но обычно элемента вполне хватает – он в достаточном количестве поступает с пищей, причем даже тогда, когда питание не самое сбалансированное.
Передозировка Br
Рассуждая о том, какие вещества взаимодействуют с бромной водой, нельзя забывать, что это жидкость, которая может вызвать серьезнейшую интоксикацию – в силу следующих причин:
- пренебрежение правилами безопасности и/или неосторожность на производстве, оборачивающаяся вдыханием паров;
- злоупотребление Валокордином, Корвалолом и другими подобными лекарственными препаратами;
- неверное использование пестицидов, удобрений, ядохимикатов при работе в саду или огороде.
- приступы сухого кашля;
- головокружение, спутанность сознания;
- спазмы в горле, слезотечение;
- жидкий стул;
- увеличение лимфоузлов.
Кроме того, элемент может накапливаться в организме и со временем спровоцировать бромизм, то есть хроническую интоксикацию, для которой характерны:
- постоянные бронхиты и риниты;
- вялость, апатия, упадок сил;
- ухудшение зрения и слуха;
- конъюнктивит;
- специфические угри на коже.
В обоих случаях нужно идти к врачам, просто в первом – в срочном порядке, а во втором – не затягивая.
Воспользовавшись услугами компании «Вода Отечества», поставляющей высококачественное оборудование для водоочистки, вам не придется беспокоиться о здоровье ваших близких и собственном. Своевременное обнаружение и устранение причин опасного превышения веществ очень важно.
Всегда следует внимательно следить за чистотой скважины (или другого источника), регулярно проводя проверки на наличие примесей. Если в очередном заборе будет обнаружена повышенная концентрация Br, обращайтесь к нам. У нас вас проконсультируют опытные специалисты, не просто знающие, какого цвета бромная вода, какие у нее свойства и с чем она взаимодействует, но и в каждой конкретной ситуации подбирающие лучшее оборудование для эффективной фильтрации.
Источник