- I. Реакции, в которых вода играет роль окислителя
- II. Реакции, в которых вода играет роль восстановителя
- III. Реакции внутримолекулярного окисления — восстановления воды.
- Реакции гидратации
- II. Гидратация оксидов
- III. Гидратация органических соединений, содержащих кратные связи
- Реакции гидролиза
- Вода: строение и свойства
- Физические свойства
- Химические свойства
- Химические свойства воды
- Химические свойства воды
- Формула воды
- Химическая и структурная формула воды
- Изотопные модификации воды
- Водород
I. Реакции, в которых вода играет роль окислителя
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н + 2О = 2NaOH + H 0 2↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2) Взаимодействие с неметаллами, имеющими низкую ЭО
(реакции происходят в жестких условиях)
C + Н + 2О = CO + H 0 2↑ («водяной газ»)
В присутствии щелочей кремний вытесняет водород из воды:
3) Взаимодействие с гидридами металлов
NaH + Н + 2 O = NaOH + H 0 2↑
4) Взаимодействие с угарным газом и метаном
Реакции используются в промышленности для получения водорода.
II. Реакции, в которых вода играет роль восстановителя
ти реакции возможны только с очень сильными окислителями, которые способны окислить кислород СО С. О. -2, входящий в состав воды, до свободного кислорода O2 или до пероксид-анионов [O2] 2- . В исключительном случае (в реакции с F2) образуется кислород со c o. +2.
1) Взаимодействие с фтором
2) Взаимодействие с атомарным кислородом
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
III. Реакции внутримолекулярного окисления — восстановления воды.
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
Термическое разложение — процесс обратимый; степень термического разложения воды невелика.
Реакции гидратации
I. Гидратация ионов.
Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 • 5H2O, FeSO4• 7Н2O и др., а также аквакомплексов: [Cr(H2O)6]CI3, [Pt(H2O)4]Br4 и др.
II. Гидратация оксидов
III. Гидратация органических соединений, содержащих кратные связи
Реакции гидролиза
I. Гидролиз солей
а) по катиону соли
Fe 3+ + Н2O = FeOH 2+ + Н + ; (кислая среда. рН
б) по аниону соли
СО3 2- + Н2O = НСО3 — + ОН — ; (щелочная среда. рН > 7)
в) по катиону и по аниону соли
NH4 + + СН3СОО — + Н2O = NH4OH + СН3СООН (среда, близкая к нейтральной)
II. Гидролиз карбидов металлов
III. Гидролиз силицидов, нитридов, фосфидов
IV. Гидролиз галогенов
V. Гидролиз органических соединений
Классы органических веществ
Продукты гидролиза (органические)
Альдегиды или кетоны
Галогенангидриды карбоновых кислот
Ангидриды карбоновых кислот
Сложные зфиры карбоновых кислот
Карбоновые кислоты и спирты
Глицерин и высшие карбоновые кислоты
Ди- и полисахариды
Пептиды и белки
Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза)
Источник
Вода: строение и свойства
Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Источник
Химические свойства воды
Вода окружает нас повсюду, без неё человек не может жить. Мы на каждом шагу встречаемся с собственно водой и с водными растворами (например, морской водой или даже водопроводной). А может ли вода вступать в химические реакции и в каких случаях это происходит? Сейчас мы это и узнаем.
Химические свойства воды
1. Вода при высокой температуре или пропускании тока разлагается на газообразные водород кислород:
2. Вода взаимодействует с активными металлами с образованием гидроксидов и газообразного водорода. К активным металлам относятся металлы первой и второй групп таблицы Менделеева. С щелочными металлами (металлы первой группы) реакции идут довольно активно, поскольку газообразный водород выделяется бурно, поэтому проводить их нужно очень аккуратно. Уравнение реакции между щелочным металлом калием и водой выглядит так:
2К + 2Н2О = 2КОН + Н2
Аналогично протекают и реакции между щелочно-земельными металлами (металлами второй группы) и водой.
3. Вода взаимодействует с менее активными металлами с образованием оксидов и газообразного водорода. Например, цинк при взаимодействии с водой даёт оксид цинка и водород:
Zn + O2 = ZnO + H2
С инертными металлами (в ряду напряжений они стоят после водорода) вода не взаимодействует.
4. Вода взаимодействует с основными оксидами с образованием гидроксидов :
МgO + H2O = Mg(OH)2
5. Вода взаимодействует с кислотными оксидами с образованием кислот:
SO3 + H2O = H2SO4
А ещё воды является чуть ли не главным растворителем. В ней растворяются и газы, и жидкости и твёрдые вещества, причём в зависимости от условий можно получать самые разные растворы. С образованием растворов связано понятие массовой доли растворённого вещества . Понимать, как рассчитывать массовую долю растворённого вещества, очень важно, поскольку в неорганической химии много задач связано именно с этим.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Формула воды
Химическая и структурная формула воды
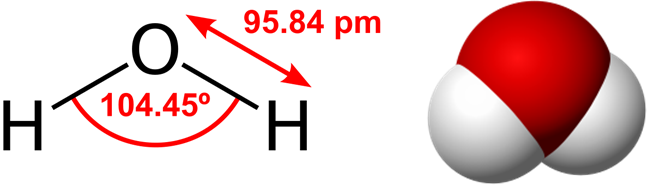
Химическая формула: Н2O
Молярная масса: 18,01528 г/моль.
Альтернативные названия: оксид водорода, гидроксид водорода, гидроксильная кислота, монооксид дигидрогена, оксидан, дигидромонооксид.
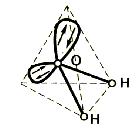
В молекуле воды атом кислорода находится в состоянии sp 3 –гибридизации, поскольку в образовании гибридных орбиталей участвуют не только валентные электроны, но и неподеленные электронные пары. Гибридные орбитали направлены к вершинам тетраэдра:
Вследствие большой разницы электроотрицательностей кислорода и водорода связи в молекуле сильно поляризованы, и происходит смещение электрон ной плотности в сторону кислорода. Молекула воды обладает большим дипольным моментом, поскольку полярные связи расположены несимметрично.
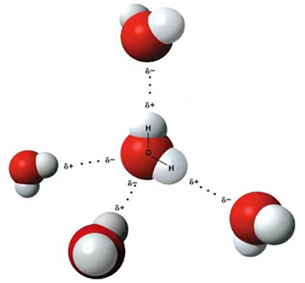
С сильной поляризацией связи О – Н связано образование водородных связей между молекулами воды. Каждая молекула воды может образовывать до четырёх водородных связей – две из них образует атом кислорода, а еще две – атомы водорода:
Образование водородных связей определяет более высокую температуру кипения, вязкость и поверхностное натяжение воды по сравнению с гидридами аналогов (серы селена и теллура).
Изотопные модификации воды
В зависимости от типа изотопов водорода, входящих в состав молекулы, выделяют следующие изотопные модификации воды:
| Название | Формула |
|---|---|