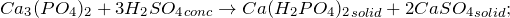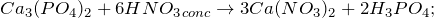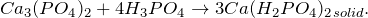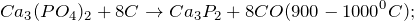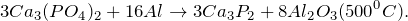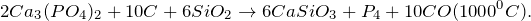- Фосфат кальция
- Характеристики и физические свойства фосфата кальция
- Получение фосфата кальция
- Химические свойства фосфата кальция
- Применение фосфата кальция
- Примеры решения задач
- Ca3(PO4)2 + H2O = ? уравнение реакции
- Фосфат кальция, характеристика, свойства и получение, химические реакции
- Фосфат кальция, характеристика, свойства и получение, химические реакции.
- Краткая характеристика фосфата кальция:
- Физические свойства фосфата кальция:
- Получение фосфата кальция:
- Acetyl
Фосфат кальция
Характеристики и физические свойства фосфата кальция
Существует в виде двух полиморфных модификаций: моноклинной и гексагональной.
Рис. 1. Фосфат кальция. Внешний вид.
Основные характеристики фосфата кальция приведены в таблице ниже:
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Растворимость в воде (20 o С), % (масс.)
Получение фосфата кальция
Лабораторные способы получения фосфата кальция предполагают действие ортофосфорной кислоты на соли кальция (1) или гидроксид кальция (2):
Химические свойства фосфата кальция
Фосфат кальция – это средняя соль, образованная сильным основанием – гидроксидом кальция (Ca(OH)2) и слабой кислотой – ортофосфорной (H3PO4). В водном растворе гидролизуется. Гидролиз протекает по аниону (теоретически возможны вторая и третья ступень). Наличие анионов ОН — свидетельствует о щелочном характере среды.
3Ca 2+ + 2PO4 3- + HOH ↔ HPO4 2- + 3Ca 2+ + OH — ;
Для фосфата кальция характерны все свойства солей:
— взаимодействие с сильными минеральными кислотами
— взаимодействие с солями, в результате которого одним из продуктов реакции является нерастворимое в воде соединение
— разложение при нагревании
Применение фосфата кальция
Фосфат кальция нашел применение в качестве добавки при производстве кормов для КРС и домашних птиц. Его используют при производстве минеральных удобрений, керамики и стекла. В пищевой промышленности фосфат кальция известен как добавка Е341 – разрыхлитель.
Примеры решения задач
| Задание | Вычислите массу фосфата кальция, который может прореагировать с концентрированным раствором соляной кислоты объемом 100 мл (массовая доля HCl 34%, плотность 1,168 кг/л). |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора соляной кислоты, а также массу растворенного вещества HCl в нем:
msolution =0,1 × 1,168 = 0,1168 кг = 116,8г.
msolute (HCl) = ω (HCl) / 100% ×msolution;
msolute (HCl) = 34 / 100% × 116,8 = 39,712 г.
Рассчитаем количество моль соляной кислоты (молярная масса равна 36,5 г/моль):
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 39,712 / 36,5 = 1,088 моль.
Согласно уравнению реакции n (HCl) :n (Ca3(PO4)2) =6: 1. Значит,
Тогда масса фосфата кальция, вступившего в реакцию будет равна (молярная масса – 310 г/моль):
| Задание | Какая масса оксида фосфора (V) образуется в ходе реакции термического разложения фосфата кальция массой 46 г? |
| Решение | Запишем уравнение реакции термического разложения фосфата кальция: |
Рассчитаем количество вещества фосфата кальция (молярная масса – 310 г/моль):
Согласно уравнению реакции n(Ca3(PO4)2) :n(P2O5) =1:1 . Тогда количество моль оксида фосфора (V) будет равно:
Найдем массу образовавшегося оксида фосфора (V) (молярная масса – 284 г/моль):
Источник
Ca3(PO4)2 + H2O = ? уравнение реакции
Подскажите, растворяется ли фосфат кальция в воде (Ca3(PO4)2 + H2O = ?)? Происходит ли при этом химическая реакция? Приведите основные физические параметры этой соли, расскажите о её химических свойствах и способах его получения.
Среди фосфатов в воде растворимы только соли щелочных металлов и аммония, а это значит, что химическая реакция между Ca3(PO4)2 + H2O = ? невозможна.
Фосфат кальция представляет собой твердое вещество белого цвета, кристаллы которого плавятся без разложения. Разлагается кислотами:
Восстанавливается углеродом и алюминием при спекании:
Из фосфата кальция можно получить белый фосфор по реакции:
Фосфат кальция получают по нижеуказанным реакциям:
Источник
Фосфат кальция, характеристика, свойства и получение, химические реакции
Фосфат кальция, характеристика, свойства и получение, химические реакции.
Фосфат кальция – неорганическое вещество, имеет химическую формулу Ca3(PO4)2.
Краткая характеристика фосфата кальция:
Фосфат кальция – неорганическое вещество бесцветного либо белого цвета, соль металла кальция и ортофосфорной кислоты.
Фосфат кальция представляет собой бесцветные кристаллы.
Химическая формула фосфата кальция Ca3(PO4)2.
Фосфат кальция существует в виде двух модификациях (α и β), отличающихся физическими свойствами (плотностью и температурой плавления). α-модификация фосфата кальция имеет моноклинную сингонию. β-модификация фосфата кальция имеет гексагональная сингонию.
Плохо растворим в воде. В отличие от многих химических веществ растворимость фосфата кальция падает с увеличением температуры.
Не растворим в жидком аммиаке, ацетоне, диэтиловом эфире, этаноле и пр. органических растворителях.
В пищевой промышленности используется 3 типа фосфатов кальция, согласно степени замещения атомов водорода:
– добавка Е341(i) – ортофосфат кальция 1-замещенный (Monocalcium ortophosphate) с химической формулой Ca(Н2PO4)2;
– добавка Е341(ii) – ортофосфат кальция 2-замещенный (Dicalcium ortophosphate) с химической формулой CaНPO4;
– добавка Е341(iii) – ортофосфат кальция 3-замещенный (Tricalcium ortophosphate) с химической формулой Ca3(PO4)2.
Фосфат кальция широко распространён в природе. Входит в состав минералов фосфорита, апатита, гидроксиапатита. Фосфаты кальция содержатся в коровьем молоке. В организме человека кальций существует в основном в виде фосфатов кальция. Кости человека на семьдесят процентов состоят из фосфатов кальция. Зубная эмаль тоже состоит в основном из гидроксиапатитов (соединений фосфата кальция).
Физические свойства фосфата кальция:
| Наименование параметра: | Значение: |
| Химическая формула | Ca3(PO4)2 |
| Синонимы и названия иностранном языке | calcium phosphate (англ.) |
кальций фосфорнокислый (рус.)
кальция ортофосфат (рус.)
трикальций фосфат (рус.)
Получение фосфата кальция:
Фосфат кальция получают из минералов, в которых он содержится: фосфорита, апатита, гидроксиапатита.
Фосфат кальция также получают в результате следующих химических реакций:
- 1. взаимодействием оксида кальция и ортофосфорной кислоты:
- 2. взаимодействием гидроксида кальция и ортофосфорной кислоты:
- 3. взаимодействием фосфата лития и хлорида кальция:
- 4. взаимодействием фосфата натрия и хлорида кальция:
- 5. разложения гидроортофосфата кальция:
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |