- Оксид фосфора (V): получение и свойства
- Химические свойства
- Р2О3 — кислотный оксид
- Р2О3 — очень сильный восстановитель
- Р2О5 — оксид фосфора (V)
- Способ получения
- Химические свойства
- Р2О5 — типичный кислотный оксид
- Р2О5 — водоотнимающий агент
- Фосфорные кислоты
- H3PO4 — фосфористая кислота
- Способы получения
- Физические свойства
- Химические свойства
- Кислотные функции
- Восстановительные свойства
- Восстановительные свойства
- Фосфиты — соли фосфористой кислоты
- Н3РO4 — ортофосфорная кислота
- Физические свойства
- Способы получения
- Химические свойства
- Кислотные функции
- Качественная реакция на анион РO4 3-
- Образование сложных эфиров
- Фосфаты. Фосфорные удобрения.
- Фосфорный ангидрид
- Содержание
- Строение
- Свойства
- Получение
- Применение
- Литература
- Полезное
- Смотреть что такое «Фосфорный ангидрид» в других словарях:
Оксид фосфора (V): получение и свойства
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей).
Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода.
Химические свойства
1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты.
Например , оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты:
2. Фосфорный ангидрид является типичным кислотным оксидом , взаимодействует с водой с образованием фосфорных кислот:
В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота:
Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь.
3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями .
Например , оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид фосфора взаимодействует с оксидом бария (при сплавлении):
Источник
Р2О3 — кислотный оксид
Как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Но при растворении в горячей воде происходит очень бурная реакция диспропорционирования Р2О3:
Взаимодействие Р2О3 со щелочами приводит к образованию солей фосфористой кислоты:
Р2О3 — очень сильный восстановитель
1. Окисление кислородом воздуха:
2. Окисление галогенами:
Р2О5 — оксид фосфора (V)
При обычной температуре — белая снегоподобная масса, не имеет запаха, существует в виде димеров Р4О10. При соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Способ получения
Фосфорный ангидрид образуется в результате сжигания фосфора в избытке воздуха:
Химические свойства
Р2О5 — типичный кислотный оксид
Как кислотный оксид Р2О5 взаимодействует:
а) с водой, образуя при этом различные кислоты
б) с основными оксидами, образуя фосфаты Р2О5 + ЗВаО = Ва3(PO4)2
в) со щелочами, образуя средние и кислые соли
Р2О5 — водоотнимающий агент
Фосфорный ангидрид отнимает у других веществ не только гигроскопическую влагу, но и химически связанную воду. Он способен даже дегидратировать оксокислоты:
Это используется для получения ангидридов кислот.
Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, но большое число кислот, в которых он находится в степенях окисления +5, +4, +3, +1. Строение наиболее известных кислот выражается следующими формулами
Как видно из этих формул, фосфор во всех случаях образует пять ковалентных связей, т.е. имеет валентность, равную V. В то же время степени окисления фосфора и основность кислот различаются.
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
H3PO4 — фосфористая кислота
Важная особенность фосфористой кислоты обусловлена строением ее молекул. Один из 3-х атомов водорода связан непосредственно с атомом фосфора, поэтому не способен к замещению атомами металла, вследствие чего эта кислота является двухосновной. Формулу фосфористой кислоты записывают с учетом этого факта следующим образом: Н2[НРО3]
Является слабой кислотой.
Способы получения
1. Растворение Р2О3 в воде (см. выше).
2. Гидролиз галогенидов фосфора (III): PCl3 + ЗН2О = Н2[НРО3] + 3HCl
3. Окисление белого фосфора хлором: 2Р + 3Cl2 + 6Н2О = 2Н2[НРО3] + 6HCl
Физические свойства
При обычной температуре H3PO3 — бесцветные кристаллы с т. пл. 74°С, хорошо растворимые в воде.
Химические свойства
Кислотные функции
Фосфористая кислота проявляет все свойства, характерные для класса кислот: взаимодействует с металлами с выделением Н2; с оксидами металлов и со щелочами. При этом образуются одно — и двухзамещенные фосфиты, например:
Восстановительные свойства
Кислота и ее соли — очень сильные восстановители; они вступают в окислительно-восстановительные реакции как с сильными окислителями (галогены, H2SО4 конц., К2Сr2O2), так и с достаточно слабыми (например, восстанавливают Au, Ag, Pt, Pd из растворов их солей). Фосфористая кислота при этом превращается в фосфорную.
При нагревании в воде Н3РO3 окисляется до H3PO4 с выделением водорода:
Восстановительные свойства
При нагревании безводной кислоты происходит диспропорционирование: 4Н3РO3 = ЗН3РO4 + РН3
Фосфиты — соли фосфористой кислоты
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2Р03.
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2- 1 анионами HPO3.
Большинство фосфитов плохо растворимы в во-де, хорошо растворяются только фосфиты щелочных металлов и кальция.
Н3РO4 — ортофосфорная кислота
3-основная кислота средней силы. Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Физические свойства
При обычной температуре безводная Н3РO4 представляет собой прозрачное кристаллическое вещество, очень гигроскопичное и легкоплавкое (т. пл. 42°’С). Смешивается с водой в любых соотношениях.
Способы получения
Исходным сырьем для промышленного получения Н3РO4 служит природный фосфат Са3(РO4)2:
I. 3-стадийный синтез:
II. Обменное разложение фосфорита серной кислотой
Получаемая по этому способу кислота загрязнена сульфатом кальция.
III. Окисление фосфора азотной кислотой (лабораторный способ):
Химические свойства
Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами, с основными оксидами и основаниями, образует соли аммония.
Кислотные функции
в) со щелочами, образуя средние и кислые соли
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Качественная реакция на анион РO4 3-
Реактивом для обнаружения анионов РO4 3- (а также НРO4 2- , Н2РO4 — ) является раствор AgNO3, при добавлении которого образуется нерастворимый желтый фосфат серебра:
Образование сложных эфиров
Сложные эфиры нуклеозидов и фосфорной кислоты являются структурными фрагментами природных биополимеров — нуклеиновых кислот.
Фосфатные группы входят также в состав ферментов и витаминов.
Фосфаты. Фосфорные удобрения.
Н3РO4 как 3-основная кислота образует 3 типа солей, которые имеют большое практическое значение.
Растворимость в воде
большинство нерастворимо (кроме фосфатов щелочных Me и аммония)
Источник
Фосфорный ангидрид
Фосфорный ангидрид
| Оксид фосфора(V) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид фосфора(V) |
| Химическая формула | P2O5 |
| Отн. молек. масса | 283.889 а. е. м. |
| Молярная масса | 283.889 г/моль |
| Физические свойства | |
| Плотность вещества | 2.39 г/см³ |
| Состояние (ст. усл.) | белый порошок |
| Термические свойства | |
| Температура плавления | 420 о С(Н-форма),569 (О-форма) °C |
| Температура кипения | возгоняется при 359 (Н-форма) °C |
| Энтальпия (ст. усл.) | -3010,1 кДж/моль |
| Химические свойства | |
| Растворимость в воде | реагирует г/100 мл |
| Классификация | |
| номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
Пентаокс́ид фосфора (фо́сфорный ангидрид, пятиокись фосфора, оксид (V) фосфора — P2O5, кислотный оксид.
Содержание
Строение
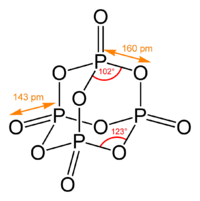
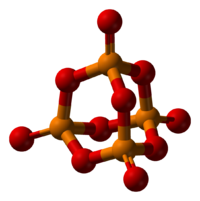
Пары оксида фосфора (V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфоном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b — 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P4O10 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360 о С) и активно взаимодействует с водой.
Другие модификации имеют слоистую полимерную структуру, также построенную из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (
580 о С) и менее химически активны. H-форма переходит в О-форму при 300-360 о C.
Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
Оксид фосфора (V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
Также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
При сплавлении P4O10 с основными оксидами образует различные твердые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной киcлоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Литература
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Реми Г. «Курс неорганической химии» М.: Иностранная литература, 1963
- Ф. Коттон, Дж. Уилкинсон «Современная неорганическая химия» М.: Мир, 1969
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Фосфорный ангидрид» в других словарях:
ФОСФОРНЫЙ АНГИДРИД — (р2о5) оксид фосфора V (см.); белый порошок, очень гигроскопичен, с водой образует фосфорные (см.); используется как сильный осушитель газов и жидкостей. При попадании на кожу и попытке смыть его водой гарантирован сильный термохим. ожог. При… … Большая политехническая энциклопедия
фосфорный ангидрид — fosforo(V) oksidas statusas T sritis chemija formulė P₂O₅ atitikmenys: angl. phosphorus pentoxide; phosphorus(V) oxide rus. фосфора пентоксид; фосфора пятиокись; фосфора(V) оксид; фосфорный ангидрид ryšiai: sinonimas – difosforo pentoksidas … Chemijos terminų aiškinamasis žodynas
Фосфорный ангидрид — пяти окись фосфора, оксид фосфора (V) P4O10 (P2O5), ангидрид фосфорных кислот. См. Фосфора окислы … Большая советская энциклопедия
фосфорный ангидрид — пятиокись фосфора … Cловарь химических синонимов I
Фосфористый ангидрид фосфорноватая окись фосфорный ангидрид — см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ангидрид — Ангидриды в неорганической химии солеобразующие оксиды, проявляющие кислотные свойства (см. Кислотные оксиды). Ангидриды в органической химии соединения, состоящие из двух кислотных остатков (например, карбоновых или фосфиновых… … Википедия
Ангидрид — (от греч. an отрицательная частица и hýdōr вода) химическое соединение какого либо, элемента с кислородом, которое можно получить, отнимая воду от соответствующей кислоты. Известны А. как неорганических, так и органических кислот. А.… … Большая советская энциклопедия
Фосфористый ангидрид — фосфорноватая окись, фосфорный ангидрид см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
пятиокись фосфора — фосфорный ангидрид … Cловарь химических синонимов I
ФОСФОРНАЯ КИСЛОТА — фосфорный ангидрид, пятиокись фосфора (химическое обозначение Р2О5), белый порошок, жадно поглощающий воду, получается при горении фосфора. По содержанию фосфорного ангидрида в фосфорных удобрениях рассчитывается количество их на 1 га при… … Сельскохозяйственный словарь-справочник
Источник




