Фталевая кислота
| Фталевая кислота | |
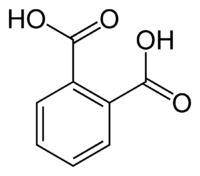 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | бензол-1,2-дикарбоновая кислота |
| Химическая формула | С8H6O4 |
| Физические свойства | |
| Молярная масса | 166,14 г/моль |
| Плотность | 1,593 г/см³ |
| Термические свойства | |
| Температура плавления | 191—230 °C |
| Химические свойства | |
| pKa | 2,98, 5,28 |
| Растворимость в воде | 0,6 г/100 мл |
| Классификация | |
| Рег. номер CAS | 88-99-3 |
| SMILES | C1=CC=C(C(=C1) C(=O)O)C(=O)O |
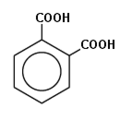
Фталевая кислота — простейший представитель двухосновных ароматических карбоновых кислот. Её соли и эфиры называют фталатами.
Содержание
История
Фталевая кислота впервые была получена французским химиком Огюстом Лораном в 1836 году, который окисляя тетрахлорид нафталина, получил ортофталевую кислоту. Полагая, что полученное им вещество является производной нафталина, он назвал его «нафталиновой кислотой». Швейцарский химик Жан Шарль Галиссард де Мариньяк определил формулу полученного вещества и указал на эту ошибку, и Лоран дал ему современное название.
Изомерия
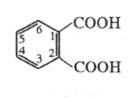
Фталевая кислота имеет три изомера, отличающиеся друг от друга взаимным расположением карбоксильных групп -COOH:
- бензол-1,2-дикарбоновая кислота (ортофталевая кислота, или фталевая кислота);
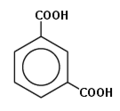
- бензол-1,3-дикарбоновая кислота (метафталевая кислота, или изофталевая кислота);
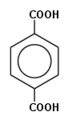
- бензол-1,4-дикарбоновая кислота (парафталевая кислота, или терефталевая кислота).
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Физические свойства
Орто-, мета- и парафталевые кислоты — бесцветные кристаллы, практически нерастворимые в воде, с температурой плавления, соответственно, 200 °C (разлагается на воду и фталевый ангидрид), 348 °C и 425 °C (в запаянном капилляре).
Получение
Ортофталевую кислоту получают главным образом из фталевого ангидрида.
Мета- и парафталевые кислоты получают окислением мета- и параксилолов соответственно. В качестве окислителя используются перманганат калия или бихромат натрия.
Применение
Практическое значение имеют эфиры ортофталевой кислоты (например, дибутилфталат, диоктилфталат), высококипящие жидкости, применяемые как пластификаторы поливинилхлорида, полистирола и многих других полимеров. Также их используют в качестве манометрических жидкостей, репеллентов, например диметилфталат. Динитрил ортофталевой кислоты (фталонитрил) используют в производстве фталоцианиновых красителей и полифталоцианинов.
Широко применяются полиэфирные смолы на основе ортофталевой кислоты и многоатомных спиртов, например глицерина и пентаэритрита, называемых соответственно глифталевыми и пентафталевыми смолами (алкидные смолы).
На основе мета- и парафталевых кислот в промышленности производят ароматические полиамиды, например поли-м-фениленизофталамид, и полиарилаты.
В производстве толстоплёночных гибридных интегральных схем терефталевая кислота вводится в пасту для придания ей тиксотропности для удобства нанесения.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Фталевая кислота» в других словарях:
ФТАЛЕВАЯ КИСЛОТА — То же, что нафталиновая кислота. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910 … Словарь иностранных слов русского языка
Фталевая кислота — о Фталевая кислота (о бензолдикарбоновая кислота) кристаллы в виде белых блестящих листочков. Температура плавления 200 C, при плавлении разлагается до фталевого ангидрида. Растворимость в 100 г растворителя: в воде 0,57 г (20,0 C), метиловом… … Официальная терминология
фталевая кислота — ftalio rūgštis statusas T sritis chemija formulė C₆H₄(COOH)₂ atitikmenys: angl. phthalic acid rus. фталевая кислота ryšiai: sinonimas – 1,2 benzendikarboksirūgštis … Chemijos terminų aiškinamasis žodynas
ФТАЛЕВАЯ КИСЛОТА — (1,2 бензолдикарбоновая к та, 0 фталевая к та), мол. м. 166,14; бесцв. кристаллы; т. пл. 211 0C (с разл.); 1,593; кДж/(кг … Химическая энциклопедия
Изофталевая кислота — Фталевая кислота – простейший представитель двухосновных ароматических карбоновых кислот. Её соли и эфиры называют фталатами. Содержание 1 Иcтория 2 Изомерия 3 Физические свойства 4 … Википедия
Азотная кислота — I (acidum nitricum, acide azotique) крепкая водка, или селитряная кислота HNO3 или NO2ОН одна из важнейших минеральных кислот. В природе в свободном состоянии не встречается, а всегда только в форме азотнокислых солей; так, в виде азотнокислого… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Терефталевая кислота — n фталевая кислота, одна из трёх изомерных бензолдикарбоновых кислот; см. Фталевые кислоты … Большая советская энциклопедия
Гексагндробензойная кислота — Г. фталевая кислота см. Гидроароматич. соединения, Г. бензол см. Гидроаромат. соед. и Циклогексан, Г. толуол см. Гидроаромат. соед. и Циклогептан … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ИЗОФТАЛЕВАЯ КИСЛОТА — (1,3 бензолдикарбоновая к та, м фталевая к та), мол. м. 166,14; бесцв. кристаллы; т. пл. 348 °С; возгоняется; d420 1,507; DH0 сгор 802 кДж/моль,DH0 субл 106,7 кДж/моль; давление пара (в кПа): 0,009 (100°С), 0,08 (125 °С), 3,98… … Химическая энциклопедия
ТЕРЕФТАЛЕВАЯ КИСЛОТА — (1,4 бензолдикарбоновая к та, л фталевая к та), мол. м. 166,14; бесцв. кристаллы тритон, сингонии (ниже 150°С а= 0,7730 нм, b Ч0,6443 нм, с =0,3749 нм, a = 92,71°, b = 109,5°, g = 95,95°; выше 150°С а=0,7452 нм, b =0,6856 нм,… … Химическая энциклопедия
Источник
ФТАЛЕВАЯ КИСЛОТА
ФТАЛЕВАЯ КИСЛОТА (1,2-бензолдикарбоновая к-та, 0-фталевая к-та), мол. м. 166,14; бесцв. кристаллы; т. пл. 211 0 C (с разл.); 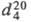
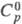
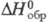
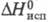
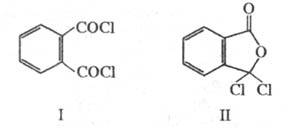
Ф талевая кислота обладает св-вами бензолполикарбоновых кислот. При нагр. или действии дегидратирующих агентов легко превра щается во фталевый ангидрид. При взаимод. с PCl 5 образует фталоилдихлорид (ф-ла I), к-рый при действии AlCl 3 перегруппировывается в изомерную несимметричную форму (П); при нагр. соед. II легко переходит в I.
В водной нейтральной среде фталевая кислота хлорируется сначала до 4-хлор-, а затем до 4,5-дихлорфталевой к-ты, при хлорировании в кислой среде дает тетрахлорпроизводное. Нитрование фталевой кислоты приводит к смеси приблизительно одинаковых кол-в 3-и 4-нитропроизводных. При 200 0 C (кат.- соли Zn, Ni, Cu) фталевая кислота декарбоксилируется до бензойной к-ты, при 350 0 C в присут. CdO — до бензола. С основаниями фталевая кислота образует соли по одной или двум карбоксильным группам, со спиртами -моно- и диэфиры; соли и эфиры фталевой кислоты наз. фталатами. Из эфиров наиб. практич. значение имеют диметилфталат и дибутилфталат. Калиевая соль фталевой кислоты при 400 0 C в присут. фталата Zn или Cd изомеризуется в соль терефталевой к-ты. При восстановлении Zn-пылью в CH 3 COOH фталевая кислота превращается в 1(ЗH)-изобензофуранон — фталид.
В природе фталевая кислота содержится в зелени и семенных коробочках мака Papaver somniferum.
В пром-сти фталевую кислоту получают в виде ее ангидрида окислением о-ксилола или нафталина (о получении см. Фталевый ангидрид).
Эфиры фталевой кислоты — бутил-, изобутил-, октил- и изооктилфтала-ты — пластификаторы полимеров, высококипящие р-рители; диметил-, диэтил- и дибутилфталаты — репелленты.
Ф талевая кислота малотоксична; ЛД 50 7,9 г/кг (мыши, перорально).
Источник
Фталаты, их роль и влияние на здоровье человека
Фталаты — данное название объединяет группу веществ, которые по своей химической сути являются эфирами фталевой кислоты. Получают последнюю путем окисления нафталина. Она представляет собой бесцветные кристаллы, температура плавления которых 200 °С. В процессе нагрева данная кислота превращается во фталевый ангидрит.
Соли и эфиры фталевой (ортофталевой) кислоты, широко используются в промышленности в виде пластификаторов для придания мягкости, прочности, гибкости и эластичности, пластиковым изделиям. 90% этих пластификаторов используют при производстве поливинилхлорида (ПВХ), а 10% применяют для изготовления резины, красок и др.
По оценкам Агентства по охране окружающей среды (EPA), ежегодно производится более 213 тыс. тонн фталатов.
Фталаты содержатся в медицинских изделиях, в игрушках, в разных упаковках, в пластиковых картах, ковровых и настенных покрытиях. Также они содержатся в шлангах, трубах, в обивке для автомобилей, оконных рамах, в смазочных материалах. Они содержатся и в моющих средствах и косметике, во многих лаках для ногтей, лаках для волос, шампунях, антиперспирантах, солнцезащитной косметике.
Как пластификаторы фталаты применяются при изготовлении строительных материалов, медицинского оборудования, товаров для детей. Всем нравятся красивые натяжные потолки, которые придают помещению современный, красочный вид. Но низкокачественная пленка, содержащая фталаты, может стать «невидимым убийцей». Катетеры, всевозможные контейнеры для крови и других материалов, оболочка некоторых лекарственных препаратов – это ещё одна область применения фталатов,
Косметические средства мы используем каждый день. Эксперты, исследовав рынок продукции для красоты, были удивлены результатами. Практически каждый второй лак для ногтей содержит фталаты. Шампуни, кондиционеры, дезодоранты, косметика с солнцезащитными фильтрами – в состав всех этих средств входят небезопасные соли фталевой кислоты. Практически каждая туалетная вода или духи содержит диэтилфталат – вещество, которое является фиксатором запаха, заменителем спирта. Многие косметические средства, помады, кремы имеют в своем составе скрытые фталаты. Чаще всего вредные компоненты называют одним, на первый взгляд не вызывающим подозрения словом «отдушка». Однако один из главных компонентов такой композиции – соли фталевой кислоты[1].
Какой вред наносят фталаты здоровью?
Если использование фталатов не превышает допустимых граничных показателей, то резкого отрицательного воздействия они не вызовут. Однако главная опасность таится в другом. Данные химические соединения способны накапливаться в нашем организме. Чем больше в теле находится токсических элементов, тем более тяжелыми могут стать последствия. Попадая в организм, фталаты распространяются по всем органам, нанося вред гормональной системе, печени, легким. Фталаты имитируют структуру полового гормона эстрогена. Попадая в организм человека, они способны вызвать серьезные нарушения в эндокринной, половой системах. Фталаты в организме мужчины угнетают выработку тестостерона. У женщин они провоцируют развитие рака груди, заболевания яичников. Большое количество данных веществ может привести к бесплодию у обеих полов. К тому же, установлено, что фталаты могут нанести вред и при беременности, так как легко проникают сквозь плаценту. Помимо того, что нарушается нормальное течение беременности, у детей в утробе матери возникают проблемы с репродуктивной системой
Учеными в США было отмечено, что фталаты, содержавшиеся в крови матерей мальчиков, копировали женские половые гормоны, то есть оказывали феминизирующее воздействие на гениталии мальчиков. Позже другая группа ученых установила, что сыновья матерей, которые подверглись воздействию фталатов во время беременности, ведут себя чаще как девочки.
Болгарские специалисты указали на возможную взаимосвязь между повышенным содержанием фталатов в воздухе и развитием астмы у детей. Медицинским центром (Mount Sinai), была установлена связь между излишним весом и фталатами. Самые полные девочки имели самый высокий уровень фталатов в крови[2].
Запрещены ли фталаты? Токсичные фталаты запрещены при производстве игрушек и товаров для детей во многих странах Европы и в Америке. В частности, это дифталат, бутилфенил-фталат и др. Еще несколько разновидностей находятся под частичным запретом (до обнародования результатов исследования). Многие цивилизованные государства уже рассматривают возможность запрета на использование фталатов. Стоит отметить, что предпочтительней использовать высокомолекулярные соединения солей фталевой кислоты (например, ди-цзодецил-фталат).
Фталаты часто добавляют в изделия из ПВХ (PVC), которые маркируются треугольником из стрелок с цифрой 3 внутри, или буквой «V», или аббревиатурой «PVC». Но чаще всего производители не указывают, что именно содержится в продукте, и скрывают вредные вещества за словами «ароматизатор»/«отдушка»/«fragrance».
Маркировка фталатов
DBP — Ди (н-бутил) фталат
DEHP — Ди- (2-этилгексил) фталат
В США уже практически полностью запрещено использование трех видов фталатов (DEHP, DBP и BBP) в детских игрушках. С 2005 года в Европе действует постоянный запрет на использование в товарах для детей таких фталатов как DEHP , DBP, BBP, а также DINP, DNOP и DIDP — в товарах для детей младше трех лет. Пластификатор диэтилгексилфталат (DEHP) признан канцерогеном, вызывающим нарушения репродуктивной системы и раковые заболевания.
Как определить тип пластика?
Помочь в определении вида пластика может специальная международная система маркировки перерабатываемых пластмасс.
Для обеспечения утилизации одноразовых предметов в 1988 году Обществом Пластмассовой Промышленности была разработана система маркировки для всех видов пластика и идентификационные коды. Маркировка пластика состоит из 3-х стрелок в форме треугольника, внутри которых находится число, обозначающая тип пластика.
Пластики подразделяют на 7 видов, каждому из которых присвоен свой цифровой символ. Он информирует покупателей и переработчиков о типе изделия, возможностях его переработки и упрощает сортировку пластика. Под цифрой располагается буквенная аббревиатура. Самыми безопасными являются пластики под номером 1,2 и 4. Старайтесь избегать номеров 3, 6 и 7.
PET или PETE — полиэтилентерефталат (polyethylene terephthalate). Самый распространенный вид пластмасс. Обычно используется для изготовления бутылок под минеральную воду, соки и другие безалкогольные напитки, а также для упаковки и изготовления блистеров. Хорошо поддается переработке. Считается одним из самых безопасных видов пластмасс.
HDPE или ПВД (high-density polyethylene) – полиэтилен высокой плотности. Используется для изготовления непрозрачных пластиков бутылок для молока, молочных продуктов и сока, различных емкостей для бытовой химии и моторных масел, различных полужестких упаковок для пищевых продуктов и крышек. Очень хорошо поддается переработке и вторичному использованию. Считается безопасным для пищевого использования.
PVC, Vinyl или ПВХ (polyvinyl chloride) – поливинилхлорид. Этот пластик используется для производства труб, напольных и настенных покрытий, окон, садовой мебели, для изготовления жалюзи, клеенок, пленок для натяжных потолков, шторок для ванной, различного вида упаковок, пластиковых пакетов и даже игрушек.
Этот пластик относится к самому опасному виду пластмасс и практически не поддается переработке. При сжигании ПВХ выделяет в воздух канцерогенные диоксины (очень опасные яды). Для придания ПВХ эластичности в него добавляют пластификаторы (фталаты), что может вызывать у людей поражения печени и почек, бесплодие, рак. В ПВХ может содержаться Бисфенол А и такие тяжелые металлы как кадмий, хром, ртуть, свинец, формальдегид.
По возможности откажитесь от использования этого пластика или сократите его потребление.
LDPE или ПНД (low-density polyethylene) — полиэтилен низкой плотности. Обычно используется для изготовления пакетов для овощных и фруктовых отделов супермаркетов, пленок, мусорных мешков, гнущихся емкостей различного применения, различной упаковки. Хорошо поддается переработке и вторичному использованию, но его переработка низкорентабельна. Считается безопасными для пищевого использования.
PP или ПП (polypropylene) – полипропилен. Из него делаются крышки для большинства бутылок, диски, шприцы, ведра, стаканчики для йогурта, упаковка для фотопленок и другой продукции. Употребляется для изготовления игрушек, бутылочек для кормления детей. Полипропилен быстрее изнашивается и менее морозостоек, чем полиэтилен. Ученые полагают, что он не представляет опасности для здоровья человека и окружающей среды. Считается безопасными для пищевого использования.
PS или ПС (polystyrene) – полистирол. Используется для изготовления пищевых контейнеров и упаковок, столовых приборов и чашек, сандвич-панелей, плит теплоизоляции зданий. Полистирол получают в результате полимеризации стирола, который является канцерогенном.
По возможности откажитесь от использования этого пластика или сократите его потребление.
К группе «другие пластики» относятся все остальные пластмассы, которые нельзя причислить к вышеперечисленным категориям. Такие пластмассы не поддаются переработке. Часто к этой группе относят пластик, изготавливаемый из поликарбоната. При нагревании, частом мытье или долгом использовании из таких изделий (пищевые контейнеры и бутылки) может выделяться Бисфенол А (БФА), который вызывает гормональные нарушения в человеческом организме. В тоже время к этому типу пластмасс могут относиться экологичные, разлагающиеся виды пластмасс[3].
Как избежать токсичных химикатов?
Хотя держаться подальше от всех потенциально опасных химических веществ практически невозможно, всё-таки можно свести к минимуму их воздействие, если помнить о ключевых принципах:
— ешьте в основном свежие, сырые цельные продукты, обработанные и упакованные продукты особенно в пластмассовые банки, а также продукты упакованные в полиэтиленовую плёнку – распространённый источник БФА и фталатов ;
— покупая продукты, отдавайте предпочтение упакованным в стеклянную тару, а не в пластик;
— храните продукты питания и напитки в стеклянной, а не пластиковой таре, и не используйте полиэтиленовую плёнку. Разогревая еду в микроволновой печи, пользуйтесь стеклянной посудой, поскольку высокая температура увеличивает выделение химических веществ из пластика. Помните, что даже из «пластмассы без БФА» вымываются другие разрушающие эндокринную систему химические вещества, которые так же вредны, как и БФА;
— для детского питания используйте стеклянные бутылочки;
— делая ремонт в доме, обратите внимание на «зелёные» альтернативы без токсинов, вместо обычных красок и виниловых напольных покрытий, которые являются ещё одним источником фталатов;
— выбирайте игрушки, сделанные из натуральных материалов, чтобы избежать пластиковых химических веществ особенно в тех элементах, которые дети могут сосать или жевать;
— по возможности, кормите ребёнка только грудью, по крайней мере, в первый год жизни (так вы избежите воздействия фталатов из упаковки детского питания, пластиковых бутылочек и сосок);
— используйте натуральные чистящие средства или готовьте их сами;
— перейдите на органические туалетные принадлежности, включая шампунь, зубную пасту, дезодоранты и косметику;
— виниловую занавеску для душа замените на тканевую;
— ищите товары без отдушек, фталаты зачастую используются, чтобы продукт дольше удерживал аромат. В искусственных отдушках могут содержаться сотни потенциально опасных химических веществ. По той же причине старайтесь не пользоваться кондиционерами для белья, антистатиками, освежителями воздуха и ароматическими свечами;
— проверьте водопроводную воду на наличие загрязнений и при необходимости фильтруйте её. Кроме того, можно заменить водопроводные ПВХ-трубы на альтернативные[4].
— обращайте внимания на коды. Пластиковые продукты с кодом переработки 3 и 7 могут содержать фталаты или бисфенол А. Выбирайте пластик с кодами переработки 1, 2 или 5;
— не используйте чужие или старые пластиковые игрушки и приспособления для кормления детей. Закон, запрещающий использовать в них фталаты, был принят только в 2009 году;
— избегайте пластик там, где это возможно. Фталаты – не единственные вредные вещества, которые он может содержать. Заменой пластику могут быть нержавеющая сталь, силикон, стекло.
Литература
1.Липовская О. Фталаты — что это такое, где содержатся, какой вред наносят здоровью? [Электронный ресурс] / О. Липовская //Режим доступа: http://fb.ru/article/209483/ftalatyi-chto-eto-takoe-gde-soderjatsya-kakoy-vred-nanosyat-zdorovyu.- Дата доступа: 03.09.2018.
2. Вред фталатов [Электронный ресурс] / Режим доступа: http://vredpolza.ru/himia/item/22-vred-ftalatov.html.-Дата доступа: 03.09.2018.
3.Фталаты небезопасны для детей и взрослых [Электронный ресурс] / Режим доступа: http://www.babygreen.ru/ftalatyi/2009/09/30/103/.- Дата доступа: 02.10.2018.
4. Меркола Д. Разрушители эндокринной системы в предметах ежедневного употребления [Электронный ресурс] / Д. Меркола // Режим доступа: https://www.kramola.info/vesti/novosti/razrushiteli-endokrinnoy-sistemy-v-predmetah-ezhednevnogo-upotrebleniya.- Дата доступа: 15.10.2018 г.

© Галина Леферд, научный сотрудник лаборатории радиоэкологии
Источник