Газообразные вещества растворяются воде
Рис. 69. Кривые растворимости некоторых газов в воде
Все жидкости и газы, подобно твёрдым веществам, способны растворяться в воде. Некоторые жидкости, например этиловый спирт, глицерин, ацетон, серная, азотная и уксусная кислоты, неограниченно растворимы в воде — их можно смешивать с водой в любых соотношениях. Бензин, керосин, растительное масло, хлороформ и многие другие жидкости лишь незначительно растворимы в воде, и поэтому их считают практически нерастворимыми. Если такую жидкость, например растительное масло, вылить в воду и взболтать, то через некоторое время образуются два раздельных слоя — верхний (растительное масло) и нижний (вода). О таких жидкостях говорят, что они не смешиваются.
Газы также различаются по растворимости. Наибольшей растворимостью в воде обладают хлороводород HCl и аммиак NH3. При температуре 0 ° С и атмосферном давлении в 1 л воды может быть растворено 500 л хлороводорода и 1200 л аммиака. Водный раствор хлороводорода называют соляной кислотой, а разбавленный водный раствор аммиака — нашатырным спиртом. Растворимость других газов в воде существенно ниже. Так, в тех же условиях в 1 л воды растворяется лишь 1,7 л углекислого газа, 50 мл кислорода, 23 мл азота и 21,5 мл водорода. Хуже всех других газов растворим гелий — 9,7 мл в 1 л воды.
Если холодную водопроводную воду нагревать, не доводя до кипения, то на дне и стенках сосуда образуются пузырьки воздуха, выделяющегося из воды. Это объясняется тем, что растворимость всех газов уменьшается с ростом температуры (рис. 69).
В отличие от жидкостей и твёрдых тел, газы значительно лучше растворяются при повышении давления. Вам, наверное, приходилось открывать пластиковую бутылку с лимонадом или газированной водой. При изготовлении этих напитков воду насыщают углекислым газом при повышенном давлении, а бутылку герметично закрывают. При открывании бутылки давление в ней становится равным атмосферному, и избыточный углекислый газ начинает выделяться, нередко настолько бурно, что вместе с ним из бутылки выливается часть напитка.
Запомните: растворимость газов возрастает при понижении температуры и повышении давления .
Лабораторный опыт 14.
Зависимость растворимости газов
Наполните пробирку водопроводной водой так, чтобы в ней совсем не осталось воздуха, закройте отверстие пальцем, переверните пробирку вверх дном и опустите в стакан с водой. Высушите верхнюю часть пробирки сухой тряпкой или листом фильтровальной бумаги и нагрейте её пламенем спиртовки. Что вы наблюдаете? Предположите, какие газы были растворены в воде. Сделайте вывод об изменении растворимости газов при нагревании.
Вопросы и задания
1. Какие вы знаете жидкости и газы, хорошо растворимые в воде?
2. Почему аквариумы нельзя заполнять кипяченой водой?
3. В воду случайно попал бензин. Как его можно отделить от воды? Будет ли вода иметь запах бензина, если разделение проводить: а) в делительной воронке; б) путём дистилляции?
* 4. При атмосферном давлении и комнатной температуре в 1 л воды может быть растворено 880 мл углекислого газа, а при давлении, которое создаётся в закрытой бутылке, — около 1600 мл. Какой объём углекислого газа выделится при открывании бутылки газированной воды объёмом 2 л? Больше или меньше газа выделится, если бутылку предварительно охладить?
5. Какие из перечисленных газов: кислород, хлороводород, углекислый газ, азот, аммиак, гелий — можно собирать: а) над водой; б) только вытеснением воздуха? Почему?
Источник
Растворимость
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20 o С:
Растворимость, г на 100 г H2O
Растворимость, г на 100 г H2O
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Растворимость твердых веществ в жидкостях зависит от структуры твердого вещества (от типа кристаллической решетки твердого вещества). Например , вещества с металлическими кристаллическими решетками (железо, медь и др.) очень мало растворимы в воде. Вещества с ионной кристаллической решеткой, как правило, хорошо растворимы в воде.
Есть замечательное правило: “подобное хорошо растворяется в подобном”. Вещества с ионным или полярным типом связи хорошо растворяются в полярных растворителях. Например , соли хорошо растворимы в воде. В то же время неполярные вещества, как правило, хорошо растворяются в неполярных растворителях.
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20 o С растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Температура различным образом влияет на растворимость твердых веществ в воде. В большинстве случаев растворимость твердых веществ возрастает с повышением температуры. Например , растворимость нитрата натрия NaNO3 и нитрата калия КNO3 при нагревании увеличивается (процесс растворения протекает с поглощением теплоты). Растворимость NaCl при увеличении температуры возрастает незначительно, что связано с почти нулевым тепловым эффектом растворения поваренной соли.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Источник
Вопрос «Растворимость твердых, жидких , газообразных веществ в воде»
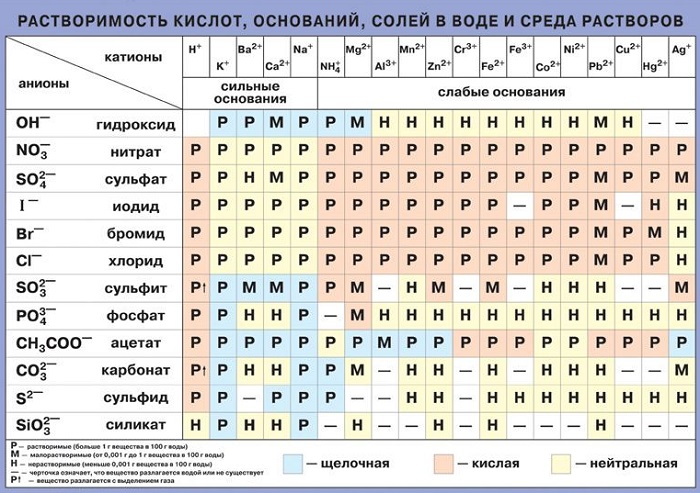
РАСТВОРИМОСТЬЮназывается способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе. Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. Если растворяется менее 1 г вещества – вещество малорастворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает. Даже когда мы наливаем воду в стеклянный сосуд, очень небольшая часть молекул стекла неизбежно переходит в раствор.
Растворимость, выраженная при помощи массы вещества, которое может раствориться в 100 г воды при данной температуре, называют также коэффициентом растворимости.
Растворимость некоторых веществ в воде при комнатной температуре.
| Название вещества | Формула | Агрегатное состояние | Растворимость (г/100 г воды) |
| Серная кислота | H2SO4 | жидкость | любое количество |
| Хлористый водород | HCl | газ | 71,9 |
| Хлорид натрия | NaCl | кристал. | 35,9 |
| Сульфат меди | CuSO4×5H2O | кристал. | 20,7 |
| Сульфат кальция | CaSO4 | кристал. | 0,2 |
| Тетрахлорид углерода | CCl4 | жидкость | 0,08 |
| Сульфат бария | BaSO4 | кристал. | 0,00023 |
| Хлорид серебра | AgCl | кристал. | 0,00015 |
Растворимость большинства (но не всех!) твердых веществ с увеличением температуры увеличивается, а растворимость газов, наоборот, уменьшается. Это связано прежде всего с тем, что молекулы газов при тепловом движении способны покидать раствор гораздо легче, чем молекулы твердых веществ.
Если измерять растворимость веществ при разных температурах, то обнаружится, что одни вещества заметно меняют свою растворимость в зависимости от температуры, другие – не очень сильно
При растворение тверд тел в водеобъем системы обычно изменяется незначительно .Поэтому растворимость веществ, находящихся в тверд состоянии , практически не зависит от давления.
Жидкости так же могут растворятся жидкостях. Некоторые из них неограниченно растворимы одна в другой , т.е смешиваются друг с другом в любых пропорциях , как например , спирт и вода , другие –взаимно растворяются лишь до известного предела . Так если взболтать диэтиловый эфир с водой то образуется два слоя : верхний представляет собой насыщенный раствор воды в эфире , а нижний – насыщенный раствор эфира в воде. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор , пока не будет достигнута температура , при которой обе жидкости смешиваются в любых пропорциях.
Растворение газов в водепредставляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается . Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покрываются пузырьками газа-это воздух, который был растворен в воде , выделяется из нее вследствие нагревания . Кипячением можно удалить из воды весь растворенный в ней воздух.
Источник
Вода как растворитель — свойства, значение и примеры
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
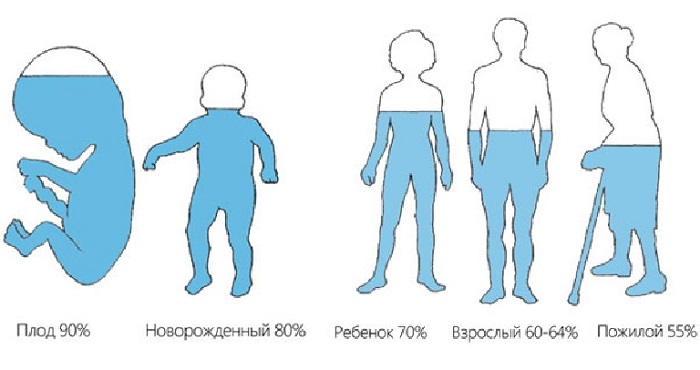
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
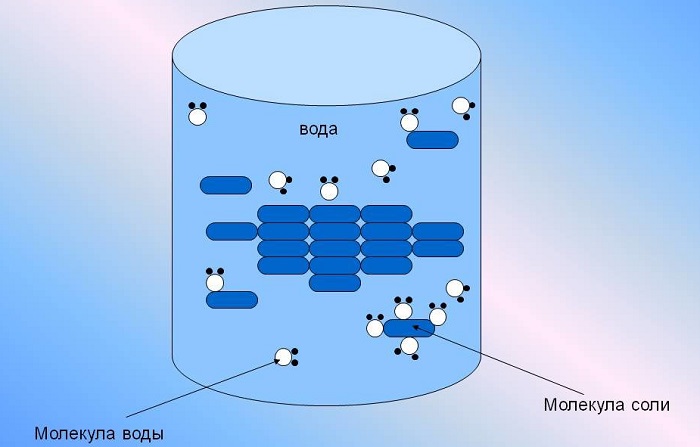
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250 0 С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
К средней степени взаимодействия относятся: бертолетова соль, метан, гипс, кислород, азот, другие химические элементы, например, сульфаты, некоторые газообразные вещества.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.
Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Источник