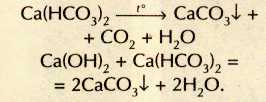Большая Энциклопедия Нефти и Газа
Раствор — баритовая вода
Раствор баритовой воды служит для контроля реакции галогеиарилиро — Вания, во время которой происходит выделение ССЬ. [1]
Выделяющаяся двуокись углерода при прохождении через раствор баритовой воды образует углекислый барий — баритовая вода мутнеет. [2]
Выделяющийся диоксид углерода при прохождении через раствор баритовой воды образует карбонат бария — баритовая вода мутнеет. [3]
Следующий метод, который может применяться для определения углекислого газа, основан на измерении электропроводности раствора баритовой воды или какой-либо другой щелочи, поглощающей углекислый газ. Этот метод называется кондуктометрическим. [4]
В присутствии катионов магния их отделяют в отдельной порции раствора, осаждая, например, действием раствора баритовой воды или щелочи в виде малорастворимого гидроксида Mg ( OH) 2, а затем проводят анализ в соответствии с тем, как описано в разделах 12 2.1 и 13.2.1. Если для отделения катионов магния использовать раствор гидроксида калия КОН, то катионы калия открывают до прибавления щелочи или же в отдельной пробе исходного анализируемого раствора. [5]
При осторожном подогревании пробирки со смесью содержимое ее буреет, выделяются пузырьки газа, которые, проходя через раствор баритовой воды , вызывают ее помутнение в связи с образованием углекислого бария. [6]
Скорость газа регулируют винтовым зажимом, помещенным на резиновой трубке, соединяющей бюретку с напорной грушей. По выходе из трубки газ попадает в поглотитель 5 с раствором баритовой воды , где происходит поглощение углекислоты. По окончании пропускания газа в бюретку набирают еще 50 мл кислорода и пропускают его с такой же скоростью для удаления газа, оставшегося в системе. По окончании сжигания нагревание прекращают. [7]
Правильность этих взглядов была подвергнута в последнее время Бахом и Шода 28 экспериментальной проверке. Для более детальной характеристики перекисей, образующихся при действии воздуха на оксидазы, они обрабатывали свежий сок Lathraea squamaria, содержащий оксидазу, током чистого воздуха, прибавляя по каплям 1 % — ный раствор баритовой воды ; при этом получился осадок барита, который не давал после промывания и разложения разбавленной серной кислотой известной реакции на перекись водорода с сернокислым раствором титановой кислоты, однако давал интенсивное синее окрашивание с иодокрахмальным реактивом. Аналогичный опыт, поставленный с соком Lathraea, ставшим неактивным при хранении, дал отрицательный результат. Таким образом, образование перекиси водорода при обработке активного сока баритовой водой должно было зависеть от присутствия оксидазы. [8]
В сухую пробирку помещают несколько кристалликов салициловой кислоты, закрывают пробирку пробкой с газоотводной трубкой, конец которой опускают в заранее приготовленную пробирку с 3 каплями раствора гидроокиси бария. Быстро нагревают пробирку с салициловой кислотой. Наблюдается частичное отщепление двуокиси углерода — декарбоксилирование и образование фенола, который определяется по характерному запаху. Выделяющаяся двуокись углерода при прохождении через раствор баритовой воды образует углекислый барий — баритовая вода мутнеет. [9]
Для реакции обычно пользуются мишенями из окиси бора. Облучение длительности более 1 — 2 часа бесполезно. Выход сильно растет с увеличением энергии дейтеронов и достигает 1 — 2 кюри на 25 цА — час при 16 MeV. Полученную радиоактивную С02 улавливают, например, в виде карбоната бария пропусканием в раствор баритовой воды . Все эти операции должны быть быстро проведены. [10]
Как в этом, так и в предыдущих случаях предполагается, что микроанализу на содержание углеводородов подвергается газ, содержащий достаточное для сожжения количество кислорода. Если кислорода мало, то его нужно добавить. После сожжения поворачивают кран с широким ходом и через него в камеру опускают петлю с пленкой баритовой воды ( фиг. Такая же трубка, содержащая соляную кислоту 2, служит для нейтрализации баритовой воды. Первоначально платиновую петлю окунают в раствор баритовой воды , а затем производят определение: далее пленку с кристаллами барита окунают в трубку с соляной кислотой. Широкие трубки прибора, в которых имеется твердая щелочь, позволяют манипулировать указанными трубками. [11]
Измеряют объем взятого газа, температуру и атмосферное давление, вводят в бюретку избыточный объем кислорода, свободного от углекислоты. Для смешения газа с кислородом смесь несколько раз переводят из бюретки в пипетку 3 со щелочью и обратно. В поглотитель 5 из бюретки для титрования наливают точно отмеренное количество ( около 15 мл) раствора едкого барита. Трубка 8 служит для предохранения раствора от соприкосновения с окружающим воздухом. Скорость газа регулируют винтовым зажимом, помещенным на резиновой трубке, соединяющей бюретку с напорным сосудом. По выходе из трубки газ попадает в поглотитель 5 с раствором баритовой воды , где происходит поглощение углекислоты. [12]
Источник
Баритовая вода
Баритовая вода используется как химический реагент при проведении химического анализа газов на содержание CO2, SO3 и т. д.
- Дополнить статью (статья слишком короткая либо содержит лишь словарное определение).
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Баритовая вода» в других словарях:
баритовая вода — barito vanduo statusas T sritis chemija apibrėžtis Sotusis Ba(OH)₂ tirpalas. atitikmenys: angl. baryta water rus. баритовая вода … Chemijos terminų aiškinamasis žodynas
Тривиальные названия неорганических соединений — Тривиальные названия названия, исторически закрепившиеся за какими либо соединениями, и не соответствующие никакой номенклатуре. # А Б В Г Д Е Ё Ж З И К Л М Н … Википедия
бария гидроксид — Ва(ОН)2, бесцветные кристаллы. Водяной раствор бария гидроксида баритовая вода. Применяется как реактив на сульфат и карбонат ионы, компонент смазок, для очистки растительных и животных масел, удаления сульфат иона из промышленных растворов. * * … Энциклопедический словарь
КЛЕЙДАЮЩИЕ ВЕЩЕСТВА — КЛЕЙДАЮЩИЕ ВЕЩЕСТВА, ВОЛОКНА. К. волокна или фибрилы (син.: кол лаге новые волокна, соединительнотканные волокна, нем. Bindegewebsfasern, франц. fibres conjonctifs), один из видов волокон соединительной ткани; названы так потому, что содержат… … Большая медицинская энциклопедия
БАРИЯ ГИДРОКСИД — Ba(OH)2, бесцветные кристаллы. Водный раствор бария гидроксида баритовая вода. Применяется как реактив на сульфат и карбонат ионы, компонент смазок, для очистки растительных и животных масел, удаления сульфат иона из промышленных растворов … Большой Энциклопедический словарь
Атропин — (датурин) алкалоид состава C17H23NO3, содержащийся во всех частях белладонны или сонной одури (Atropa Belladonna) и в семенах дурмана (Datura Strammonium); спутником его в природе является изомерный с ним алкалоид гиосциамин (см. это сл.), легко… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Кофеин — I (хим.) или теин (иначе метил теобромин или триметилксантин) горькое вещество (алкалоид) кофе и чая с эмпирическим составом, отвечающим формуле C8H10N4O2. Впервые в чистом виде получен из кофейных зерен Пеллетье и Каванту (1828); состав… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Шафран органическая краска — Ш., испорченное арабское слово азафран , представляет естественную органическую краску, которая прежде имела довольно большое значение. Пигмент заключается в пестиках цветка, которые собираются и высушиваются. Один килограмм сухого Ш.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Шафран, красящее вещество — Ш., испорченное арабское слово азафран , представляет естественную органическую краску, которая прежде имела довольно большое значение. Пигмент заключается в пестиках цветка, которые собираются и высушиваются. Один килограмм сухого Ш.… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
БАРИЯ ГИДРОКСИД — Ва(ОН)2, бесцв. кристаллы. Вод. раствор Б. г. баритовая вода. Применяется как реактив на сульфат и карбонат ионы, компонент смазок, для очистки растит. и животных масел, удаления сульфат иона из пром. растворов … Естествознание. Энциклопедический словарь
Источник
Где взять баритовую воду
Гидроксиды кальция, стронция и бария — щёлочи, хотя растворимость С а( ОН)2 и Sr(OH)2 при комнатной температуре низкая. У гидроксида кальция она падает с ростом температуры: наибольшей концентрации удаётся достичь, насыщая Са(ОН)2 ледяную воду (растворимость при О °С составляет 0,173 г на 100 г воды, при 20 °С — 0,166 г, а при 100 °С — 0,08 г). Насыщенный раствор С а( ОН)2 называется известковой водой.
Гидроксид бария растворяется значительно лучше (4,3 г на 100 г воды при 20 °С), причём при повышении температуры его растворимость резко воз растает (при 80 °С — 101,5 г на 100 г воды). Этим свойством пользуются для перекристаллизации вещества: медленно охлаждая насыщенный при 80 °С раствор, получают красивые пластинчатые кристаллы кристаллогидрата В а( ОН)2•8Н2О. По аналогии с известковой водой насыщенный раствор гидроксида бария называется баритовой водой.
Гидроксиды щелочных металлов всегда содержат примесь нерастворимого в воде карбоната, поскольку активно поглощают из атмосферы углекислый газ. Помутнение известковой воды — простейшая качественная реакция на это вещество: С а( ОН)2+СО2= CaCO3 ¯ +H2O. При дальнейшем пропускании углекислого газа осадок карбоната кальция растворяется, превращаясь в растворимую кислую соль — гидрокарбонат кальция: СаСО3+СО2+Н2О = С а( НСО3)2.
Подземные воды, насыщенные растворённым углекислым газом, просачиваясь сквозь пласты известняков, постепенно растворяют их, образуя пещеры. Гидрокарбонат кальция в свою очередь вновь переходит в карбонат (реакция легко протекает при нагревании или при добавлении щёлочи):
С этим связано интересное явление природы. Вода, попадая в подземные пещеры в известковых породах, посте пенно вновь выделяет известняк. В результате на сводах пещер растут сталактиты — сосульки, которые по мере стекания по ним воды удлиняются в толстые стержни. Навстречу им снизу поднимаются сталагмиты: они образуются из воды, падающей каплями на дно пещеры. Со временем сталагмиты нередко срастаются со сталактитами, становясь похожими на колонны. В таком сталактитовом «лесу» можно найти «деревья», достигающие в высоту тридцати метров.
В отличие от гидроксидов натрия и калия, гидроксиды щёлочноземельных металлов при нагревании разлагаются: С а( ОН)2 отщепляет воду при 580 °С, Sr(OH)2 — при температуре выше 400 °С, а Ва(ОН)2 — лишь при 800 °С.
Источник
Баритовая вода
| Гидроксид бария | |
|---|---|
| Общие | |
| Систематическое наименование | Гидроксид бария |
| Традиционные названия | едкий барит, бариевая щёлочь |
| Хим. формула | Ba(OH)2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 171,35474 г/моль |
| Плотность | 4,5 (20 °C) |
| Термические свойства | |
| Температура | |
| • плавления | 408 °C |
| • кипения | 780 °C |
| • разложения | 1000 °C |
| Энтальпия | |
| • образования | -950 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 3,89 (20 °C) |
| Классификация | |
| Рег. номер CAS | 17194-00-2 |
| PubChem | 6093286 |
| Рег. номер EINECS | 241-234-5 |
| SMILES | |
| RTECS | CQ9200000 |
| ChEBI | 32592 |
| Номер ООН | » data-wikidata-property-id=»P695″> |
| ChemSpider | 26408 и 21169506 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м³ |
| Токсичность | Едкий, ядовитый. |
| Пиктограммы ECB |    |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Медиафайлы на Викискладе | |
Гидрокси́д ба́рия (е́дкий бари́т) — неорганическое соединение, проявляющее сильные основные свойства. Химическая формула — Ba(OH)2. Насыщенный водный раствор гидроксида бария называется баритовой водой.
Содержание
Физические свойства
Гидроксид бария при стандартных условиях представляет собой бесцветные кристаллы. Гигроскопичен. Не растворим в спирте, но растворим в воде. Образует кристаллогидраты с одной, двумя, семью и восемью молекулами воды. Гидроксид бария токсичен, ПДК составляет 0,5 мг/м³.
Получение
1. Взаимодействие металлического бария с водой:
B a + 2 H 2 O ⟶ B a ( O H ) 2 + H 2 ↑ <\displaystyle <\mathsf
2. Взаимодействие оксида бария с водой:
B a O + H 2 O ⟶ B a ( O H ) 2 <\displaystyle <\mathsf
3. Взаимодействие сульфида бария с горячей водой:
B a S + 2 H 2 O ⟶ B a ( O H ) 2 + H 2 S ↑ <\displaystyle <\mathsf
Химические свойства
B a ( O H ) 2 + 2 H B r ⟶ B a B r 2 + 2 H 2 O <\displaystyle <\mathsf
B a ( O H ) 2 + H 2 S O 4 ⟶ B a S O 4 ↓ + 2 H 2 O <\displaystyle <\mathsf
2. Взаимодействие с кислотными оксидами с образованием соли и воды:
B a ( O H ) 2 + C O 2 ⟶ B a C O 3 ↓ + H 2 O <\displaystyle <\mathsf
B a ( O H ) 2 + S O 3 ⟶ B a S O 4 ↓ + H 2 O <\displaystyle <\mathsf
3. Взаимодействие с амфотерными оксидами
4. Взаимодействие с солями
Применение
Применяют гидроксид бария в виде баритовой воды как реактив на SO4 2− и CO3 2− (сульфат- и карбонат-ионы), для очистки растительных масел и животных жиров, как компонент смазок, для удаления SO4 2− (сульфат-ионов) из промышленных растворов, получения солей бария, а также гидроксидов рубидия и цезия из их сульфатов и карбонатов.
Источник