Гидриды — свойства, формулы и применение водородных соединений
Типы и классификация
Вещества, созданные водородом с металлами и неметаллами многобразны. В зависимости от характера полученного соединения, выделяют:
- Простые гидриды — бинарные, в них только 2 элемента, они встречаются чаще всего.
- Со многими переходными металлами (элементы р-подгруппы) водород образует ко́мплексные соединения. Ко́мплексные гидриды металлов (к примеру, боро- или алюмогидриды) вместо атома водорода, имеют алюмогруппу (AlH4) или борогруппу (BH4). Из них натрийборогидрид Na (BH4) и литийалюмогидрид Li (AlH4), будучи сильными восстановителями, нашли применение в лабораторной практике. Кроме этого, Na (BH4) используют для отбеливания бумаги.
- И также есть гидриды интерметаллидов (пример: TiAl или Ti3Al, алюминид титана), в кристаллических решётках которых водород просто растворяется, аккумулируется.
У разных химических элементов строение атомов и молекул отличается. Соответственно, связи в образованных гидридах тоже неодинаковы. Классификация по виду связи определяет полученные вещества, как:
- металлоподобные;
- ионные (солеобразные);
- ковалентные.
Бинарные соединения самые распространённые, есть у всех элементов. Исключения здесь металлы платиновой группы (платиноиды), Au, Ag, Hg, Ti, Cd, In, а также благородные газы. Между этими веществами нет чётко выраженных границ, деление по характеру связи для них немного условно.
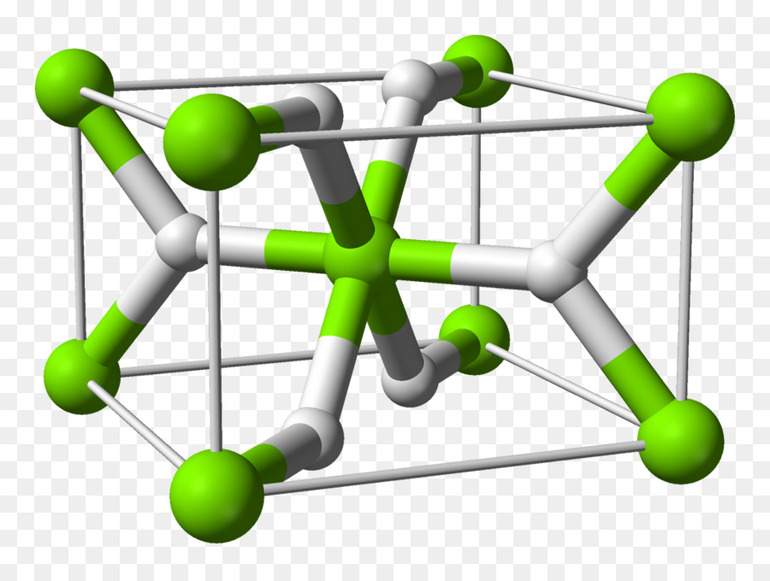
Металлические гидриды
К металлическим принадлежат соединения водорода с переходными металлами и редкоземельными элементами. Это, скорее, раствор неметалла в металле, с внедрением атомов в кристаллическую решётку. Характерно для них следующее:
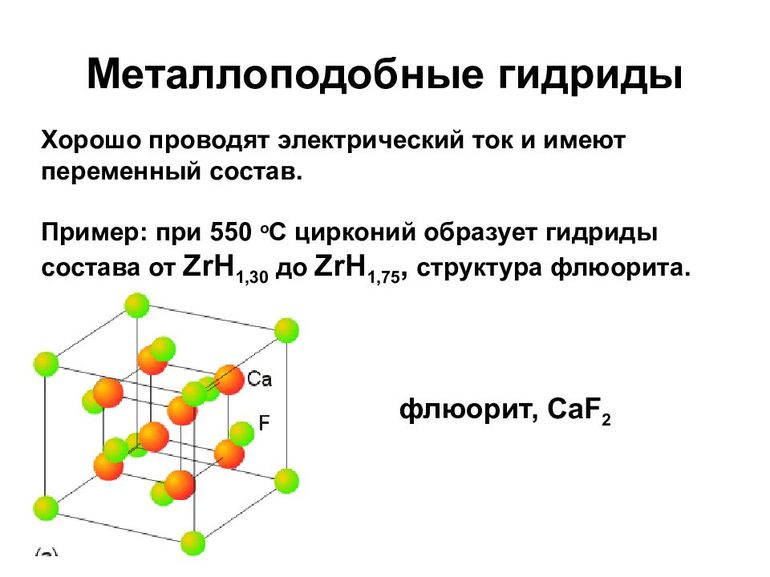
- В основном такие гидриды являются бертоллидами, состав их зависит от способа получения, непостоянен, законам постоянных и кратных отношений не подчиняется.
- В формулах для них указывают предельное содержание водорода.
- В отличие от прочих, они сохраняют исходную металлическую решётку.
- Их вид и физические свойства соответствуют металлам, с которыми они образованы.
- Имеют характе́рный металлический блеск, взаимодействуют с H2O (в жидком или газообразном состоянии), кислородом, при нормальных условиях, но медленно.
- Как и металлы, обладают значительной теплопроводностью и проводимостью.
- При нагревании распадаются на водород и исходный металл.
Образуются в процессе адсорбции водорода на металлической поверхности, диссоциации H2 и диффузного проникновения атомов в металлическую решётку. Поглощение обратимо, но химические связи весьма крепкие.
От металлоподобных, через гидриды меди (CuH, водородистая медь), цинка, ZnH2, водородистый цинк и им подобных, осуществляется переход к полимерам.
Это химические вещества со сложной структурой, в которой присутствуют цепи и полиэдры. Твёрдые, устойчивые, с кристаллическим строением (полимерные гидриды лёгких металлов стабильнее всего), данные соединения распадаются при нагреве на составляющие элементы.
От них, через гидриды бора и галлия — к водородным соединениям с неметаллами. В них водород имеет степень окисления +1.
Соединения с ионным типом связи
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
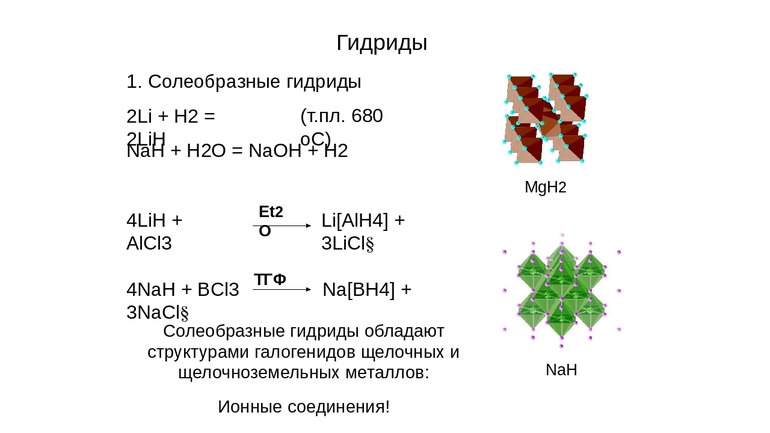
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
- Получают при высокой температуре и под давлением.
- В этих соединениях, проявляющих, как правило, щелочные свойства, у водорода степень окисления -1. С металлами 1А и 2А групп, такими, как Na, Li, Be, K, Rb, Sr он выступает окислителем, подобно галогенам. Например, гидрид натрия, с химической формулой NaH — в этом соединении ион водорода имеет отрицательный заряд.
- Это кристаллические вещества белого цвета, с ионной решёткой, структура подобна строению соответствующего галогенида.
- При нормальных условиях устойчивы.
- Распад на металл и водород при нагреве, минуя этап плавления (исключением является LiH, его температура плавления 688 градусов Цельсия).
- В расплаве — хорошие проводники, при этом на аноде будет выделяться H2.
- Вспыхивают при растирании на воздухе.
- Все являются сильными восстановителями. Применяются для получения чистых металлов из солей и оксидов, для удаления окалины, коррозии.
- Реагируют с оксидом углерода, формируют соли муравьиной кислоты (формиаты).
- Как и соли, могут участвовать в обменных реакциях, гидролизе.
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
Окислительная активность водорода небольшая по сравнению с галогенами. Дополнительный электрон он отдаёт с трудом, при нагреве (реакция проходит с поглощением тепла). Это и обусловливает различие между свойствами ионных гидридов и галогенидов.
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
- С водой: 2NaH + H2O = 2NaOH + H2O.
- С кислородом: NaH + O2 = NaO + H2O.
- Реакция разложения: CaH2 = Ca + H2.
- С оксидами углерода: NaH + CO2 = NaCOOH.
- Кремния: 4NaH + 3SiO2 = 2Na2SiO3 + Si + 2H2.
- Металлов: 4NaH + Fe3O4 = 4NaOH + 3Fe.
- Восстановление: 2NaH + 2SO2 = Na2SO4 + H2S.
- С аммиаком: NaH + NH3 = NaNH2 + H2.
- С кислотами: 2NaH + H2SO4 = Na2SO4 + 2H2.
- Со спиртами: KH + HO-R = KOR + H2.
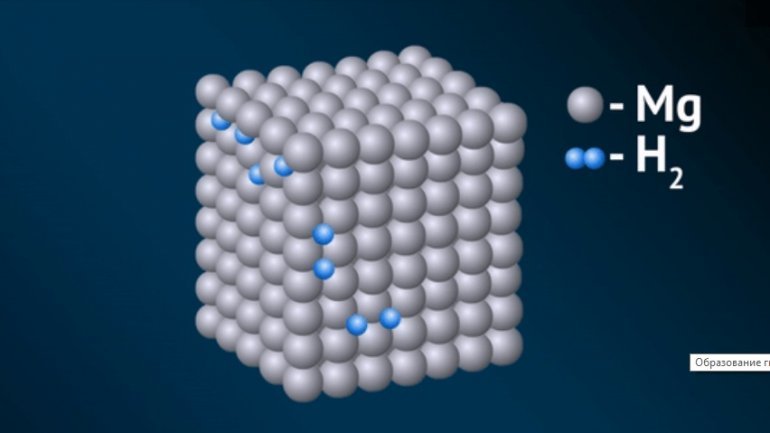
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Гидросульфид натрия, NaHS, образует не только дигидрат, NaHS плюс 2H2O, но и тригидрат, с присоединением 3H2O.
Когда связь ковалентна
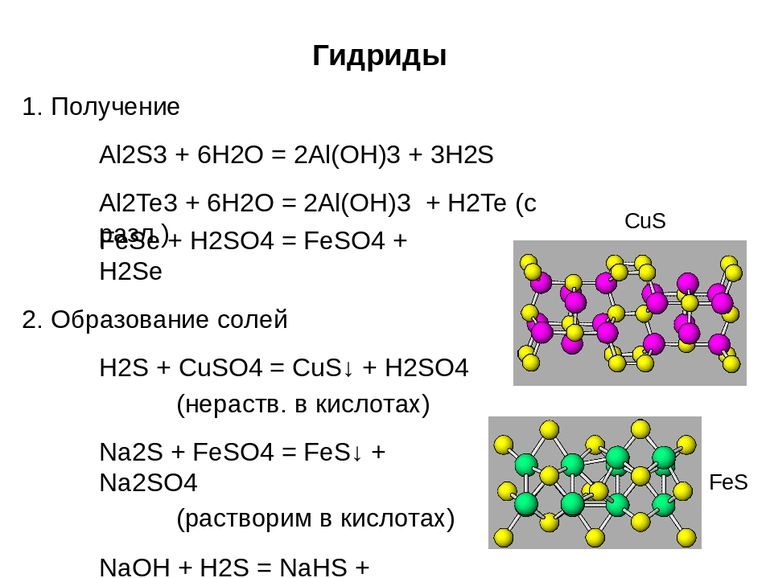
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Это могут быть вещества простые, бинарные, такие как метан (CH4), силан (формула SiH4). Сложные тоже имеются, с длинными цепями, многоатомные молекулы — они образуются водородом с кремнием, бором, германием.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:
- Все сильные восстановители, степень окисления водорода +1.
- Проявляют кислотные, а также амфотерные свойства.
- Агрегатное состояние — газ или летучая жидкость, исключения тут гидрид кислорода (вода), азота, фтороводород (плавиковая кислота), те, в которых молекулы полярны и возникает водородная связь. Последние существуют, как нелетучая жидкость или в твёрдом состоянии.
- Электронодефицитные виды, получаемые с элементами главной подгруппы 3 группы, например, гидрид алюминия AlH3 или бериллия, химическая формула BeH2, очень активны и образуют многоатомные, длинные полимерные цепи, с больши́м весом. Такие полимеры — твёрдые вещества.
- При нагреве легко и практически необратимо, разлагаются на элемент и водород H2. Требуется температура от 100 до 300 градусов по Цельсию (для гидрида серы H2S — порядка 400 градусов).
- Чаще всего они имеют высокую токсичность.
- Характерна высокая химическая активность, реакционная способность.
- Получить можно непосредственным взаимодействием элементов, разложением металлических соединений водой, кислотой, восстановлением галогенидов гидридами бора, алюминия, щелочных металлов.
- Высшие гидриды германия, кремния, с общей химической формулой EnH2n+2 — это полимеры, их стабильность тем ниже, чем больше атомный вес и количество атомов элемента.
- Принадлежащие к s-подгруппе хорошо растворяются в воде и проявляют кислотные свойства. Прочие — в незначительной мере, свойства у них основные. Все хорошо растворимы в неполярных органических растворителях.
- При взаимодействии с водой (H2O), выделяется чистый водород (H2) и оксид, с общей химической формулой EO2.
Тяжёлые элементы дают соединения с небольшой устойчивостью.
За счёт водородных связей и способности к донорно-акцепторному взаимодействию, вода (H2O), плавиковая кислота (HF), аммиака (NH3), а частично HCl и H2S, хорошие растворители.
Интерметаллические соединения
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.
У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
Источник
Гидриды лантана, неодима, иттрия и скандия (М.Е. Кост, В.И. Михеева)
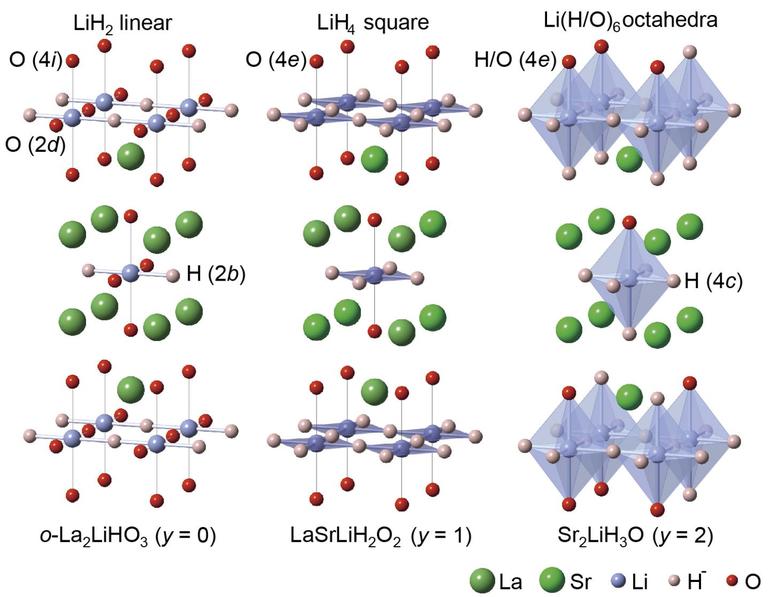
Первые сообщения о синтезе водородных соединений лантана и неодима относятся к концу прошлого века 1. По данным различных авторов, максимальное содержание водорода в них соответствует LaH3 [4] и NdH3 [5]. Для этих гидридов изучены кристаллическая структура [6], теплота образования, упругость диссоциации [7]. Соответственно этим исследованиям было высказано предположение, что дигидриды лантана и неодима представляют собой химические соединения постоянного состава. Дальнейшее же поглощение водорода приводит к образованию твердого раствора водорода в дигидриде [7].
Первое сообщение о гидриде скандия появилось лишь в 1960 г. [8]. В нем имеются данные о составе (ScH2) и кристаллической структуре этого соединения.
Гидрид иттрия описан [9, 10], однако индивидуального соединения получено не было. Предполагаемый состав гидридов: Y2H3 [9] и YH2,7 [10].
Гидриды рзэ в настоящем исследовании были получены непосредственным взаимодействием металла (образец 98-99%-ной чистоты содержал в качестве основных примесей другие рзэ) с водородом.
Последний получали термическим разложением гидрида титана. Металлы после предварительной тщательной очистки их поверхности гидрировали в вакуумной установке [11]. За ходом реакции следили по изменению давления водорода в системе.
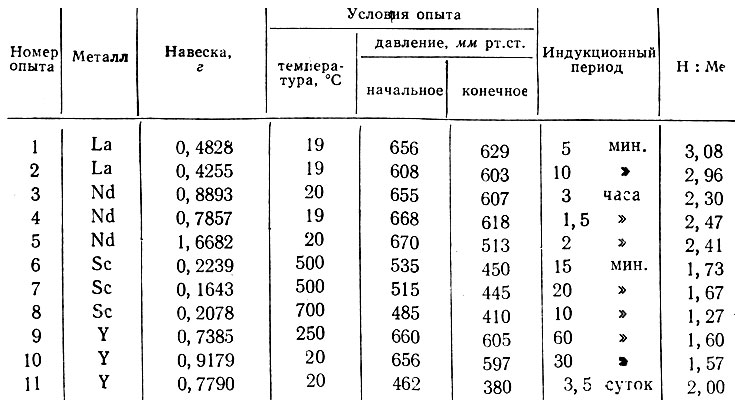
Результаты гидрирования металлов
* ( Предварительная термическая обработка в вакууме при 400° С продолжалась 30 мин. )
В случае лантана и неодима реакция начинается при комнатной температуре. В отличие от предыдущей работы [12], в которой применяли электролитический водород, использование чистейшего водорода дало возможность получить гидрид иттрия с максимальным содержанием водорода также при комнатной температуре. Однако эта реакция имеет очень большой индукционный период (см. таблицу, опыт 11). Скандий гидрируется лишь при нагревании.
В результате реакции получаются серо-черные хрупкие гидриды, легко растирающиеся в порошок. Содержание водорода в них определяли волюмометрическим методом путем измерения количества водорода, выделяющегося при растворении в разбавленной НСl [11].
Максимальное достигнутое нами насыщение исследуемых металлов водородом соответствует формулам LaH3, NdH2,4, ScHi1,7, YH2.
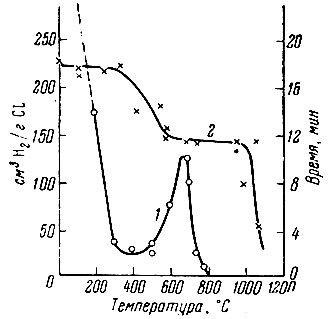
Рис. 1. Зависимость времени гидрирования (1) и состава гидрида лантана (2) от температуры
Для лантана было проведено исследование реакции гидрирования при различных температурах. Аналогично церию [11], кривая зависимости времени гидрирования (рис. 1) имеет две опускающиеся и одну подымающуюся ветвь, что может служить указанием на различный характер соединений, получающихся в соответствующих интервалах температур. Последующее изучение термической устойчивости полученных гидридов лантана показало, что, действительно, в области 0-300° С существует LaH3, в интервале 600-1000° С — LaH2, а при 300-600° С образуется твердый раствор водорода в дигидриде лантана.
По химическим свойствам гидриды рзэ существенно отличаются друг от друга. В то время как гидрид церия самовоспламеняется на воздухе, гидрид скандия практически не взаимодействует с водой и даже разбавленными кислотами. На примере Се, La и Nd было показано, что химическая активность, в частности скорость гидролиза, резко падает с уменьшением содержания кислорода.
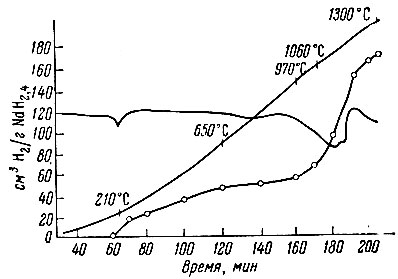
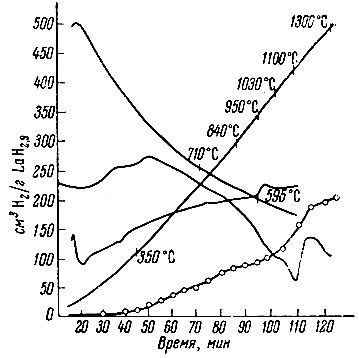
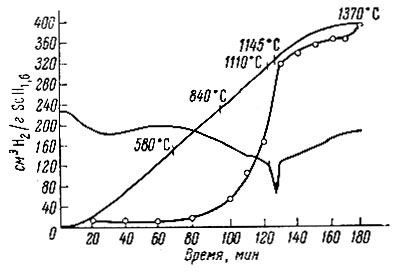
При изучении термической устойчивости выяснилось, что гидриды лантана и неодима, аналогично гидриду церия, разлагаются в две стадии (рис. 2, 3). В интервале 200-600° С выделяется водород, избыточный над дигидридом, и лишь около 1000° С происходит разложение дигидрида на составляющие элементы. Аналогично ведет себя гидрид скандия (рис. 4). Ввиду небольшого содержания водорода для него характерна только вторая стадия разложения на элементы.
Несколько иначе выглядит термограмма разложения гидрида иттрия YН2 (рис. 5): около 400° С наблюдается отчетливый эндотермический эффект, соответствующий выделению половины водорода; далее выделение газа прекращается; лишь при 1000-1300° С начинается разложение оставшегося моногидрида.
Из приведенных данных видно, что отдельные рзэ существенно отличаются по своей абсорбционной способности и условиям [реакции гидрирования. Последнее вместе с различной термической стойкостью полученных гидридов открывает возможности применения их при достижении высокого вакуума, изготовлении пенометаллов и т. д. Кроме того, высокая реакционная способность этих гидридов может быть использована в различных областях неорганического синтеза.
Рис. 2. Термограмма разложения NdH2,4
Рис 3. Термограмма разложения LaH2,9
Рис. 4. Термограмма разложения ScH1,6
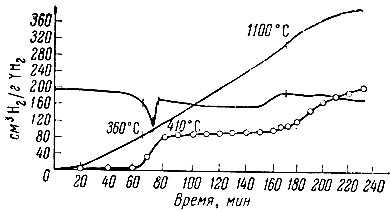
Рис. 5. Термограмма разложения YH2
В заключение авторы выражают искреннюю признательность Н. П. Сажину, Р. М. Либерман и А. Н. Остроуховой за содействие в работе.
Источник