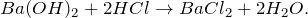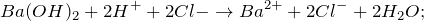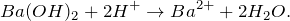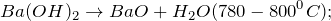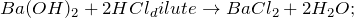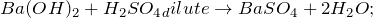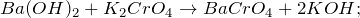- Ba(OH)2 + HCl = ? уравнение реакции
- Гидроксид бария: способы получения и химические свойства
- Способы получения
- Качественная реакция
- Химические свойства
- Хлорид бария: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Гидроксид бария хлороводород хлорид бария вода
- Гидроксид бария хлороводород хлорид бария вода
Ba(OH)2 + HCl = ? уравнение реакции
Срочно нужна помощь! Какие продукты образуются в результате взаимодействия гидроксида бария и соляной кислоты (Ba(OH)2 + HCl = ?)? Запишите молекулярное и ионное уравнения реакции. Охарактеризуйте соединение гидроксид бария: укажите основные физические и химические свойства, способы получения.
В результате взаимодействия гидроксида бария и соляной кислоты (Ba(OH)2 + HCl = ?) происходит образование средней соли – хлорида бария и воды (обмен). Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что вода и гидроксид бария и вода на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Гидроксид бария (едкий барит) представляет собой кристаллы белого цвета, которые плавятся без разложения, но при дальнейшем нагревании разлагаются. Хорошо растворяется в воде, образует сильнощелочной раствор. Проявляет основные свойства, реагирует с кислотами. Вступает в реакции обмена.
Помимо вышеуказанной реакции гидроксид бария получают путем растворения оксида бария в воде (1) или при горячей воды на сульфид бария (2):
Источник
Гидроксид бария: способы получения и химические свойства
Гидроксид бария Ba(OH)2 — неорганическое соединение. Белый, плавится без разложения. При дальнейшем нагревании разлагается. Хорошо растворяется в воде. Проявляет основные свойства.
Относительная молекулярная масса Mr = 171,34; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 408º C.
Способы получения
1. Гидроксид бария получают в результате взаимодействия твердого сульфида бария и паров воды при 450º С, на выходе образуется гидроксид бария и сероводородная кислота:
2 . При взаимодействии бария с водой при комнатной температуре образуется гидроксид бария и водород:
3. Оксид бария при взаимодействии с водой образует гидроксид бария:
Качественная реакция
Качественная реакция на гидроксид бария — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид бария взаимодействует со сложными веществами :
1.1. Гидроксид бария реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом бария и разбавленной соляной кислотой образуется хлорид бария и вода:
1.1.2. Гидроксид бария взаимодействует с разбавленной серной кислотой, образуя сульфат бария и воду:
1.1.3. В результате взаимодействия гидроксида бария и разбавленной фосфорной кислоты образуется фосфат бария и вода:
если с гидроксидом бария будет взаимодействовать концентрированная фосфорная кислота, то в результате реакции возможно образование гидрофосфата бария и воды:
1.1.4. С насыщенным и холодным гидроксидом бария реагирует разбавленная сероводородная кислота , образуя сульфид бария и воду:
если сероводородная кислота будет насыщенной на выходе образуются гидросульфид бария и вода:
1.1.5. Гидроксид бария вступает во взаимодействие с концентрированной плавиковой кислотой с образованием фторида бария и воды:
1.2. Гидроксид бария взаимодействует с оксидами:
1.2.1. В результате взаимодействия гидроксида бария и углекислого газа образуется карбонат бария и вода:
если с углекислым газом реагирует карбонат бария в виде суспензии, то образуется гидрокарбонат бария в растворе:
1.2.2. Гидроксид бария вступает в реакцию с оксидом серы (IV) , образуя на выходе сульфит бария и воду:
если с оксидом серы (IV) взаимодействует гидроксид бария в виде суспензии, то на выходе происходит образование гидросульфита бария в растворе:
1.3. Гидроксид бария вступает в взаимодействие с солями :
1.3.1. Гидроксид бария вступает в реакцию с хроматом калия и образует хромат бария и гидроксид калия:
1.3.2. Насыщенный гидроксид бария взаимодействует при кипении с концентрированным раствором хлората аммония. При этом образуются хлорат бария, газ аммиак и воды:
2. Гидроксид бария разлагается при температуре 780 — 800º С, образуя на выходе оксид бария и воду:
Источник
Хлорид бария: способы получения и химические свойства
Хлорид бария BaCl2 — соль щелочноземельного металла бария и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 208,23; относительная плотность для тв. и ж. состояния d = 3,856; tпл = 961º C;
Способ получения
1. Хлорид бария можно получить путем взаимодействия бария и хлора :
2. В результате взаимодействия карбоната бария и разбавленной соляной кислоты образуется хлорид бария, углекислый газ и вода:
3. Гидроксид бария вступает в реакцию с соляной кислотой с образованием хлорида бария и воды:
Качественная реакция
Качественная реакция на хлорид бария — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид бария образует нитрат бария и осадок хлорид серебра:
Химические свойства
1. Хлорид бария вступает в реакцию со многими сложными веществами :
1.1. Хлорид бария реагирует с кислотами:
1.1.1. Твердый хлорид бария реагирует с концентрированной серной кислотой при кипении , образуя сульфат бария и газ хлороводород :
1.2. Хлорид бария вступает в взаимодействие с солями:
1.2.1. В результате реакции между хлоридом бария и концентрированным раствором карбоната натрия образуется карбонат бария и хлорид натрия:
1.2.2. Хлорид бария может реагировать с сульфатом натрия при 800º С с образованием сульфата бария и хлорида натрия:
2. В результате электролиза раствора хлорида бария образуется водород и хлор:
Источник
Гидроксид бария хлороводород хлорид бария вода
Из данного перечня выберите ЛЮБОЕ СЛОЖНОЕ вещество, содержащее атомы кислорода (кроме воды). Запишите его химическую формулу и укажите, к какому классу неорганических соединений оно относится.
| Вещество | Класс соединений |
В окошке ответа укажите название вещества.
Имеется следующий перечень химических веществ: железо, хлороводород, хлорид железа(II), водород, гидроксид бария, серная кислота, сульфат бария, вода.
Напишите химические формулы каждого из указанных веществ.
Железо — _____. Хлороводород — ______. Хлорид железа(II) — ______________________.
Гидроксид бария — __________________. Серная кислота — ________________________.
Сульфат бария — ____________________. Вода — _________. Водород — ______________.
Железо — хлороводород —
хлорид железа(II) —
гидроксид бария —
серная кислота —
сульфат бария —
вода —
водород —
Источник
Гидроксид бария хлороводород хлорид бария вода
Вычислите массу 0,8 моль хлороводорода.
Имеется следующий перечень химических веществ: железо, хлороводород, хлорид железа(II), водород, гидроксид бария, серная кислота, сульфат бария, вода.
Напишите химические формулы каждого из указанных веществ.
Железо — _____. Хлороводород — ______. Хлорид железа(II) — ______________________.
Гидроксид бария — __________________. Серная кислота — ________________________.
Сульфат бария — ____________________. Вода — _________. Водород — ______________.
Железо — хлороводород —
хлорид железа(II) —
гидроксид бария —
серная кислота —
сульфат бария —
вода —
водород —
Источник