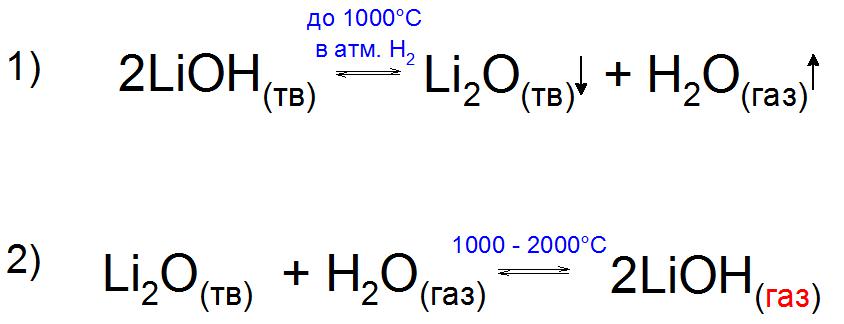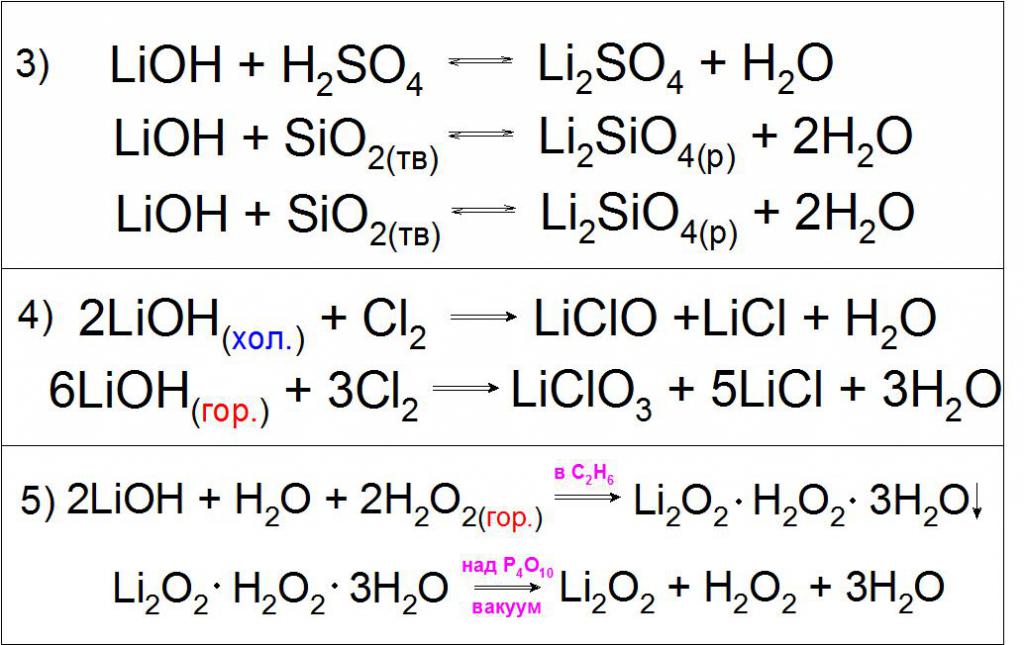- Гидроксид лития: способы получения и химические свойства
- Способы получения
- Качественная реакция
- Химические свойства
- Гидроксид лития. Примеры химических реакции, а также физические свойства щелочи и ее особенности
- Особенности строения атома лития
- Физические свойства
- Химические свойства
- Получение
- Применение
- Свойства лития. Реакции воды и некоторых кислот с литием
- Физические свойства лития
- Химические свойства
Гидроксид лития: способы получения и химические свойства
Гидроксид лития при стандартных условиях представляет собой бесцветные кристаллы. Растворяется в воде.
Относительная молекулярная масса Mr = 23, 95; относительная плотность для тв. и ж. состояния d = 1, 46; tпл = 471◦ C;
Способы получения
1. Гидроксид лития получают электролизом раствора хлорида лития :
2LiCl + 2H2O → 2LiOH + H2 + Cl2
2. При взаимодействии лития, оксида лития, гидрида лития и пероксида лития с водой также образуется гидроксид лития:
2Li + 2H2O → 2LiOH + H2
Li2O + H2O → 2LiOH
2LiH + 2H2O → 2LiOH + H2
3. Карбонат лития при взаимодействии с гидроксидом кальция образует гидроксид лития:
Качественная реакция
Качественная реакция на гидроксид лития — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид лития реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид лития реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид лития реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид лития также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид лития взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида лития:
Сера взаимодействует с гидроксидом лития только при нагревании:
6. Гидроксид лития взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2LiOH + 2Al + 6Н2О = 2Li[Al(OH)4] + 3Н2
7. Гидроксид лития вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом лития с образованием хлорида лития и осадка гидроксида меди (II):
2LiOH + CuCl2 = Cu(OH)2↓+ 2LiCl
Также с гидроксидом лития взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида лития образуются хлорид лития, аммиак и вода:
NH4Cl + LiOH = NH3 + H2O + LiCl
8. Гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Гидроксид лития проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
LiOH ↔ Li + + OH —
10. Гидроксид лития в расплаве подвергается электролизу . При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4LiOH → 4Li + O2 + 2H2O
Источник
Гидроксид лития. Примеры химических реакции, а также физические свойства щелочи и ее особенности
Что такое гидроксид лития? Это соединение является одним из важнейших термоустойчивых соединений, используемых в производстве для получения различных солей лития. Ионы этого элемента обладают рядом характерных особенностей, которые нашли свое широкое применение в химическом производстве.
Особенности строения атома лития
Литий (Li) является элементом I группы основной подгруппы 2-го периода, и относится к группе щелочных металлов. Его часто называют переходным к щелочноземельным элементам, поскольку он имеет немного меньшую активность, чем следующие представители этой группы, например, натрий (Na) или калий (K).
Атом лития обладает самым маленьким радиусом среди всех щелочных металлов, что обуславливает его химическую активность. Также особую роль играет предшествующая валентному электрону 2s 1 устойчивая электронная оболочка 1s 2 типа гелия, которая создает высокую поляризуемость частицы.
Это свойство лития характеризует возникновение электромагнитных или дипольных полей вокруг атома, что позволяет создавать прочные комплексные ионы вроде [Li(NH3)n] + . Стоит отметить, что при таких свойствах сам атом не подвержен поляризации, что объясняет термическую неустойчивость некоторых его солей, в особенности с комплексными анионами.
Все вышеперечисленные факты объясняют некоторые особенности в физических и химических свойствах гидроксида лития (LiOH).
Физические свойства
Чистый LiOH – очень едкое вещество, способное разрушить стекло и фарфор, поэтому его хранят в парафинированных сосудах. В расплавленном состоянии его можно получить только в никелевых или серебряных сосудах, так как он окисляет большинство металлов и сплавов. Золото является одним из немногих веществ, устойчивых к влиянию подобного соединения.
Само основание, по сравнению с окисью Li2O, химически неустойчиво и уже ближе к 1000 °C в атмосфере водорода H2 разлагается на составляющие (пример 1).
Оксид лития и гидроксид лития в химически чистом состоянии являются твердыми веществами, относительно растворимы в воде, но менее (почти в 5 раз), чем аналогичные соединения следующих представителей группы. Высшая точка растворения у описываемого основания приходится при 100 °C – 17,5 г/100 г растворителя, тогда как, например, у гидроксида натрия (NaOH) — 337 г/100 г и продолжает расти с повышением температуры. В то же время растворимость гидроксида лития практически в 100 раз больше растворимости гашеной извести (Ca(OH)2), у которой такая способность снижается с повышением температуры.
Интересно, что экспериментально удалось получить газообразный LiOH в присутствии паров воды. Его получают путем нагревания оксида Li до 2000 °C, когда после рубежа в 1000 °C давление пара этого соединения увеличивается за счет образования устойчивого родственного основания (пример 2).
Химические свойства
Гидроксид лития кислотой не считается, так как не является амфотерным элементом и не проявляет способности к распаду по типу MeOH ↔ MeO — + H + (где, Me — любой металл I или II группы основной подгруппы), как и другие представители щелочных металлов. Про такие соединения говорят, что они являются очень сильными основаниями, так как константа их диссоциации по принципу MeOH ↔ Me + + OH — очень высокая (Кb, LiOH = 6,75 · 10 -1 ).
Поскольку подобное соединение проявляет сильные основные свойства, оно может вступать в реакции нейтрализации с кислотами, кислотными оксидами и обмена с различными солями (пример 3).
Также характерной реакцией является взаимодействие холодных и горячих концентрированных растворов гидроксида лития с газообразным хлором с образованием гипохлоритов и хлоратов лития (пример 4).
Особенностью данного основания является взаимодействие с горячим раствором перекиси водорода H2O2 с образованием кристаллогидрата перекисного лития Li2O2 в среде этанола, разделяемый в вакууме (пример 5).
Получение
LiOH получают различными способами, одним из которых является непосредственное взаимодействие металла или его оксида с водой по схеме литий → оксид лития → гидроксид лития.
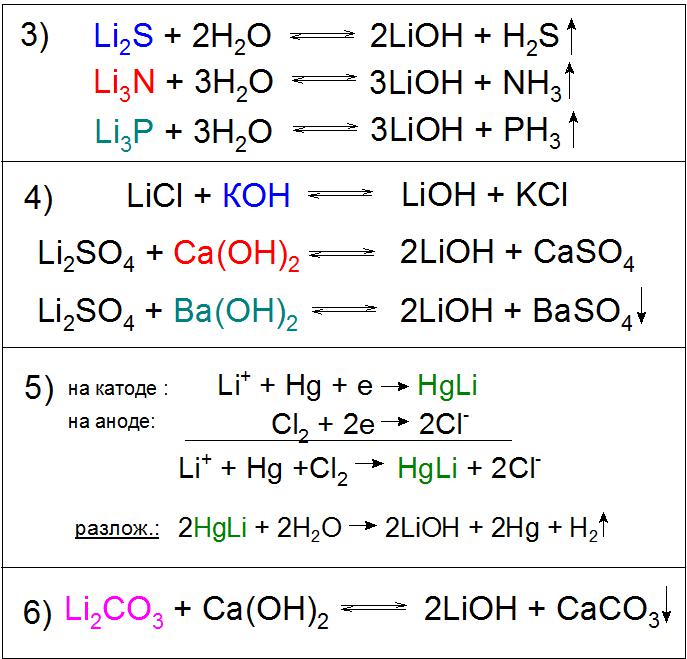
Также применяется гидролиз сульфида, нитрида, фосфидов и других соединений (пример 3).
Реакции обмена растворов солей лития возможны практически с любыми основаниями, например гидроксидом калия (KOH), кальция (Ca(OH)2) и бария (Ba(OH)2), причем с последним реагентом химическое взаимодействие идет практически до конца с сульфатом Li. В первом и втором случае реакция будет оправдана за счет плохой растворимости получаемых солей в растворе LiOH (пример 4), а в третьем — к этому прибавится нерастворимое в воде BaSO4 (пример 4). Стоит отметить, что последний вариант не используется на производстве по экономическим соображениям.
Еще одним примечательным методом получения данного соединения является электролиз раствора хлорида лития LiCl на ртутном катоде. При этом образуется амальгама HgLi, интересная тем, что температура ее плавления гораздо выше (609 °C), чем любого ее компонента. В процессе разложения водой полученного соединения образуется необходимое основание (пример 5).
Особенное промышленное значение имеет реакция разложения карбоната лития гашеной известью, в ходе которого химическое равновесие искусственно сдвигается в правую сторону для более высокого выхода основного продукта (пример 6).
Применение
Гидроксид лития используется при получении стеаратов этого металла для производства водоупорных морозо- и термостойких смазочных материалов. Также применяется в качестве катализатора при изготовлении полимерных материалов и как компонент электролита в различных аккумуляторах.
В пожарной и военной практике гидроксид лития используется как поглотитель углекислого газа (CO2) в противогазах.
Источник
Свойства лития. Реакции воды и некоторых кислот с литием
C какими веществами реагирует литий
Литий — металл первой группы второго периода в таблице Менделеева — был открыт в 1817 году. Сделал это открытие шведский ученый Иоганн Аугуст Арфведсон, когда он исследовал разные минералы. Элемент этот находился в петалите, сподумене и лепидолите. Немного позднее, в 1818 году, Гемфри Деви получил металлический литий.
Литий и его соединения являются незаменимыми химическими элементами в жизни человека. Литий используется во многих промышленных сферах:
- в производстве химических источников тока;
- в пиротехнике: нитрат лития придает огню красный цвет;
литий часто используется как металл для сплавов — с ним получаются легкие, но в тоже время прочные припои;
также литий используют в радиоэлектронике и ядерной энергетике;
в медицине широко применяют соли лития.
Вообще, в небольших количествах литий необходим для здоровья человека и поддерживает функционирование жизненно важных органов, таких как сердце, печень и легкие.
И это далеко не все сферы, где применяется этот металл и его соединения.
Физические свойства лития
Литий представляет собой щелочной металл серебристо-белого цвета. Он пластичен и легко поддается обработке: кубик металлического лития можно разрезать ножом.
Примечательно, что литий является единственным металлом из этой группы, который кипит и плавится при довольно высоких температурах: 1340 и 180,54 °С соответственно. Но также примечательно, что, по сравнению с «щелочными соседями», у лития самая низкая плотность (она в два раза меньше плотности воды). Из-за этого свойства литий не тонет даже в керосине.
Химические свойства
Литий относится к щелочной группе металлов, однако он устойчиво ведет себя на воздухе и практически не взаимодействует с кислородом, даже с сухим . Из-за необычных свойств лития — в отличие от других щелочных металлов — его не хранят в керосиновой жидкости. Кроме того, из-за малой плотности он держался бы на плаву. Хранить литий стоит в парафине, петролейном эфире, газолине или минеральном масле в герметичной жестяной упаковке.
Во влажном воздухе литий может вступать в медленные реакции с азотом и другими газами, которые входят в состав воздуха. При этом образуется: Li₃N, LiOH и Li₂CO₃ — нитрид, гидроксид и карбонат соответственно.
Другие химические свойства лития
При нагревании с кислородом литий сгорает с образованием оксида лития Li₂O.
Литий и его соли окрашивают пламя в карминно-красный цвет.
Такая качественная реакция на литий была установлена Леопольдом Гмелином в 1818 году.
При температурах от 100 до 300 °С на поверхности лития образуется плотная оксидная пленка, которая защищает металл от дальнейшего окисления. Литий легко реагирует с галогенами (кроме йода).
С водой литий реагирует спокойно: реакция не сопровождается возгоранием или взрывом.
Литий взаимодействует со спиртами, образуя алкоголяты.
При нагревании реагирует с серой, кремнием, йодом, водородом с образованием сульфида, силицида, йодида и гидрида лития.
Реакция лития с водой
Реакция проходит довольно спокойно. Если литий — как и все щелочные металлы — опустить в воду, начнет образовываться щелочь и выделяться водород, а металл будет плавать на поверхности и буквально таять на глазах. Реакция растворения лития в воде сопровождается характерным шипением.
Щелочь, образующаяся в растворе, — гидроксид лития LiOH. Он представляет собой кристаллы белого цвета и является довольно сильным основанием:
2Li + 2H₂O → 2LiOH + H₂↑
Реакция лития и серной кислоты
Если добавить небольшую пластинку лития в концентрированную серную кислоту, получится сульфат лития, сероводород и вода.
Внимание! Не пытайтесь повторить этот опыт самостоятельно! Здесь вы найдете безопасные эксперименты, которые можно проводить дома.
Сама по себе реакция опасна, особенно в домашних условиях, поскольку литий моментально загорается ярким пламенем:
8Li + 5H₂SO₄ → 4Li₂SO₄ + Н₂S + 4H₂O
С разбавленной серной кислотой литий взаимодействует с образованием сульфата лития и водорода.
2Li + H₂SO₄ → Li₂SO₄ + Н₂
Реакция лития с азотной кислотой
Если опустить кусочек лития в разбавленную азотную кислоту, образуется нитрат лития, нитрат аммония и вода:
8Li + 10HNO₃ → 8LiNO₃ + NH₄NO₃ + 3H₂O
С концентрированной азотной кислотой литий реагирует иначе. Продуктами реакции будут нитрат лития, вода и диоксид азота:
Li + 2HNO₃ → LiNO₃ +NO₂ + H₂O
Реакция с соляной кислотой
С соляной кислотой литий реагирует как и другие металлы — образуется хлорид лития и выделяется водород:
2Li + 2HCl = 2LiCl + H₂
Стоить отметить, что реакция лития и других щелочных металлов с кислотами идет неоднозначно, поскольку в растворах кислот содержится вода, с которой литий активно взаимодействует с образованием гидроксида лития, который вступает в реакцию с кислотами с образованием соли и воды.
Источник