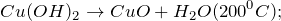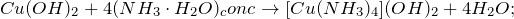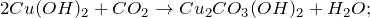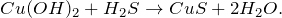- Гидроксид меди (II)
- Гидроксид меди (II)
- Способы получения гидроксида меди (II)
- Химические свойства
- Гидроксид меди (II), характеристика, свойства и получение, химические реакции
- Гидроксид меди (II), характеристика, свойства и получение, химические реакции.
- Краткая характеристика гидроксида меди (II):
- Физические свойства гидроксида меди (II):
- Получение гидроксида меди (II):
- Химические свойства гидроксида меди (II). Химические реакции гидроксида меди (II):
- Применение и использование гидроксида меди (II):
- Cu(OH)2 + H2O = ? уравнение реакции
- Оксид меди (II)
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Гидроксид меди плюс вода реакция
Гидроксид меди (II)
Гидроксид меди (II)
Гидроксид меди (II) Сu(OН)2 — голубое аморфное или кристаллическое вещество. Практически нерастворим в воде.
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ).
1. Взаимодействует с кислотами .
Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение:
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается :
Источник
Гидроксид меди (II), характеристика, свойства и получение, химические реакции
Гидроксид меди (II), характеристика, свойства и получение, химические реакции.
Гидроксид меди (II) – неорганическое вещество, имеет химическую формулу Cu(OH)2.
Краткая характеристика гидроксида меди (II):
Гидроксид меди (II) – неорганическое кристаллическое или аморфное вещество ярко-голубого цвета.
Химическая формула гидроксида меди (II) Cu(OH)2.
Не растворяется в воде. Растворимость в воде 0,000673 г/100 мл.
Не горит. Термически неустойчивый. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водных суспензий разлагается на оксид меди (II) и воду.
Гидроксид меди токсичен.
Физические свойства гидроксида меди (II):
| Наименование параметра: | Значение: |
| Химическая формула | Cu(OH)2 |
| Синонимы и названия иностранном языке | сopper(II) hydroxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | ярко-голубые кристаллы либо ярко-голубая водная суспензия (аморфное состояние) |
| Цвет | ярко-голубой |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), кг/м 3 | 3370 |
| Плотность (состояние вещества – твердое вещество – кристаллы, при 20 °C), г/см 3 | 3,37 |
| Температура разложения, °C | 70 |
| Гигроскопичность | отсутствует |
| Молярная масса, г/моль | 97,561 |
Получение гидроксида меди (II):
В лаборатории гидроксид меди (II) получается действием на холоде растворимых гидроксидов металлов на растворимые соли меди в результате следующих химических реакций:
- 1. в результате взаимодействия нитрата меди (II) с гидроксидом натрия :
При этом гидроксид меди (II) выпадает в осадок.
При этом гидроксид меди (II) выпадает в осадок.
- 3. в результате взаимодействия нитрата меди (II) с гидроксидом калия:
При этом гидроксид меди (II) выпадает в осадок.
- 4. в результате взаимодействия сульфата меди (II) с гидроксидом кальция:
При этом гидроксид меди (II) выпадает в осадок.
- 5. в результате взаимодействия хлорида меди (II) с гидроксидом натрия:
При этом гидроксид меди (II) выпадает в осадок.
Химические свойства гидроксида меди (II). Химические реакции гидроксида меди (II):
Гидроксид меди (II) – слабое основание. Проявляет амфотерные свойства.
Химические свойства гидроксида меди (II) аналогичны свойствам гидроксидов других амфотерных металлов . Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида меди (II) с ортофосфорной кислотой:
В результате реакции образуются фосфат меди (II) и вода . В качестве исходного вещества используется разбавленный раствор ортофосфорной кислоты.
2. реакция гидроксида меди (II) с азотной кислотой:
В результате реакции образуются нитрат меди (II) и вода . В качестве исходного вещества используется разбавленный раствор азотной кислоты.
Аналогично проходят реакции гидроксида меди (II) и с другими кислотами.
3. реакция гидроксида меди (II) и сероводорода:
В результате реакции образуются сульфид меди (II) и вода . В ходе реакции используется суспензия гидроксида меди (II) и насыщенный раствор сероводорода.
4. реакция гидроксида меди (II) и оксида углерода:
В результате реакции образуются карбонат-дигидроксид димеди (II) и вода .
5. реакция гидроксида меди (II) и оксида селена:
В результате реакции образуются селенит меди (II) и вода . Реакция протекает при нагревании.
6. реакция гидроксида меди (II) и гидроксида натрия:
В результате реакции образуется тетрагидроксокупрат натрия.
7. реакция гидроксида меди (II), аммиака и воды:
В результате реакции образуется гидроксид диакватетрааммин меди (I).
8. реакция гидроксида меди (II) и гидрата аммиака:
В результате реакции образуются гидроксид тетрааммин меди (II) и вода. Гидрат аммиака используется в ходе реакции в виде концентрированного раствора.
Гидроксид тетрааммин меди (II) имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu 2+ в растворе.
9. реакция гидроксида меди (II) с кислородом:
При длительном нахождении на воздухе, обогащённом кислородом, гидроксид меди (II) вступает в обратимую реакцию с кислородом , образуя грязно-красный оксид меди (III). В результате реакции образуется оксид меди (III) и вода.
При избытке влаги может образоваться гидроксид куприла (III) и вода.
10. реакция термического разложения гидроксида меди (II):
В результате реакции образуются оксид меди (II) и вода .
Применение и использование гидроксида меди (II):
Гидроксид меди (II) используется:
– как пигмент при производстве стекол, керамики, красок,
– как катализатор в химической промышленности.
Примечание: © Фото https://www.pexels.com, https://pixabay.com

гидроксид меди (II) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида меди (II) реакции
Источник
Cu(OH)2 + H2O = ? уравнение реакции
Закончите уравнение реакции Cu(OH)2 + H2O = ? Возможно ли взаимодействие между этими веществами? Дайте краткую характеристику физических и химических свойства гидроксида меди (II), приведите способы его получения.
Гидроксид меди (II) представляет собой кристаллы ярко-голубого цвета или же светло-голубой аморфный осадок, если он только что был осажден из водного раствора. Термически неустойчивый. Не растворяется в воде, т.е. записать уравнение реакции по схеме [Cu(OH)2 + H2O = ?] невозможно. Переводится в раствор действием гидрата аммиака. Проявляет амфотерные свойства (с преобладанием основных свойств); реагирует с разбавленными кислотами, концентрированными щелочами. В ОВР может проявляет свойства как слабого окислителя, так и восстановителя.
В лаборатории гидроксид меди (II) получают действием на холоде растворимых гидроксидов (кроме NH4OH) на растворимые соли меди:
Источник
Оксид меди (II)
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Источник
Гидроксид меди плюс вода реакция
Оксид меди (II) CuO – кристаллы черного цвета, кристаллизуются в моноклинной сингонии, плотность 6,51 г/см 3 , температура плавления 1447°С (под давлением кислорода). При нагревании до 1100°С разлагается с образованием оксида меди (I):
В воде не растворяется и не реагирует с ней. Имеет слабовыраженные амфотерные свойства с преобладанием основных.
В водных растворах аммиака образует гидроксид тетраамминмеди (II):
Легко реагирует с разбавленными кислотами с образованием соли и воды:
При сплавлении со щелочами образует купраты:
Восстанавливается водородом, угарным газом и активными металлами до металлической меди:
CuO + CO = Cu + CO2;
CuO + Mg = Cu + MgO.
Получается при прокаливании гидроксида меди (II) при 200°С:
Cu(OH)2 = CuO + H2O
или при окислении металлической меди на воздухе при 400–500°С:
Гидроксид меди (II) Cu(OH)2 – вещество голубого цвета, существует в аморфной и кристаллической формах, кристаллическая решетка ромбическая, плотность 3,37 г/см 3 , при нагревании выше 70°С разлагается на оксид меди (II) и воду:
В воде плохо растворим. Имеет слабовыраженные амфотерные свойства с преобладанием основных.
Легко реагирует с кислотами с образованием солей:
В водных растворах щелочей образует неустойчивые ярко-синие гидроксокомплексы:
В растворе аммиака – устойчивые аммиакаты темно-синего цвета:
Проявляя основные свойства, взаимодействует с углекислым газом образованием основного карбоната меди (II) – малахита:
Получается при обменном взаимодействии солей меди (II) и щелочи
кристаллический гидроксид меди (II) образуется при введении гидроксида натрия или калия в аммиачный раствор сульфата меди (II):
Источник