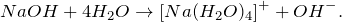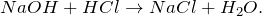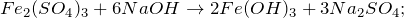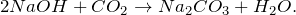- NaOH + H2O = ? уравнение реакции
- Гидроксид натрия, характеристика, свойства и получение, химические реакции
- Гидроксид натрия, характеристика, свойства и получение, химические реакции.
- Краткая характеристика гидроксида натрия:
- Модификации гидроксида натрия:
- Физические свойства гидроксида натрия:
- Получение гидроксида натрия:
- Химические свойства гидроксида натрия. Химические реакции гидроксида натрия:
- Применение и использование гидроксида натрия:
NaOH + H2O = ? уравнение реакции
Закончите уравнение реакции NaOH + H2O = ? Назовите полученное соединение? Охарактеризуйте гидроксид натрия: приведите его основные физические и химические свойства. Каким образом можно получить гидроксид натрия в лаборатории?
При растворении твердого гидроксида натрия в воде (NaOH + H2O = ?) не происходит образования каких-либо новых веществ, поскольку данный процесс не относится к химическому взаимодействию, а является физическим. В результате него возможно формирование ионов следующего состава:
Гидроксид натрия (едкий натр, каустическая сода) представляет собой белые твердые и очень гигроскопичные кристаллы, которые плавятся при температуре выше 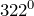
Гидроксид натрия следует хранить в хорошо закупоренных сосудах, так как он легко поглощает из воздуха диоксид углерода, постепенно превращаясь в карбонат натрия.
Раствор гидроксида натрия изменяет цвет индикаторов, так, например, при добавлении лакмуса, фенолфталеина или метилового оранжевого в раствор этой щелочи их окраска станет синей, малиновой и желтой соответственно.
Гидроксид натрия реагирует с кислотами с образованием солей и воды (реакция нейтрализации):
Гидроксид натрия реагирует с растворами солей (если в их состав входит металл, способный образовать нерастворимое основание) и кислотными оксидами:
К основным лабораторным способам получения гидроксида натрия относят электролиз водного раствора хлорида натрия:
Источник
Гидроксид натрия, характеристика, свойства и получение, химические реакции
Гидроксид натрия, характеристика, свойства и получение, химические реакции.
Гидроксид натрия – неорганическое вещество, имеет химическую формулу NaOH.
Краткая характеристика гидроксида натрия:
Гидроксид натрия – неорганическое вещество белого цвета.
Химическая формула гидроксида натрия NaOН.
Обладает высокой гигроскопичностью. На воздухе «расплывается», активно поглощая пары воды из воздуха.
Хорошо растворяется в воде, при этом выделяя большое количество тепловой энергии. Раствор едкого натра мылок на ощупь.
Гидроксид натрия – самая распространённая щёлочь. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
Гидроксид натрия – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Модификации гидроксида натрия:
До 299 о С гидроксид натрия имеет устойчивую ромбическую модификацию (a = 0,33994 нм, c = 1,1377 нм), выше 299 о С – моноклинную.
Физические свойства гидроксида натрия:
| Наименование параметра: | Значение: |
| Химическая формула | NaOН |
| Синонимы и названия иностранном языке | sodium hydroxide (англ.) |
натрия гидроокись (рус.)
сода каустическая (рус.)
Получение гидроксида натрия:
Гидроксид натрия получается в результате следующих химических реакций:
- 1. из оксида натрия (т.н. пиролитический метод):
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия при температуре 1000 °C либо нагревания до 200 °C гидрокарбоната натрия в целях получения карбоната натрия:
2NaHCO3 → Na2CO3 + CO2 + H2O (t = 200 o C), после чего проводят первую химическую реакцию.
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
- 2. путем взаимодействия раствора соды с гашеной известью (т.н. известковый метод, каустификация соды):
Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH.
- 3. ферритным методом:
Реакционную смесь спекают.
Реакция протекает медленно.
Fe2O3•nH2O выпадает в осадок, который после отделения его от раствора возвращается в процесс в первую реакцию.
- 4. электролизом:
Одновременно получаются также водород и хлор.
Гидроксид натрия, водород и хлор вырабатываются тремя электрохимическими методами. Два из них – электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий – электролиз с жидким ртутным катодом (ртутный метод).
Химические свойства гидроксида натрия. Химические реакции гидроксида натрия:
Гидроксид натрия – химически активное вещество, сильное химическое основание.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4).
Химические свойства гидроксида натрия аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида натрия с серой:
В результате реакции образуются сульфид натрия, сульфит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
2. реакция гидроксида натрия с хлором:
2NaOH + Cl2 → NaCl + NaClO + H2O.
В результате реакции образуются хлорид натрия, гипохлорит натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде холодного разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими галогенами.
3. реакция гидроксида натрия с алюминием:
2Al + 6NaOH → 2NaAlO2 + 3H2 + 2Na2O (t = 450 °C).
В результате реакции образуются алюминат натрия, водород и оксид натрия .
4. реакция гидроксида натрия с алюминием и водой:
В результате реакции образуются тетрагидроксоалюминат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых условиях, так как данная реакция не требует источников электроэнергии , а исходные реагенты для неё могут легко транспортироваться.
5. реакция гидроксида натрия с цинком:
В результате реакции образуются цинкат натрия и водород .
6. реакция гидроксида натрия с цинком и водой:
В результате реакции образуются тетрагидроксоцинкат натрия и водород. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
7. реакция гидроксида натрия с ортофосфорной кислотой:
В результате реакции образуются дигидроортофосфат натрия и вода . При этом в качестве исходных веществ используются: фосфорная кислота в виде концентрированного раствора, гидроксид натрия в виде разбавленного раствора.
8. реакция гидроксида натрия с азотной кислотой:
В результате реакции образуются нитрат натрия и вода . При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
9. реакция гидроксида натрия с азотной кислотой:
В результате реакции образуются нитрат натрия и вода . При этом азотная кислота в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими кислотами.
10. реакция гидроксида натрия с сероводородом:
В результате реакции образуются в первом случае – сульфид натрия и вода, во втором – гидросульфид натрия и вода . При этом гидроксид натрия в первом случае в качестве исходного вещества используется в виде концентрированного раствора, во втором случае – в виде разбавленного раствора.
11. реакция гидроксида натрия с фтороводородом:
HF + NaOH → NaF + H2O,
В результате реакции образуются в первом случае – фторид натрия и вода, во втором – гидрофторид натрия и вода. При этом гидроксид натрия и фтороводород в первом случае в качестве исходного вещества используются в виде разбавленного раствора, во втором случае фтороводород используется в виде в виде концентрированного раствора.
12. реакция гидроксида натрия с бромоводородом:
HBr + NaOH → NaBr + H2O.
В результате реакции образуются бромид натрия и вода. При этом гидроксид натрия и бромоводород в качестве исходного вещества используются в виде разбавленного раствора.
13. реакция гидроксида натрия с йодоводородом:
HI + NaOH → NaI + H2O.
В результате реакции образуются йодид натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
14. реакция гидроксида натрия с оксидом цинка:
Оксид цинка является амфотерным оксидом. В результате реакции образуются цинкат натрия и вода.
15. реакция гидроксида натрия с оксидом цинка и водой:
ZnO + NaOH + H2O → Na[Zn(OH)3] (t = 100 °C),
Оксид цинка является амфотерным оксидом. В результате реакции образуется в первом случае – тригидроксоцинкат натрия и вода, во втором случае – тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в первом случае в виде 40 % разбавленного раствора, во втором – в виде 60 % разбавленного раствора.
16. реакция гидроксида натрия с оксидом алюминия:
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат натрия и вода.
17. реакция гидроксида натрия с оксидом алюминия и водой:
Оксид алюминия является амфотерным оксидом. В результате реакции образуется в первом случае – гексагидроксоалюминат натрия, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного горячего раствора.
18. реакция гидроксида натрия с оксидом железа:
Оксид железа является амфотерным оксидом. В результате реакции образуются феррит натрия и вода. Реакция происходит при сплавлении исходных веществ.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными оксидами.
19. реакция гидроксида натрия с оксидом углерода ( углекислым газом ):
В результате реакции образуется гидрокарбонат натрия.
20. реакция гидроксида натрия с оксидом серы:
В результате реакции образуется гидросульфит натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
21. реакция гидроксида натрия с оксидом кремния:
В результате реакции образуется в первом случае – силикат натрия и вода, во втором случае – ортосиликат натрия и вода. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
22. реакция гидроксида натрия с гидроксидом алюминия:
Гидроксид алюминия является амфотерным основанием. В результате реакции образуются в первом случае – алюминат натрия и вода, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид натрия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
23. реакция гидроксида натрия с гидроксидом цинка:
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде концентрированного раствора.
24. реакция гидроксида натрия с гидроксидом железа:
Гидроксид железа является амфотерным основанием. В результате реакции образуется гексагидроксоферрат натрия.
Аналогично проходят реакции гидроксида натрия и с другими амфотерными гидроксидами.
25. реакция гидроксида натрия с сульфатом железа:
В результате реакции образуются гидроксид железа и сульфат натрия.
26. реакция гидроксида натрия с хлоридом меди:
В результате реакции образуются гидроксид меди и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
27. реакция гидроксида натрия с нитратом свинца:
В результате реакции образуются гидроксид свинца и нитрат натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
28. реакция гидроксида натрия с хлоридом алюминия:
В результате реакции образуются гидроксид алюминия и хлорид натрия. При этом гидроксид натрия в качестве исходного вещества используется в виде разбавленного раствора.
Аналогично проходят реакции гидроксида натрия и с другими солями.
Применение и использование гидроксида натрия:
Гидроксид натрия используется во множестве отраслей промышленности и для бытовых нужд:
– в целлюлозно-бумажной промышленности для делигнификации(сульфатный процесс) целлюлозы, в производстве бумаги , картона, искусственных волокон , древесно-волоконных плит;
– для омыления жиров при производстве мыла, шампуня и других моющих средств;
– в химических отраслях промышленности – для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке – для производства масел;
– для изготовления биодизельного топлива – получаемого из растительных масел и используемого для замены обычного дизельного топлива .
Для получения биодизеля к девяти массовым единицам растительного масла добавляется одна массовая единица спирта (то есть соблюдается соотношение 9:1), а также щелочной катализатор (NaOH). Полученный эфир (главным образом линолевой кислоты) отличается хорошей воспламеняемостью, обеспечиваемой высоким цетановым числом. Цетановое число – условная количественная характеристика самовоспламеняемости дизельныхтоплив в цилиндре двигателя (аналог октанового числа для бензинов). Если для минерального дизтоплива характерен показатель в 50-52 %, то метиловый эфир уже изначально соответствует 56-58 % цетана. Сырьём для производства биодизеля могут быть различные растительные масла: рапсовое, соевое и другие, кроме тех, в составе которых высокое содержание пальмитиновой кислоты (пальмовое масло). При его производстве в процессе этерификации также образуется глицерин который используется в пищевой, косметической и бумажной промышленности;
– в качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей. Гидроксид натрия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе;
– в текстильной промышленности – для мерсеризации хлопка и шерсти. При кратковременной обработке едким натром с последующей промывкой волокно приобретает прочность и шелковистый блеск;
– в приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий. Зарегистрирован в качестве пищевой добавки E-524;
– в фотографии – как ускоряющее вещество в проявителях для высокоскоростной обработки фотографических материалов .
Источник