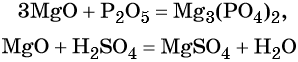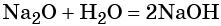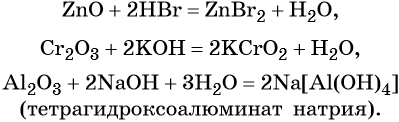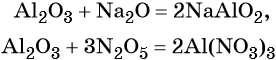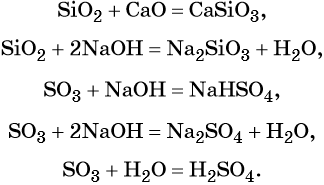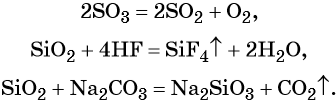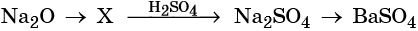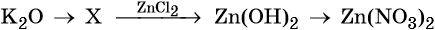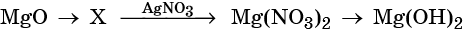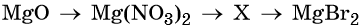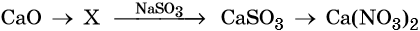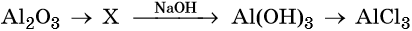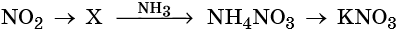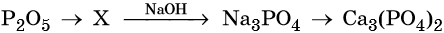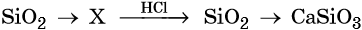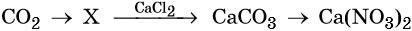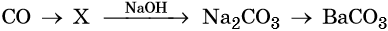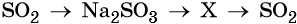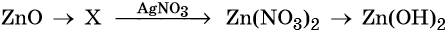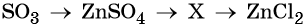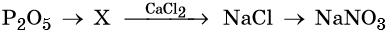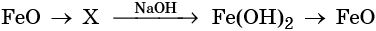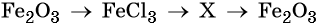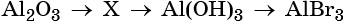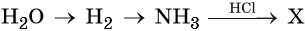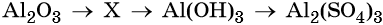Гидроксид натрия взаимодействует с оксидом кальция водой
Оксид кальция реагирует с
1)
2)
3)
4)
Основный оксид кальция может реагировать с кислотными оксидами, например, с .
Правильный ответ указан под номером 2.
N2O ведь тоже кислотный оксид, он может реагировать с основным оксидом CaO
И какая в таком случае кислота соответствует оксиду со степенью окисления азота +1?
Из предложенного перечня выберите две пары веществ, с каждым из которых реагирует оксид кальция:
1) и
2) и
3) и
4) и
5) и
Основный оксид кальция реагирует с кислотами и кислотными оксидами, а также с водой.
Источник
Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Источник
Химические свойства оксидов: основных, амфотерных, кислотных
Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
22. Установите соответствие между реагирующими веществами и продуктами реакций.
23. Установите соответствие между реагирующими веществами и продуктами реакций.
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯ H2O →
В) ZnO + Na2O ⎯⎯ сплавление →
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
27. Установите соответствие между реагирующими веществами и продуктами реакций.
28. Установите соответствие между реагирующими веществами и продуктами реакций.
29. Установите соответствие между реагирующими веществами и продуктами реакций.
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
31. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Источник