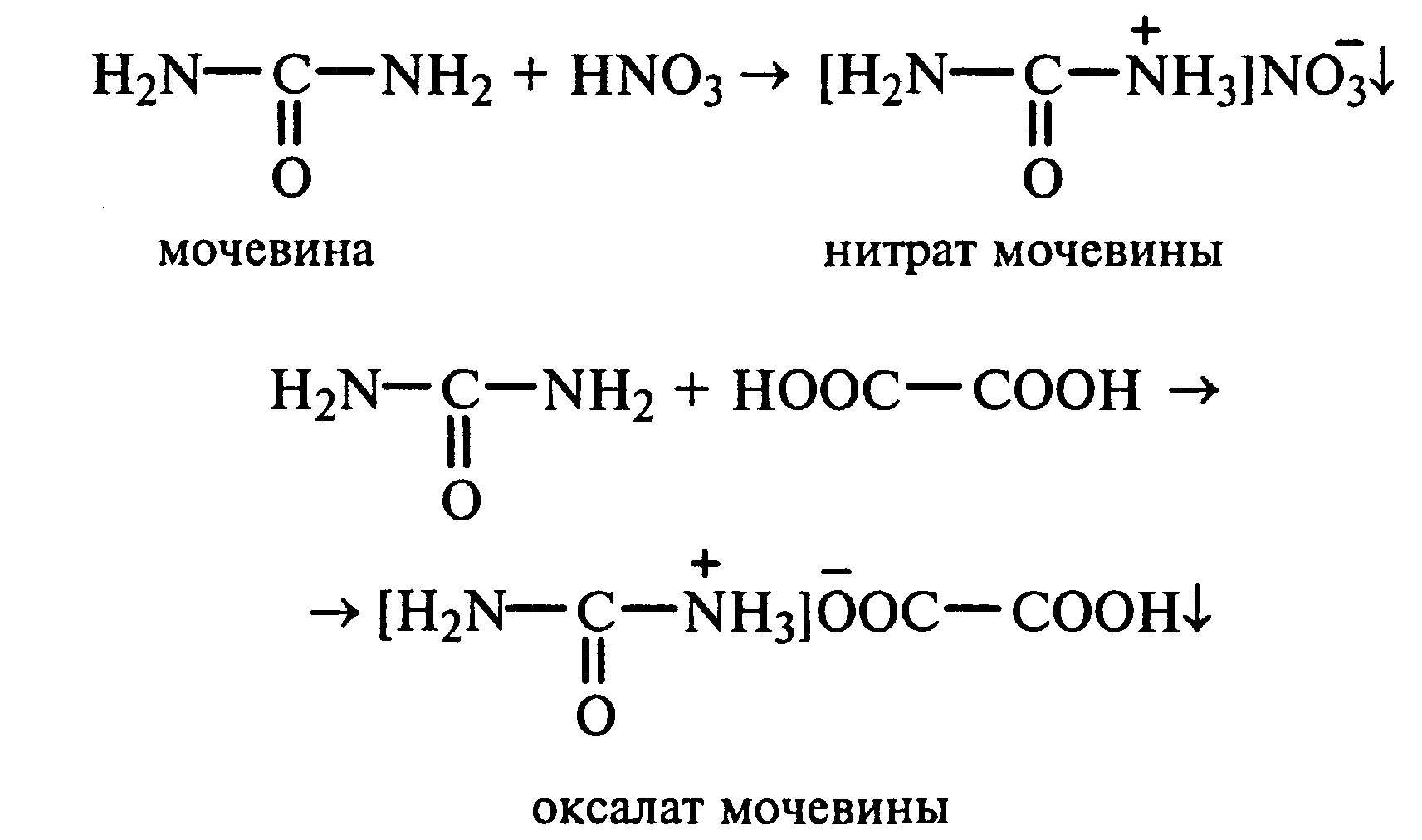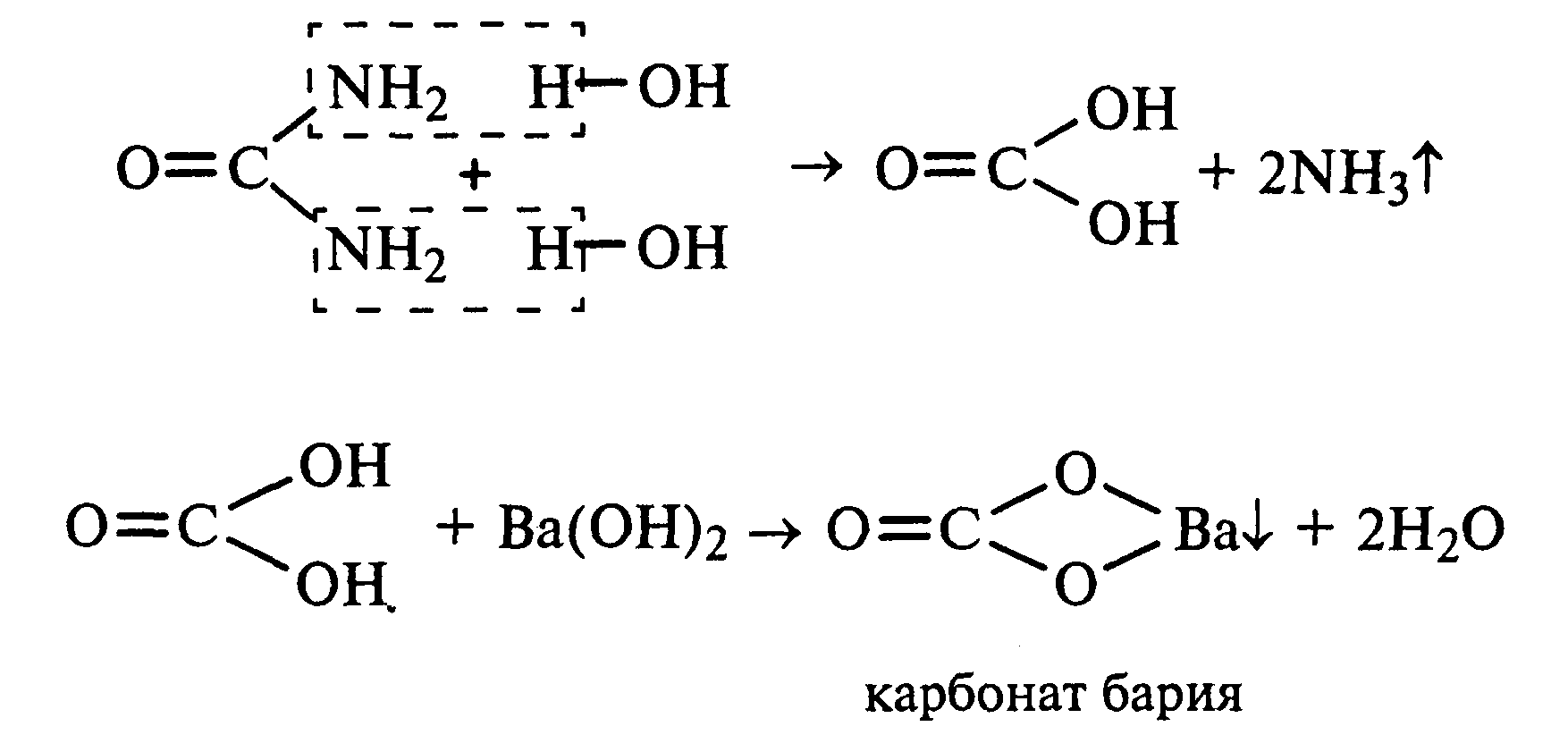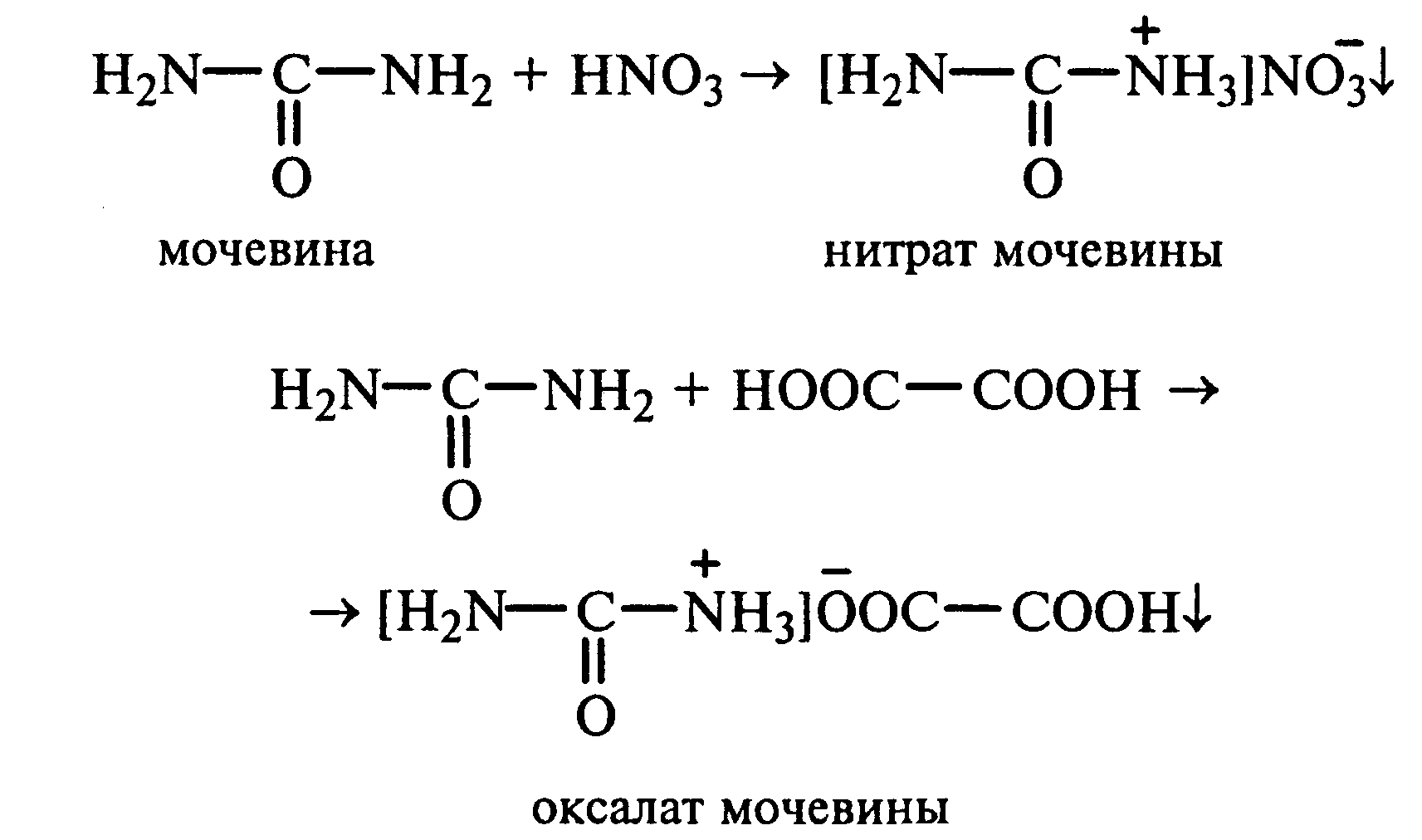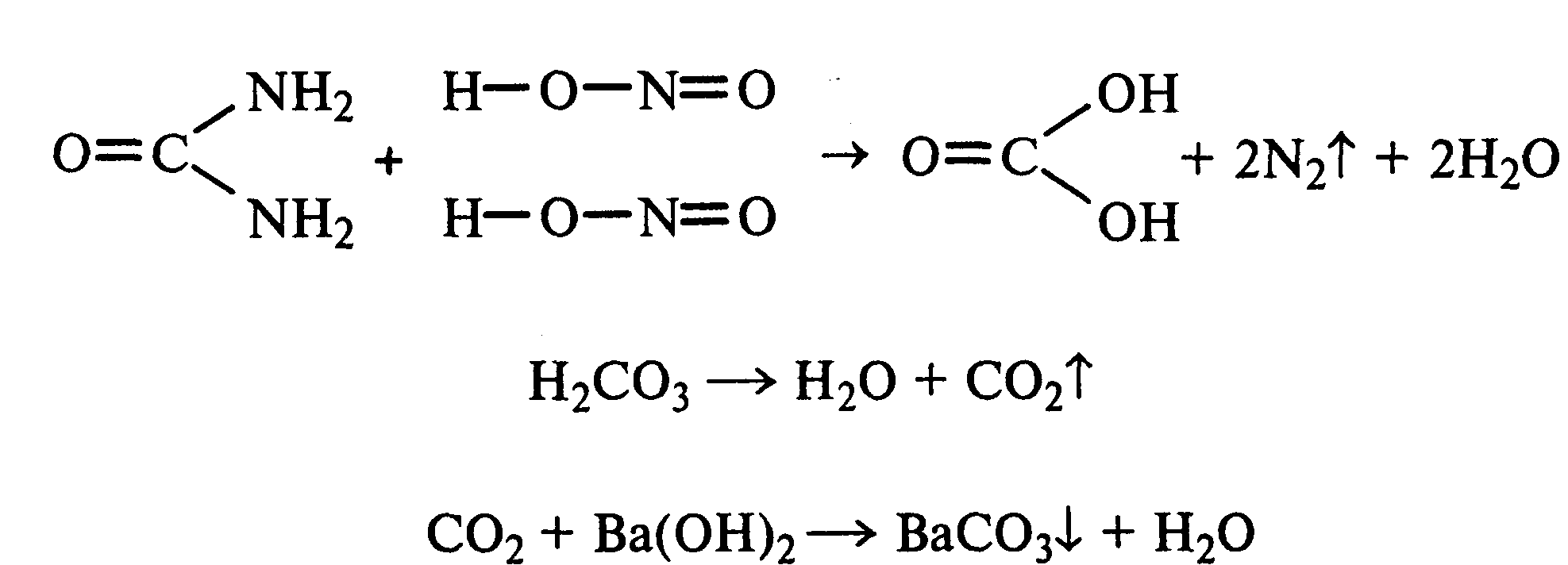Опыт 22. Свойства мочевины
Реактивы и оборудование:мочевина кристаллическая, 20%-ный раствор мочевины, концентрированная азотная кислота, насыщенный раствор щавелевой кислоты, насыщенный раствор гидроксида бария, 1%-ный раствор сульфата меди, бром, лакмусовая бумага (синяя и красная); лед, пипетки, изогнутые газоотводные трубки, химические стаканы на 100 мл, пробирки.
22.1.Растворимость мочевины в воде и образование ее солей. В пробирку вносят 0,2—0,5 г мочевины и добавляют несколько капель воды до полного ее растворения. По капле раствора наносят на синюю и красную лакмусовую бумагу. Раствор мочевины нейтрален на лакмус. Тем не менее основные свойства мочевины можно обнаружить при взаимодействии ее с кислотами. Полученный концентрированный раствор мочевины делят на две части. К первой части добавляют 2—3 капли концентрированной азотной кислоты, а ко второй — 2—3 капли насыщенного раствора щавелевой кислоты. Через несколько секунд наблюдают выпадение кристаллов солей мочевины:
Почему мочевина дает соль только по одной аминогруппе? Способность мочевины образовывать труднорастворимую соль с азотной кислотой используют для обнаружения мочевины в моче. В сутки с мочой из организма человека выделяется около 30 г мочевины.
22.2Гидролиз мочевины.В пробирку вносят 0,1—0,2 г мочевины и добавляют 1—2 мл баритовой воды (насыщенный раствор гидроксида бария). Раствор кипятят до выпадения в осадок карбоната бария. Влажная красная лакмусовая бумажка, поднесенная к отверстию пробирки во время кипячения раствора, синеет в связи с выделением аммиака:
В живых организмах гидролиз мочевины происходит под действием фермента уреазы (urea — лат.— мочевина).
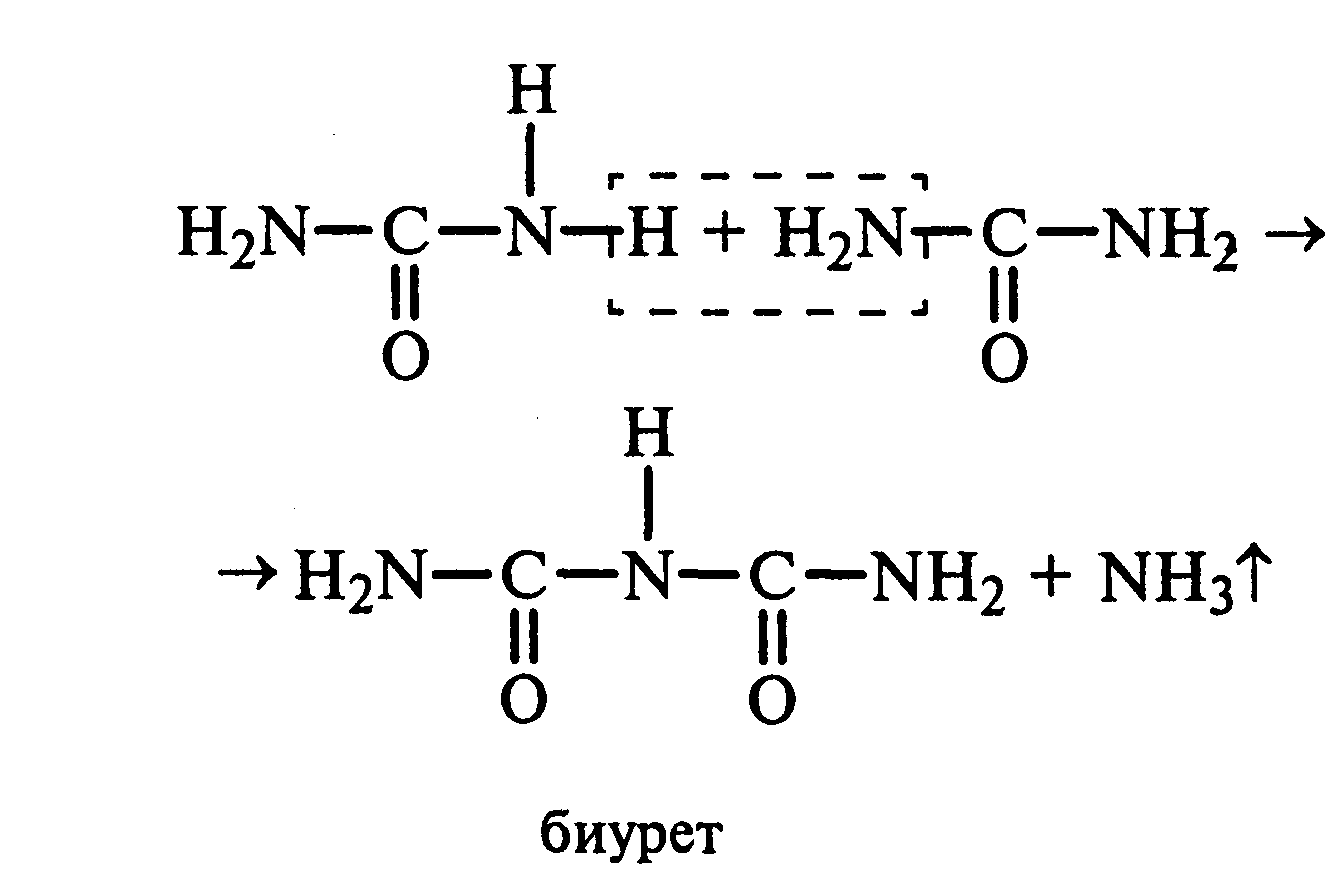
22.3 Образование биурета.В сухую пробирку насыпают 0,2 г мочевины и нагревают ее в пламени горелки. Мочевина сначала плавится, а потом при дальнейшем нагревании разлагается с выделением аммиака, который обнаруживают по посинению влажной красной лакмусовой бумажки, поднесенной к отверстию пробирки, и по запаху. Через некоторое время плав в пробирке затвердевает, несмотря на продолжающееся нагревание:
Пробирку охлаждают, добавляют в нее 2 мл воды и при слабом нагревании растворяют полученный биурет. Когда осадок отстоится, сливают с него раствор биурета и добавляют несколько капель 10%-ного раствора гидроксида натрия и 1—2 капли 1%-ного раствора сульфата меди. Раствор окрашивается в розово-фиолетовый цвет вследствие образования комплексной медной соли биурета.
Схема таутомерных превращений биурета:
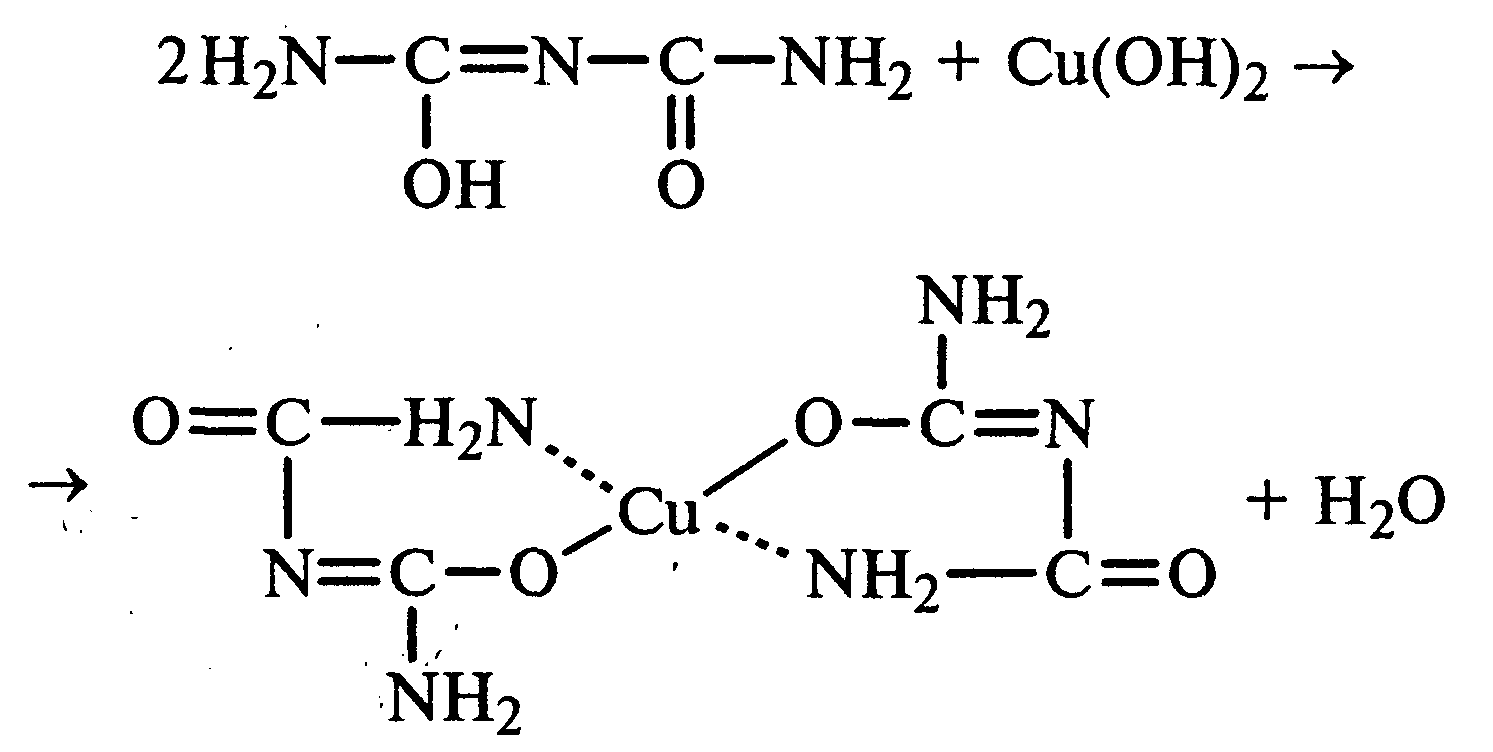
Уравнение реакции биурета с гидроксидом меди (II):
комплексная медная соль биурета.
Эта реакция называется биуретовой. Она также является цветной реакцией на пептиды и белки.
Опыт 23. Растворимость анилина и его солей в воде. Основные свойства анилина
Реактивы и оборудование:анилин, концентрированная соляная кислота, 10%-ный раствор серной кислоты, раствор гидроксида натрия, синяя и красная лакмусовая бумага; пробирки.
К 5—6 каплям анилина приливают 2—3 мл воды. После тщательного перемешивания получают мутную жидкость — эмульсию анилина в воде. Анилин плохо растворяется в воде, поэтому иногда его называют анилиновым маслом. В полученную эмульсию опускают красную, а затем синюю лакмусовые бумажки. Изменение цвета индикаторов не наблюдается.
Кислотно-основные свойства анилина выражены слабо. Однако основные свойства анилина четко проявляются в его способности образовывать соли с минеральными кислотами.
Эмульсию анилина разливают в две пробирки. К одной части по каплям при встряхивании добавляют концентрированную соляную кислоту. Постепенно происходит просветление мутной жидкости вследствие образования легко растворимой в воде соли — хлорида фениламмония:
В пробирку с полученной солью приливают раствор гидроксида натрия. Наблюдают помутнение жидкости вследствие выделения анилина:
Во вторую пробирку с эмульсией анилина прибавляют по каплям 10%-ный раствор серной кислоты. После ее встряхивания и охлаждения наблюдают выпадение белого осадка трудно растворимого в воде гидросульфата фениламмония:
При добавлении раствора гидроксида натрия осадок растворяется, и жидкость мутнеет.
Источник
2.3. Мочевина Опыт 13. Свойства мочевины
Реактивы и оборудование:мочевина кристаллическая, 20%-ный раствор мочевины, концентрированная азотная кислота, ледяная уксусная кислота, концентрированный раствор гидроксида натрия, насыщенный раствор щавелевой кислоты, насыщенный раствор гидроксида бария, 20%-ный раствор нитрита натрия, 10%-ный раствор гидроксида натрия, 1%-ный раствор сульфата меди, бром, лакмусовая бумага (синяя и красная); лед, пипетки, изогнутые газоотводные трубки, химические стаканы на 100 мл, пробирки.
13.1. Растворимость мочевины в воде и образование ее солей. В пробирку вносят 0,2—0,5 г мочевины и добавляют несколько капель воды до полного ее растворения. По капле раствора наносят на синюю и красную лакмусовую бумагу. Раствор мочевины нейтрален на лакмус. Тем не менее основные свойства мочевины можно обнаружить при взаимодействии ее с кислотами. Полученный концентрированный раствор мочевины делят на две части. К первой части добавляют 2—3 капли концентрированной азотной кислоты, а ко второй — 2—3 капли насыщенного раствора щавелевой кислоты. Через несколько секунд наблюдают выпадение кристаллов солей мочевины:
Почему мочевина дает соль только по одной аминогруппе? Способность мочевины образовывать труднорастворимую соль с азотной кислотой используют для обнаружения мочевины в моче. В сутки с мочой из организма человека выделяется около 30 г мочевины.
13.2 Гидролиз мочевины.В пробирку вносят 0,1—0,2 г мочевины и добавляют 1—2 мл баритовой воды (насыщенный раствор гидроксида бария). Раствор кипятят до выпадения в осадок карбоната бария. Влажная красная лакмусовая бумажка, поднесенная к отверстию пробирки во время кипячения раствора, синеет в связи с выделением аммиака:
В живых организмах гидролиз мочевины происходит под действием фермента уреазы (urea — лат.мочевина).
13.3. Реакция мочевины с азотистой кислотой.В пробирку наливают 1 мл 20%-ного раствора мочевины, 1,5 мл 20%-ного раствора нитрита натрия и 2—3 капли ледяной уксусной кислоты. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой опускают в пробирку с баритовой водой. Пробирку с реакционной смесью встряхивают и наблюдают интенсивное выделение пузырьков газов — азота и оксида углерода (IV). Последний обнаруживают по помутнению баритовой воды.
Эта реакция подобна реакции с азотистой кислотой первичных аминов алифатического ряда и аминокислот. Ее также используют для количественного определения мочевины по методу Ван-Сляйка (масса мочевины рассчитывается по объему выделившегося азота).
13.4. Разложение мочевины гипобромитом натрия (тяга).Для приготовления раствора гипобромита натрия в пробирку наливают 1—2 мл концентрированного раствора гидроксида натрия и при охлаждении добавляют 3—4 капли брома. Смесь встряхивают до растворения брома и исчезновения его окраски.
К 1 мл 20%-ного раствора мочевины добавляют по каплям раствор гипобромита натрия. В пробирке наблюдают бурное выделение азота и оксида углерода (IV):
Эта реакция лежит в основе количественного определения мочевины по методу Бородина (массу мочевины рассчитывают по объему выделившегося азота).
13.5. Образование биурета.В сухую пробирку насыпают 0,2 г мочевины и нагревают ее в пламени горелки. Мочевина сначала плавится, а потом при дальнейшем нагревании разлагается с выделением аммиака, который обнаруживают по посинению влажной красной лакмусовой бумажки, поднесенной к отверстию пробирки, и по запаху. Через некоторое время плав в пробирке затвердевает, несмотря на продолжающееся нагревание:
Пробирку охлаждают, добавляют в нее 2 мл воды и при слабом нагревании растворяют полученный биурет. Когда осадок отстоится, сливают с него раствор биурета и добавляют несколько капель 10%-ного раствора гидроксида натрия и 1—2 капли 1%-ного раствора сульфата меди. Раствор окрашивается в розово-фиолетовый цвет вследствие образования комплексной медной соли биурета.
Схема таутомерных превращений биурета:
Уравнение реакции биурета с гидроксидом меди (II):
комплексная медная соль биурета.
Эта реакция называется биуретовой. Она также является цветной реакцией на пептиды и белки.
Источник
МОЧЕВИНА
МОЧЕВИНА (диамид угольной к-ты, карбамид) (NH 2 ) 2 CO, мол. м. 60,06; бесцв. кристаллы без запаха; кристаллич. решетка тетрагон. (а = 0,566 нм, b= 0,4712 нм, z = 2, пространств. группа P42 1 m); претерпевает полиморфные превращ.; т.пл. 132,7 °С; плотн. 1330 кг/м 3 (25 °С); п D 20 1,484; С° 93,198 ДжДмоль . К); DG 0 обр — 197,3 кДж/моль, DН 0 обр -333,3 кДж/моль, DН 0 сгор — 632,5 кДж/моль, DН 0 пл 14,53 кДж/моль, S 0 298 104,67 ДжДмоль . К); m 14,0 . 10 -30 Кл . м (вода, 25 °С); К 1,5 . 10 -14 (вода, 25 °С). Для расплава плотн. 1225 кг/м 3 ; h 0,00258 Па . с; g 0,036 Н/м; теплопроводность (135°С) 0,42 Вт/(м . К); р 2,3 Ом . м. Р-римость (г в 100 г р-рителя): в воде-51,8 (20°С), 71,7 (60°С), 95,0 (120°С); в жидком NH 3 -49,2 (20°С, 709 кПа), 90 (100 °С, 1267 кПа); в метаноле-22 (20 °С); в этаноле-5,4 (20 °С); в изопропано-ле-2,6 (20 °С); в изобутаноле-6,2 (20 °С); в этилацетате-0,08 (25 °С); не раств. в хлороформе. Молекула мочевины имеет плоское строение.
М очевина образует соед. включения с неорг. и орг. в-вами, напр. CO(NH 2 ) 2 . NH 3 , CO(NH 2 ) 2 • Н 3 РО 4 , CO(NH 2 ) 2 . H 2 O 2 , CO(NH 2 ) 2 . CH 3 OH и др.
При нагевании до 150°С и выше мочевина последовательно превращ. в NH 4 NCO, NH 3 , CO 2 , биурет, циануровую к-ту; в замкнутом сосуде, особенно при добавлении NH 3 ,-продукты ами-нирования циануровой к-ты, напр. меламин. В разбавленных р-рах при
200 °С возможен полный гидролиз мочевины с образованием NH 3 и СО 2 . Гидролиз ускоряется в присут. к-т и щелочей, а также под действием фермента уреазы, находящегося во мн. организмах и семенах нек-рых растений (соевые бобы и др.).
В расплавленном виде мочевина реагирует со щелочными металлами и их амидами с образованием солей цианамида. При сплавлении с содой разлагается до NaNCO, CO 2 , NH 3 и Н 2 О; при сплавлении с NH 4 NO 3 в присут. SiO 2 образуется гуанидин; при взаимод. с хлорсульфокислотами-амидо-сулъфокислоты; с конц. олеумом-сульфаминовая к-та; с (СН 3 СО) 2 О при 140°С-ацетамид и диацетамид (при 60 °С в присут. Н 2 SО 4 -ацетилмочевина); с хлором на холоду -N-хлор- и N,N’-дихлормочевина NH 2 CONHCl и CO(NHCl) 2 ; с бромом-циануровая к-та; с NaClO-гидразин; с CS 2 (110°C)-NH 4 SCN и COS. К действию Н 2 О 2 и KMnO 4 мочевина устойчива.
При алкилировании мочевины образуются алкилзамещенные мочевины RNHCONH 2 ; при действии спиртов -уретаны NH 2 COOR; при взаимод. с карбоновыми к-тами, их ангидридами, хлор-ангидридами и сложными эфирами-уреиды RCONHCONH 2 ; с двухосновными к-тами-циклич. уреиды, напр. с натрий-малоновым эфиром в спиртовом р-ре—барбитуровая к-та; с ангидридами ароматич. двухосновных к-т-соответствующие имиды, напр. с фталевым ангидридом при 156°С-фталимид; с аминами — высокомол. продукты поликонденсации типа NH 2 (CH 2 ) n [NHCONH(CH 2 ) n ] m ; с анилином — фенил- и дифе-нилмочевины; с гидразином-семикарбазид NH 2 CONHNH 2 и гидразоформамид (NH 2 CONH) 2 . Мочевина легко конденсируется с формальдегидом, образуя мочевино-формалъдегидные смолы. В нек-рых р-циях проявляется таутомерная форма мочевины-изомочевина NH 2 C(OH)=NH; напр., при взаимод. гидрохлорида цианамида со спиртами образуются О-алкило-вые эфиры изомочевины.
М очевина-конечный продукт белкового обмена у мн. беспозвоночных и большинства позвоночных животных (рыб, земноводных, млекопитающих) и человека. Биосинтез мочевины из конечных продуктов распада белков (NH 3 , CO 2 ) протекает в печени в результате ряда ферментативных р-ций, замкнутых в цикл (цикл мочевины, или орнитиновый цикл). Мочевина участвует в регуляции водного режима животных. Из организма выводится почками в виде мочи и потовыми железами (человек выделяет 25-30 г мочевины в сутки). У животных содержится в небольших кол-вах в мышцах, крови, лимфе, слюне, молоке, слезах, обнаружена в тканях растит. организмов (грибы, нек-рые высшие растения).
В пром-сти мочевина получают по р-ции Базарова:
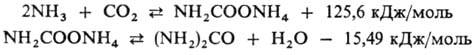
Произ-во мочевины включает стадию синтеза, осуществляемого при 180-230 °С и давлении 12-25 МПа, рецикл непрореагировавших в-в в виде аммониевых солей угольной к-ты, стадии обезвоживания р-ров мочевины и приготовления товарных форм (кристаллы, гранулы). В совр. технологии широко применяют дистилляцию в токе СО 2 или NH 3 , позволяющую значительно повысить экономичность процесса. Разработаны научно-техн. решения для создания безотходного и энергосберегающего произ-ва мочевины с единичной мощностью агрегатов 450 тыс. т/год и более.
Препаративных методов синтеза мочевины известно более пятидесяти; напр., взаимод. NH, с СОСl 2 , COS или СО, ацетиленом или бензолом на Pt; окислением цианида калия КМnО 4 или NaClO; нагреванием СО в медноаммиачном р-ре под давлением; гидролизом Pb(CN) 2 кипящей водой и др.
Для количеств. определения мочевины гидролизуют в присут. H 2 SO 4 или уреазы и определяют NH 3 . Для обнаружения мочевины используют появление желто-зеленого окрашивания при взаимод. р-ра мочевины с n-диметиламинобензальдегидом в присут. НСl; ниж. предел определения мочевины в фотометрируемом объеме 2 мг/л.
М очевины применяют в качестве концентрир. азотного удобрения (содержит ок. 46% N) для мн. с.-х. культур на любых почвах, а также как заменитель естеств. белка в кормах для жвачных животных. Производные мочевины-эффективные гербициды. Мочевина-сырье для синтеза ценных хим. продуктов: карбамидных смол, меламина, циануровой к-ты и ее эфиров, NaCN, KCN, гидразина, гидразоформамида, а также фармацевтич. препаратов (веронала, люминала, бромурала и др.), нек-рых красителей. В нефтяной пром-сти мочевину используют для де-парафинизации масел и моторных топлив с выделением мягкого парафина-сырья для получения белково-витамин-ных препаратов, жирных спиртов и к-т, моющих ср-в и т. п.
Мировое произ-во 106 млн. т/год (1984).
М очевина открыта И. Руэлем (1773) в моче, идентифицирована У. Праутом (1818), впервые синтезирована Ф. Вёлером (1828) из цианата аммония, что нанесло первый удар по витализму-учению о т. наз. жизненной силе.
===
Исп. литература для статьи «МОЧЕВИНА» : Кучерявый В. И., Лебедев В. В., Синтез и применение карбамида, Л., 1970; Кучерявый В. И., Горловский Д. М., Альтшулер Л. Н., Технология карбамида, Л., 1981; Кучерявый В. И., Горловский Д. М., «Ж. Всес. хим. об-ва им. Д. И. Менделеева», 1983, № 4, с. 47-54.
В. И. Кучерявый, Ю. А. Сергеев.
Страница «МОЧЕВИНА» подготовлена по материалам химической энциклопедии.
Источник