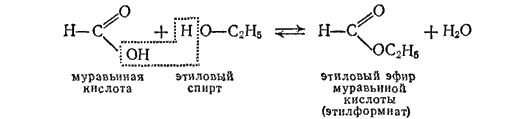- Сложные эфиры: способы получения и свойства
- Классификация сложных эфиров
- По числу карбоксильных групп:
- Номенклатура сложных эфиров
- Химические свойства сложных эфиров
- 2. Переэтерификация
- 3.Восстановление сложных эфиров
- Получение сложных эфиров
- 1. Этерификация карбоновых кислот спиртами
- 2. Соли карбоновых кислот с галогеналканами
- Гидролиз (омыление) сложных эфиров
- Гидролиз сложных эфиров
- Общие понятия о гидролизе сложных эфиров
- Гидролиз сложных эфиров
- Примеры решения задач
- Статьи
- Растворимость воды в сложных эфирах и гидролиз сложных эфиров
Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, химические и физические свойства, строение.
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
| Например, метилформиат |
- сложные эфиры многоосновных карбоновых кислот — содержат две и более карбоксильные группы -СОО-. Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4.
| Например, тристеарат глицерина |
Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Получение сложных эфиров
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
| Например, при взаимодействии ацетата натрия с хлорметаном образуется метилацетат. |
CH3-COONa + CH3-Cl = CH3-COOH + NaCl
Источник
Гидролиз (омыление) сложных эфиров



Под действием воды, особенно в кислой или щелочной среде, сложные эфиры разлагаются (гидролизуются) с образованием кислоты и спирта:
уксусноэтиловый эфир уксусная к-та этиловый спирт
Этим сложные эфиры отличаются от простых эфиров, которые, как уже известно, гидролизу не подвергаются. Однако гидролиз сложных эфиров идет медленно и гораздо менее энергично, чем гидролиз ангидридов.

R—C—O—R’ + NaOH ¾® R—C—ONa + R’—OH
сложный эфир соль к-ты спирт
Щелочной гидролиз сложных эфиров называют омылением. Скорость гидролиза эфиров возрастает также при нагревании и в случае применения избытка воды.
Способы получения сложных эфиров
Реакция этерификации
Сложные эфиры могут быть получены при непосредственном взаимодействии кислоты и спирта, например:
II укс. к-та II этиловый эфир
О О уксусной кислоты
Как уже было указано, такую реакцию называют реакцией этерификации. Для органических кислот она протекает очень медленно, причем, скорость образования эфира зависит от строения исходных кислот и спирта. Скорость этерификации увеличивается при нагревании и, особенно, в присутствии минеральных кислот благодаря каталитическому действию ионов водорода. Особенно в качестве катализатора применяют серную кислоту (В.В. Марковников, 1873г.)
Реакция этерификации обратима. Это объясняется тем, что получаемый сложный эфир гидролизуется одновременно образующейся при реакции водой, и поэтому процесс идет в обратном направлении с разложением эфира на кислоту и спирт. При этом, чем больше накапливается воды, тем больше скорость обратной реакции, последняя ускоряется и при нагревании, а также под влиянием ионов водорода, вводимых для ускорения прямой реакции. Таким образом, реакция этерификации не доходит до конца, а лишь достигает состояния химического равновесия, применение же катализаторов и повышение температуры только ускоряет достижения равновесия. Соотношение всех реагирующих веществ в момент равновесия зависит от строения кислоты и спирта, а также от склонности сложного эфира к гидролизу.
Чтобы увеличить количество образующегося эфира, т.е. сместить равновесие реакции этерификации вправо одно из реагирующих веществ (то, которое доступнее) берут в избытке (в соответствии с законом действия масс). При избытке спирта в реакцию может вступить практически вся кислота, при избытке кислоты – весь спирт.
Другой способ увеличения выхода сложного эфира заключается в постоянном выведении из реакции одного из образующихся веществ – эфира или воды. Так, применяемая при этерификации в качестве катализатора серная кислота, кроме того, является веществом, связывающим воду, и таким образом способствует смещению равновесия вправо.
Источник
Гидролиз сложных эфиров
Общие понятия о гидролизе сложных эфиров
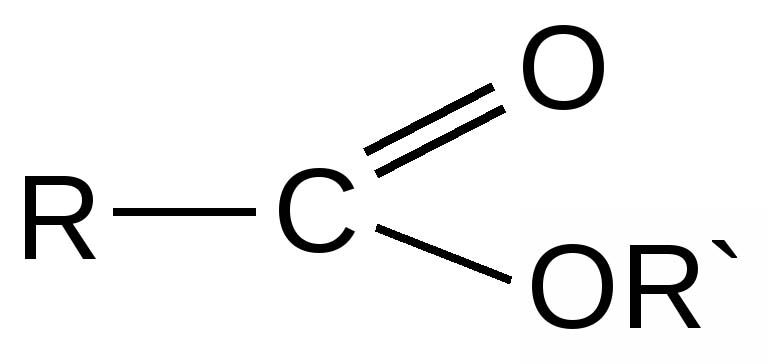
Структурная формула сложных эфиров в общем виде:
где R и R’ – углеводородные радикалы.
Гидролиз сложных эфиров
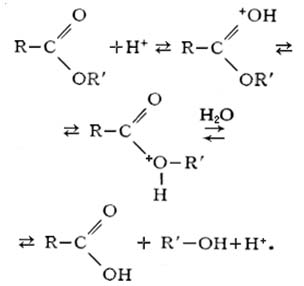
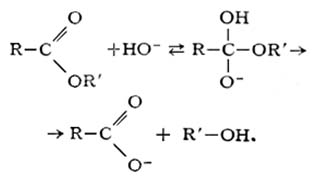
Одной из наиболее характерных для сложных эфиров способностей (помимо этерификации) является их гидролиз – расщепление под действием воды. По-другому гидролиз сложных эфиров называют омылением. В отличие от гидролиза солей в данном случае он практически необратим. Различают щелочной и кислотный гидролиз сложных эфиров. В обоих случаях образуются спирт и кислота:
а) кислотный гидролиз
б) щелочной гидролиз
Примеры решения задач
| Задание | Определите массу уксусной кислоты, которую можно получить в ходе реакции омыления этилацетата массой 180 г. |
| Решение | Запишем уравнение реакции гидролиза этилового эфира уксусной кислоты используя брутто формулы: |
Рассчитаем количество вещества этилацетата (молярная масса – 88 г/моль), используя значение массы из условий задачи:
Согласно уравнению реакции, число моль этилацетата и уксусной кислоты равны:
Тогда, можно определить массу уксусной кислоты (молярная масса – 60 г/моль):
m(CH3COOH)= υ (CH3COOH) × M (CH3COOH) = 2 × 60 = 120г.
Источник
Статьи
Растворимость воды в сложных эфирах и гидролиз сложных эфиров
Растворимость воды в сложных эфирах при 28С в большинстве случаев не превышает 0,05%, у отдельных эфиров — 0,1%; исключение составляют эфиры триэтилен- и полиэтиленгликолей и 2-этилгексановой кислоты, которые растворяют 0,2-1,3% воды. Следует полагать, что при содержании в эфире воды не более 0,1% скорость гидролиза эфира будет протекать весьма медленно.
Экспериментальные определения степени гидролиза большей части эфиров двухосновных кислот показывают, что их гидролиз в течение 24 час. не превышает 0,02-0,03%, кроме ди-2-этилгексилового эфира глутаровой кислоты и ди-2-(бутоксиэтокси) этилового эфира адипиновой кислоты, а также триэтиленгликольди-2-этилгексаноата, глубина гидролиза которых составляет соответственно 0,1, 0,2% в достаточно широком интервале рН (от 3,0 до 9,6).
Сложные эфиры, синтезированные из неполных эфиров многоатомных спиртов вместо спиртов того же молекулярного веса или путем взаимодействия полиэтиленгликолей с разветвленными одноосновными карбоновыми кислотами, должны обладать большей растворимостью воды, и потому можно предположить, что скорость гидролиза этих эфиров также должна быть больше.
Стойкость сложных эфиров к гидролитическому расщеплению, как правило, больше у эфиров, имеющих одну или несколько коротких боковых цепей в основной цепи молекулы. Эффект боковых цепей тем больше, чем ближе они расположены к эфирной связи. Желательно иметь боковые цепи в В-положении по отношению к спиртовому или кислотному остатку. Такое строение молекулы эфира как бы создает пространственные затруднения для гидролиза эфирной связи. Однако очень большое экранирование этой связи имеет и серьезный недостаток — при синтезе выходы эфиров такого строения должны быть невысоки соответственно степени экранирования.
Сложные эфиры, а также и приготовленные на их основе смазочные жидкости значительно менее вспениваются (при прохождении газов через слой жидкости), чем нефтяные масла, и их цена значительно менее устойчива.
Чистые эфиры не образуют с водой стойкой эмульсии, и эфир полностью отделяется от воды в течение 10 мин. или даже быстрее, скорость деэмульсации тем больше, чем меньше плотность эфира. Добавка к эфирам 0.2% 4-изобутил-2-фенилфенола не изменяет заметно скорости деэмульсации эфиров. При добавке к эфирам антикоррозийных присадок стойкость образующихся эмульсий этих эфиров с водой заметно увеличивается, меньше при добавках солей двухвалентных металлов арилстеариновых кислот, больше — при добавках нефтяных сульфонатов.
Источник