- Гидросульфат натрия: способы получения и химические свойства
- Способ получения
- Химические свойства
- Гидросульфид натрия
- Получение
- Физические свойства
- Химические свойства
- Токсичность
- Применение
- Натрий гидросульфид: свойства и особенности применения
- Свойства и характеристики гидросульфида натрия
- Существуют два метода получения сульфогидрата натрия:
- Во что упаковывается, как транспортируется и где должен храниться натрий гидросульфид?
- Техника безопасности как важный аспект работы с NaHS
- Где и для чего применяется натрий сернистый?
- Где в Украине сульфогидрат натрия купить лучше всего?
Гидросульфат натрия: способы получения и химические свойства
Гидросульфат натрия NaHSO4 — кислая соль щелочного металла натрия и серной кислоты. Белое кристаллическое вещество. Плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 120,06; относительная плотность для ж. и тв. состояния d = 2,742; tпл = 186º C;
Способ получения
1. В результате взаимодействия холодной и концентрированной серной кислоты и гидроксида натрия, образуется гидросульфат натрия и вода:
2. Твердый сульфат натрия реагирует с концентрированной серной кислотой. В результате реакции образуется гидросульфат натрия:
3. При температуре до 50º C в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование гидросульфата натрия и газа хлороводорода:
Химические свойства
1. Гидросульфат натрия разлагается при температуре 250–320º C в вакууме с образованием пиросульфата натрия и воды :
2. Гидросульфат натрия может взаимодействовать со сложными веществами :
2.1. Г идросульфат натрия реагирует с концентрированным раствором гидроксида натрия . При этом образуются сульфат натрия и вода:
2.2. С хлоридом натрия гидросульфат натрия реагирует при температуре 450–800º C с образованием сульфата натрия и хлороводородной кислоты:
3. Гидросульфат натрия может взаимодействовать с простыми веществами-металлами :
Например , раствор гидросульфата реагирует с цинком:
Источник
Гидросульфид натрия
Гидросульфид натрия — кислая соль натрия и сероводородной кислоты с формулой NaHS, белые кристаллы. Образует несколько кристаллогидратов, например NaHS·2H2O, NaHS·3H2O.
Получение
- Пропускание сероводорода через раствор сульфида натрия:
N a 2 S + H 2 S ⇄ 2 N a H S
- Пропускание сероводорода через разбавленный раствор щёлочи:
N a O H + H 2 S ⇄ N a H S + H 2 O
Физические свойства
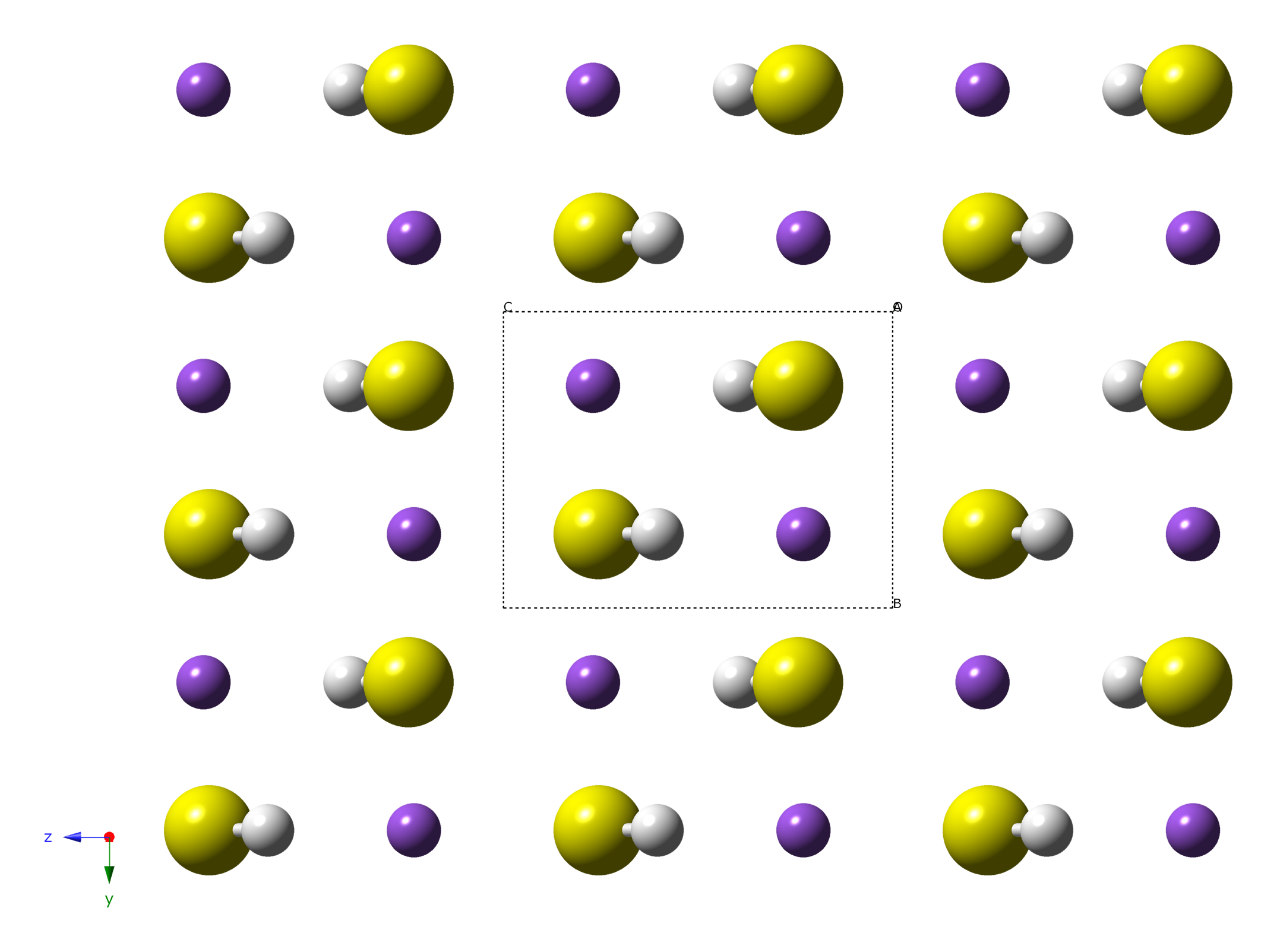
- Гидросульфид натрия образует белые кристаллы тригональной сингонии, пространственная группа R 3m, параметры ячейки a = 0,4460 нм, c = 0,915 нм, Z = 3.
- В расплавленном состоянии гидросульфид натрия имеет чёрный цвет.
Химические свойства
- Водные растворы гидросульфида натрия имеют щелочную реакцию вследствие гидролиза по аниону:
H S − + H 2 O ⇄ H 2 S + O H −
- При взаимодействии с щелочами образуется средняя соль:
N a H S + N a O H → N a 2 S + H 2 O
- Легко разрушается кислотами:
N a H S + H C l → N a C l + H 2 S ↑
- В щелочной среде с серой образует полисульфиды:
N a H S + N a O H + n S → N a 2 S n + 1 + H 2 O
- Окисляется, например, кислородом, до серы, которая образует полисульфиды:
N a H S + x O 2 → 100 o C N a 2 S n + 1 + N a O H
Токсичность
- При хранении во влажных условиях выделяет сероводород.
Применение
- В кожевенной промышленности как компонент состава для удаления наружного слоя шкур.
- Используют как сырьё в химической промышленности (для производства этилмеркаптана, бутифоса, красителей).
- В текстильной промышленности.
- Используется как восстановитель окисленной руды в горно-добывающей промышленности, при флотировании и извлечении металлосодержащего концентрата.
Источник
Натрий гидросульфид: свойства и особенности применения
Гидросульфид натрия – это вещество неорганической этимологии, востребованное в различных промышленных областях в немалом перечне разноплановых процессов. Без него сегодня не обходится химическая промышленность. Оно имеет немалое значение для добывающей индустрии. Кожевенное, текстильное, целлюлозно-бумажное и другие производства задействуют натрий гидросульфид в разных целях как качественное и функциональное сырье, доступное для приобретения.
Если и вам понадобился этот технический продукт… Если хотите узнать о нем как можно больше… Если интересует, где в Украине натрий гидросульфид купить оптом так, чтобы ни сомнений в качественном уровне, ни малейших чрезмерностей в плане стоимости не возникало… Данная статья поможет найти ответы на эти и другие сопутствующие вопросы. Читайте далее.
Свойства и характеристики гидросульфида натрия
Гидросульфид натрия, а также сульфогидрат/бисульфид натрия, натрий сернистый кислый, Sodium hydrosulfide/bisulfide – все это синонимические названия, обозначающие кислую соль натрия и сероводородной кислоты. Неорганическое кристаллическое вещество с характерным запахом, преимущественно белого цвета (иногда окрас варьируется от желтого до темно-коричневого и даже черного в расплавленном виде), образующее ряд кристаллогидратов (к примеру, NaHS·2H2O, NaHS·3H2O). Кроме рассыпчатой формы (в виде чешуек), возможен выпуск раствора, прозрачного или мутноватого (незначительный осадок допустим стандартом). Массовая доля основного вещества в товарной форме составляет 70 % от общего объема и более. В то же время, количество сульфида натрия не превышает 3 %, а железа – 0,0008 %. Общие объемы осадка, не растворяющегося в водной среде – 0,005 %.
Это твердое гигроскопичное вещество. Слабо поддается гидролизу. Является типичным восстановителем, испытывающим окисление под воздействием кислорода воздуха. Выступает аналогом каустика. Растворяется в таких средах, как вода и спирт. При этом растворение в воде происходит достаточно хорошо: 75,5 г/100 мл при 20 °C. Водным растворам этого соединения свойственна щелочная реакция, которая реализуется, ввиду гидролиза по аниону. Когда происходит кипячение (существенное повышение температуры), данный реактив теряет сульфид водорода, в результате чего баланс нарушается со сдвигом вправо. Также выделение сероводорода характерно при сочетании с водой либо кислотами. Последние бисульфид натрия с легкостью разрушают. Взаимодействуя со щелочами, он создает среднюю соль. В щелочных средах является источником полисульфидов. При окислительном воздействии кислорода появляется сера, а из нее – полисульфиды. Когда t р-вора снижается до 22 °C, выпадает осадок, когда же после она повышается опять (осуществляется повторный нагрев), осадочные образования снова становятся растворенными.
Молярная масса – 56,06 г/моль, плотность – 1,79 г/см³, t плавления – 350 °C (без разложения). Хим. формула: NaHS.
Существуют два метода получения сульфогидрата натрия:
- Пропуск дигидросульфида сквозь сульфиднатриевый раствор.
- Пропуск дигидросульфида через разбавленный р-вор щелочи (абсорбция растворенной каустической содой) с образованием на выходе NaHS и H2O.
Как видите, в обоих случаях синтез рассматриваемой соли происходит из сернистого водорода – основного сырьевого источника для ее получения.
Давайте еще рассмотрим популярный способ синтеза этого вещества (взаимодействие сульфида натрия и сероводорода) более детально. Чтобы получить сернистый натрий, восстанавливают сернокислый натрий с участием сульфата кальция, придерживаясь пропорции 1:0,5-1,25.. Содержащий сульфид натрия фильтрат поддается взаимодействию с сернистым водородом, полученным, в свою очередь, в ходе реакции шлама фильтрации с хлороводородной кислотой. Раствор появившегося хлорида кальция фильтруют, избавляясь, таким образом, от шлама. Избыточные объемы сероводорода поглощаются с помощью щелочного поглотителя.
Благодаря описанному методу получения, применению доступного и недорогого сырья, снижается себестоимость производственного процесса. В результате натрий гидросульфид оптом можно купить максимально выгодно. Дополнительный плюс – получение хлористого кальция – еще одного ценного хим. продукта с немалой широтой применения и стабильным рынком сбыта.
Во что упаковывается, как транспортируется и где должен храниться натрий гидросульфид?
Стандартная упаковка для указанного соединения – полипропиленовые мешки емкостью 25 кг.
Транспортировка возможна разными видами транспортных средств, в том числе железной дорогой повагонно, а также крытым автомобильным и речным транспортом. При этом запрещена его перевозка совместно с пищевой продукцией и кормами для сельскохозяйственных животных.
Что касается хранения, то для него необходимы сухие закрытые и хорошо проветриваемые помещения. Упакованное вещество следует размещать на поддонах или стеллажах из дерева. Оптимальный диапазон относительной влажности воздуха – до 70 %. Также важно обеспечить огнестойкость и исключить соседство с кислотами и мощными окислителями. Подбирая место и условия хранения, важно руководствоваться тем, что Sodium hydrosulfide способен выделять сероводород при повышении влажности, температуры, а также контакте с кислотами (плюс провоцирует в последнем случае коррозионные проявления).
Гарантийный срок годности – 1 год со дня изготовления.
Техника безопасности как важный аспект работы с NaHS
Что бы вам не предстояло делать с гидросульфидом натрия – производить его, перевозить, хранить или применять в работе – обязательно следует детально ознакомиться и тщательно соблюдать технику безопасности. Так получится свести к нулю любые риски, максимизировав при этом полезные стороны вещества. Поэтому сейчас рассмотрим, несет ли оно опасность, если да, то какую, и как, собственно, ей противостоять и бороться с негативными последствиями.
Итак, натрий сернистый кислый принадлежит к веществам четвертого класса токсичности. Негорюч, опасности пожара и взрыва не несет. Однако емкости, в которые он помещен, способны взрываться в случае нагрева. Если такое случится или продукт попадет в зону пожара, для тушения, а точнее для охлаждения, необходимо использовать распыленную воду (прямой контакт с водой запрещен). Также на помощь могут прийти пена, порошок и углекислый газ.
Что касается воздействия данной соли на организм человека в обычных условиях, то избегать следует любых прямых контактов неспроста. Вдыхание, проглатывание, попадание на кожу и в глаза, плюс превышение предельно допустимой концентрации в рабочем пространстве – все чревато немалыми негативами (сильными локальными и общими эффектами). Болевые ощущения, жжения, раздражения, покраснения, ожоги, нарушения дыхания, потеря сознания, рвота, кашель, насморк, слезотечение, ослабление организма, отеки век, легких, шок – вот основной перечень того, чего не избежать, нарушая правила обращения с этим химическим материалом. Но главная опасность, а именно смертельный исход, существует именно при проглатывании. Запомните это!
Чтобы минимизировать любые риски, используйте средства индивидуальной защиты глаз, органов дыхания и кожных покровов. Обязательно применение спецодежды и спецобуви, респиратора и защитных очков либо противогаза, а также специальных перчаток. Хорошую службу могут сослужить мази, пасты и кремы из силикона. Кроме того, во время работы нельзя употреблять пищу, напитки и курить. Важно соблюдать личную гигиену, в частности принимать душ по завершению работ.
Что делать в случае аварии? Главное – не паниковать. Необходимо предоставить первую помощь пострадавшим (обязательно находясь в СИЗ) и как можно быстрее ликвидировать утечку, предотвратив распространение негативного воздействия.
Случись что плохое, действуйте так:
— если вещество попало в дыхательную систему, нужно разместить пострадавшего полусидя, при необходимости сделать искусственное дыхание и поспособствовать оперативному предоставлению медицинской помощи;
— при контакте с кожей важно промывание значительными объемами воды (как вариант – принятие душа), а после – обращение к доктору;
— пораженные слизистые глаз следует хорошо промыть водой и без промедлений показаться медикам;
— проглатывание требует прополаскивания ротовой полости, выпивания нескольких стаканов воды без провоцирования рвоты и опять же помощи медицинских работников.
Что еще необходимо выполнить, так это прекратить доступ в зону опасности для посторонних, собрать сухое рассыпанное вещество, не прикасаясь к нему, и поместить в закрытые контейнеры для хранения и утилизации, согласно предписаниям.
Зная все вышесказанное и руководствуясь этим, можете смело приступать к работе. Теперь вам под силу минимизировать минусы и максимизировать плюсы гидросульфида натрия.
Где и для чего применяется натрий сернистый?
Гидросульфид натрия – это химический продукт, нашедший немалое применение в ряде стратегически важных промышленных отраслей. Один из самых известных процессов, в которых актуально его использование, это, пожалуй, выполнение роли флотационного реагента в горно-обогатительном сегменте. Сферы флотационного задействования весьма разнообразны. Обогащение руд цветных металлов в цветной металлургии способом флотации весьма популярно. Здесь рассматриваемое вещество известно как реагент-регулятор в процессах обогащения целого перечня руд: меди, свинца, цинка, молибдена и содержащих сурьму. Активное применение горно-обогатительными предприятиями объясняется не только технологическими свойствами материала, но и экономическими факторами (объемами предложения и ценами).
Sodium hydrosulfide ценен для химической промышленности, поскольку является хорошим во всех смыслах сырьевым материалом для изготовления ряда других веществ:
— к примеру, с его участием создают кальцинированную соду, необходимую для стеклопроизводства, мыловарения, изготовления эмалей, бытовой химии, ультрамарина и т.д., для смягчения воды, обезжиривания металлов, предотвращения полимеризации моторных масел, выполнения роли регулирующей кислотность, разрыхляющей, препятствующей слеживанию и появлению комков пищевой добавки и др.;
— также из него производят полисульфидные пластики и красители, примечательные своими уникальными эксплуатационными характеристиками;
— применяется это вещество и для создания этилмеркаптана (этантиола). Для этого специалистами реализуется взаимодействие бисульфида натрия, его водного раствора, с этилхлоридом. В основе общего метода синтеза меркаптанов – реакция между галогенпроизводными и NaHS;
— еще один продукт, для изготовления которого нужен гидросульфид натрия – бутифос. Это маслянистая жидкость-дефолиант для хлопчатника с большой дефолиирующей активностью. Фитотоксический эффект проявляется спустя 12 дней, не распространяется по всему растению, а приводит к опадению лишь тех листков, на которые изначально попадает.
Как вы можете догадаться, этим применение и значение данного соединения не ограничивается. Кроме всего прочего, сульфогидрат натрия используется в:
— кожевенной отрасли (составная часть материалов, задействуемых для выделки шкур, а именно для изъятия их внешней прослойки);
— текстильном направлении (изготовление синтетического шелка, отбеливание текстиля, в том числе льна, хлопка, рэйона и нейлона);
— целлюлозно-бумажном производстве (отбеливание бумаги).
Работаете в какой-либо из вышеупомянутых индустрий и хотите купить натрий гидросульфид оптом на выгодных условиях? Никаких проблем!
Где в Украине сульфогидрат натрия купить лучше всего?
Если поискать вещество в интернете, то можно найти весьма разнообразные предложения и по качеству продукта, и по условиям его приобретения (объемам и срокам поставок, ценам и т.д.). Как не ошибиться, принимая окончательное решение? Все просто! Обращайтесь в компанию «Система Оптимум»!
Мы много лет активно функционируем на рынке химической продукции Украины. Внимательно следим за качественным уровнем каждой поставляемой клиенту партии. Сотрудничаем исключительно с надежными и проверенными производителями и поставщиками сырья. Не завышаем стоимость, а, наоборот, при крупных оптовых заказах предоставляем дополнительные скидки в индивидуальном порядке. Предлагаем купить натрий гидросульфид, цена которого вас обязательно порадует.
По поводу такого аспекта работы, как оплата и доставка… Возможны разные варианты. Доставка – автотранспортом нашей компании и различными украинскими перевозчиками. Оплата – по согласованию с менеджером.
Если вас заинтересовал сульфогидрат натрия от ЧП «Система Оптимум», звоните! Предоставим всю недостающую информацию о продукте, чтобы вы могли принять окончательное решение с максимальной уверенностью в правильности выбора!
Источник