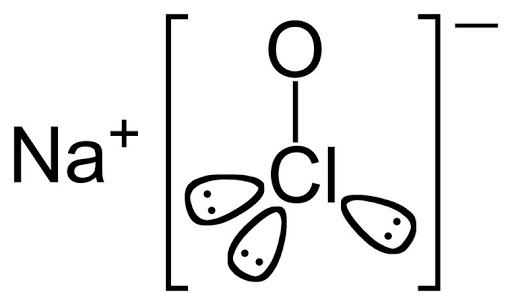- Очистка воды гипохлоритом натрия
- ОЧИСТКА ВОДЫ МЕТОДОМ ОКИСЛЕНИЯ ГИПОХЛОРИТОМ НАТРИЯ. КАК РАБОТАЕТ МЕТОД
- ХИМИЧЕСКАЯ РЕАКЦИЯ ОКИСЛЕНИЯ ДВУХВАЛЕНТНОГО ЖЕЛЕЗА
- ПОКАЗАНИЯ К ИСПОЛЬЗОВАНИЮ
- ПРИМЕР РАСЧЕТА КОЛИЧЕСТВО ГИПОХЛОРИТА НАТРИЯ
- СРОК ГОДНОСТИ ГИПОХЛОРИТА НАТРИЯ
- НАСОСЫ ДОЗАЦИИ
- СОВЕТЫ ПО МОНТАЖУ И НАСТРОЙКЕ НАСОСА ДОЗАЦИИ
- СОВЕТЫ ПО ЗАПУСКУ СИСТЕМЫ
- Журнал «Сырье и Упаковка»
- Текущий номер
- Ближайшие выставки
- Партнеры
- Гипохлориты и их применение в средствах бытовой химии
- 30.03.2020
- Введение
- История открытия
- Физические свойства
- Химические свойства
- Дезинфицирующее действие
- Методы анализа
- Способы получения наиболее важных товарных продуктов
- Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
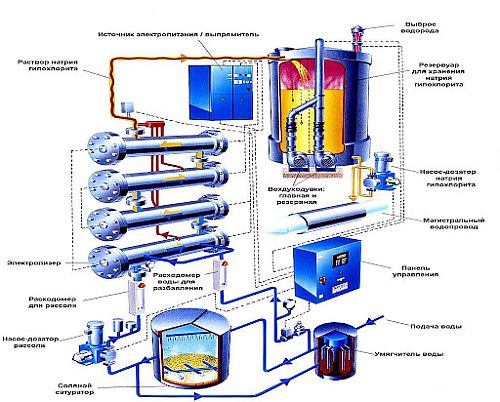
Очистка воды гипохлоритом натрия
Одной из эффективных, современных, а главное, безопасных для здоровья схем химического окисления воды для её очистки является метод окисления гипохлоритом натрия. Даже без угольной очистки, после дозации гипохлорита и обезжелезивания вода становится чистой и пригодной для использования в быту.
ОЧИСТКА ВОДЫ МЕТОДОМ ОКИСЛЕНИЯ ГИПОХЛОРИТОМ НАТРИЯ. КАК РАБОТАЕТ МЕТОД
Суть метода заключается в пропорциональном дозировании водного раствора гипохлорита натрия (натрия хлорноватокислого Марки А) в целях окисления железа, марганца, сероводорода и других органических веществ для общей водоочистной дезинфекции. В этом процессе задействуют срабатывающий от импульсного счетчика в момент расхода воды насос дозации.
Схема процесса выглядит так. Вода поступает в систему водоочистки, это фиксируется счетчиком, включается магнитный контакт (геркон), подаётся импульс на насос дозации, насос осуществляет рассчитанное количество впрысков раствора гипохлорита в подающую трубу, ведущую в систему водоочистки. Чем больше расход воды, тем больше импульсов и, соответственно, больше впрысков. Как только расход воды прекращается, процесс останавливается.
ХИМИЧЕСКАЯ РЕАКЦИЯ ОКИСЛЕНИЯ ДВУХВАЛЕНТНОГО ЖЕЛЕЗА
Как известно из школьной программы, окислением называют реакцию присоединения кислорода к другим элементам. Легко подвергаются окислению простейшие металлы — железо и марганец
Процесс окисления двухвалентного железа происходит по формуле:
2 Fe(HCO3)2 + NaClO + H2O = 2 Fe(OH)3↓ + 4 CO2↑ + NaCl (10)
Являясь сильным окислителем, кислород воздуха всегда ищет источник окисления и вступает в химическую реакцию с этим веществом.
В глубоких артезианских скважинах железо находится в растворенном состоянии и при попадании в воду кислорода со временем превращается в коллоидный раствор железа (Fe(OH)3). После коагуляции коллоидный раствор превращается в гидроксид железа
(Fe2O3 · 3H2O), образуя твердый осадок, который застревает в загрузке фильтра-обезжелезивателя.
Гипохлорит выигрывает перед кислородом воздуха, т.к. последний действует медленно и быстро расходуется на окисление, а гипохлорит действует лучше, как по времени так и по эффективности. При взаимодействии с растворенным железом, марганцем, сероводородом и органическими веществами гипохлорит легко отдает атом кислорода. Углекислый газ, освободившись от молекулы железа улетучивается, а окисленное до твердого трехвалентного состояния железо выпадает в осадок и застревает в фильтрующей среде обезжелезивателя. Концентрация пищевой соли и углекислого газа настолько незначительна, что никак не влияет на качество воды.
Сложнее с сероводородом (Н2S). Его сложно удалить из воды, и он препятствует процессу окисления железа. Однако под воздействием гипохлорита натрия сероводород распадается, превращаясь в серу. В виде сульфатов сера в твердом состоянии успешно задерживается в загрузке обезжелезивателя.
ПРЕИМУЩЕСТВА МЕТОДА ОКИСЛЕНИЯ ГИПОХЛОРИТОМ НАТРИЯ ПЕРЕД МЕТОДОМ АЭРАЦИИ
Цена (аэрация дороже в среднем на 15 тыс.руб, а стоимость раствора мизерная).
Более тихая работа (звук работы насоса дозации гораздо ниже воздушного компрессора).
Эффективность (гипохлорит натрия — отличный окислитель, не требующий контактной ёмкости).
Возможность точного расчета (точную дозировку раствора можно посчитать, а объём воздуха — нет).
Наличие гибкой настройки дозации (на выбор: насосы разной мощности и с разными функциями управления).
Гипохлорит натрия — сильный и быстро работающий окислитель. При концентрациях до 15 мг/л железа для его использования в бытовых системах очистки воды домов, коттеджей и дач контактная ёмкость не требуется. Гипохлорит подается в трубу в непосредственной близости к осадочному фильтру (обезжелезивателю).
ПОКАЗАНИЯ К ИСПОЛЬЗОВАНИЮ
Гипохлорит натрия применяется там, где использование напорной аэрации не рекомендуется из-за наличия больших концентраций следующих элементов:
— сероводорода (от 0,01 мг/л, запах 4-5 баллов),
— железа (от 8-10мг/л),
— марганца (от 0,7мг/л),
— органических веществ (перманганатная окисляемость выше 4,5).
ПРИМЕР РАСЧЕТА КОЛИЧЕСТВО ГИПОХЛОРИТА НАТРИЯ
Возьмём скважину со следующими параметрами:
Железо двухвалентное — 8,8 мг/л.
Марганец — 0,39 мг/л.
Сероводород — 0,01 мг/л.
Потребляемый объем воды — 2 куба в сутки.
При указанных параметрах для дозировки понадобится 1,5 литра рабочего раствора (10 г/л) в сутки.
Для более точного расчёта по Вашим параметрам Вы можете обратиться к специалистам нашей компании. Вам обязательно помогут.
СРОК ГОДНОСТИ ГИПОХЛОРИТА НАТРИЯ
Под воздействием температуры воздуха, света и других факторов, как и бензин, гипохлорит натрия со временем теряет свою эффективность. За год концентрация активного хлора падает в среднем со 190 до 110 г/л.
Рекомендуется со временем повышать концентрацию рабочего раствора. Логично, что закупать гипохлорит впрок в больших количествах нецелесообразно: 1 запасной канистры будет достаточно. Гипохлорит натрия доступен к покупке по средней цене 1250 руб. за 30-литровую канистру.
НАСОСЫ ДОЗАЦИИ
Гипохлорит натрия — является коррозийно-активным веществом и агрессивен даже к стали, меди и алюминию. Его дозация происходит в протекающую по трубе воду, поэтому здесь важна высокая точность дозировки. Для этого используются специальные насосы-дозаторы.
Различают насосы дозации двух типов — мембранные и перистальтические.
Мембранные насосы — отличаются относительной дешевизной, создают большое давление, но грешат щелчками в момент срабатывания впрыска реагента. В основе их работы — резкие толчки электромагнитного клапана.
Перистальтические насосы — работают почти без звука, стойкие к износу, но дороже мембранных. Принцип работы заключается во вращении роликового механизма, проталкивающего раствор по эластичной трубочке.
Насосы дозации бывают как постоянного дозирования — не настраиваемые, так и с возможностью регулирования дозировки. Есть модели со встроенным контроллером, который, принимая сигнал от внешнего датчика, определяет пропорции дозирования автоматически.
Указанные виды насосов успешно справляются со своей основной задачей: по импульсному сигналу водяного счетчика подать нужное количество раствора в протекающую по трубе воду.
СОВЕТЫ ПО МОНТАЖУ И НАСТРОЙКЕ НАСОСА ДОЗАЦИИ
Насос можно установить двумя путями: либо на стену, либо на ёмкость с раствором.
Обратите внимание! Мембранным насосам вредит работа без жидкого раствора: может послужить скорейшему выходу его из строя. Для перистальтического насоса это не так важно, но вместо раствора он будет подавать в трубу водоснабжения воздух, и система будет «завоздушиваться», а это — нарушение технологии. Есть риск гидроударов при переключении режимов промывки в клапане обезжелезивателя.
Чтобы избежать попадания пыли в ёмкость и запах гипохлорита не выходил наружу, сверлите отверстия в пластиковом покрытии ёмкости на полмиллиметра меньше диаметра трубки, чтобы она входила в корпус ёмкости очень плотно. Тщательно очистите от стружки ёмкость перед тем как зальёте в нее рабочий раствор.
Для настройки насоса дозации ознакомьтесь с инструкцией на импульсный водосчетчик для определения частоты импульсов и с инструкцией на насос дозации для понимания объёма одной дозы впрыска. Вся эта информация необходима для расчета нужного для работы количества рабочего раствора.
После монтажа и настройки насоса дозации можно запускать систему.
СОВЕТЫ ПО ЗАПУСКУ СИСТЕМЫ
Обратите внимание на кран отбора пробы, расположенного после водосчетчика и перед угольным фильтром. В том случае, если система дозации настроена правильно, вода из этого крана, налитая в открытую ёмкость должна иметь запах свежести. Если чувствуется сильный запах хлора, значит есть ошибка в расчетах и раствора дозируется слишком много. Если есть легкий запах железа, сероводорода или застоявшейся воды — это значит, что активного хлора дозируется недостаточно, и его количества не хватает на окисление и удаление всех загрязнений из воды. В этих случаях пересчитайте дозировку и скорректируйте её.
Наличие в воде остаточного хлора можно определить также с помощью прибора для запуска бассейнов.
Вода, забранная с пробоотборного крана, должна иметь легкий вкус хлорированной воды — это норма. После прохождения угольного фильтра вкус воды станет приятным и без запаха. Показатель железа после теста должен быть 0,3 и менее мг/л.
Безусловно, настройка системы очистки воды методом окисления гипохлоритом натрия — процесс достаточно трудоёмкий и технически сложный. Обратитесь к нашим специалистам, для того, чтобы всё сделать правильно — и Вы долгие годы будете пользоваться чистой, вкусной и полезной водой.
Источник
Журнал «Сырье и Упаковка»
| Бизнес-портал косметической промышленности и индустрии чистоты |
Текущий номер
Ближайшие выставки
Партнеры
Гипохлориты и их применение в средствах бытовой химии
30.03.2020
| Д. А. Меркулов, к.х.н., зав. кафедрой фундаментальной и прикладной химии, ФГБОУ ВПО «Удмуртский государственный университет», г. Ижевск |
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
Таблица 1. Наиболее распространенные гипохлориты .
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
|---|---|---|---|---|
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий, жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) | KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO) 2 | 7778–54–3 | 142,98 |
История открытия
В 1774 г. шведский химик Карл Вильгельм Шееле получил хлор (Cl 2 ) в результате взаимодействия оксида марганца(IV) MnO 2 и соляной кислоты (HCl). Позже, в 1785 г. французский химик Клод Луи Бертолле обнаружил, что водный раствор газообразного хлора («хлорная вода»), содержащий хлорноватистую и хлороводородную кислоты, может отбелить белье, и сообщил о своих выводах Французской академии наук.
Cl 2 + H 2 O = HClO + HCl
Знания об отбеливающих свойствах хлора были незамедлительно использованы Джеймсом Уаттом на текстильной фабрике в Глазго. Несмотря на то, что отбеливание с использованием хлора был значительно эффективнее традиционных способов отбеливания солнечным светом, слабыми растворами кислот и щелочей, применение хлора ограничивалось его токсичностью и разрушающим действием на ткани. Для стабилизации раствора газообразного хлора в воде и безопасности его применения, в 1787 г. на Парижском предприятии Societe Javel хлор стали пропускать через водный раствор карбоната калия (поташа)
Cl 2 + K 2 СO 3 = 2KHCO 3 + KClO + KCl.
Глава предприятия Леонард Альбан назвал новый продукт «Eau de Javel» («жавелевая вода»), и вскоре белильная жидкость стала популярной во Франции и Англии.
В 1820 г. француз Антуан Лабаррак усовершенствовал способ получения отбеливателя, заменив поташ на более дешевый гидроксид натрия (каустическую соду). Полученный раствор гипохлорита и хлорида натрия получил название «Eau de Labarraque» («лабарракова вода»).
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Широкое применение гипохлоритов для обеззараживания питьевой воды и дезинфекции стало возможным гораздо позже, в начале XX века, благодаря развитию промышленного производства хлора электролизом поваренной соли.
Физические свойства
Гипохлориты встречаются нам преимущественно в виде водных растворов, хотя некоторые из них можно выделить в твердом виде. Так, известен безводный гипохлорит натрия, который представляет собой неустойчивое бесцветное кристаллическое вещество. Из кристаллогидратов наиболее устойчивой формой является NaClO×5H 2 O. Это соединение представляет собой белые или бледно-зеленые ромбические кристаллы, расплывающиеся на воздухе. При нагревании пентагидрата гипохлорита натрия до температуры 24,4°С, он плавится. Кристаллогидрат NaClO×2,5H 2 O плавится при температуре 57,5°С. Моногидрат крайне неустойчив и разлагается выше 60°С, при более высоких температурах разложение протекает со взрывом.
Таблица 2. Плотности и температуры замерзания водных растворов гипохлорита натрия.
| Концентрация, % | 1 | 2 | 4 | 6 | 8 | 10 | 14 |
| Плотность, г/мл (18 °С) | 1,0053 | 1,0121 | 1025,8 | 1,0397 | 1,0538 | 1,0681 | 1,0977 |
| Концентрация, % | 18 | 22 | 26 | 30 | 34 | 38 | 40 |
| Плотность, г/мл (18 °С) | 1,1288 | 1,1614 | 1,1953 | 1,2307 | 1,2680 | 1,3085 | 1,3285 |
| Концентрация, % | 2 | 4 | 6 | 8 | 10 | 12 | 15,6 |
| t зам , °С | – 2,2 | – 4,4 | – 7,5 | – 10,0 | – 13,9 | – 19,4 | –29,7 |
В отличие от гипохлорита калия, известного только в растворах, гипохлорит кальция можно выделить в форме бесцветных кристаллов, устойчивых в сухой атмосфере без углекислого газа. Из водных растворов гипохлорит кальция можно выделить в виде кристаллогидратов Ca(ClO) 2 ×2H 2 O, Ca(ClO) 2 ×3H 2 O, Ca(ClO) 2 ×4H 2 O.
Кислотно-основное равновесие между хлорноватистой кислотой и гипохлорит-ионом описывается обратимой реакцией с константой равновесия Ka = 2,63×10 –8 при 20°С.
Используя константу равновесия Ka, можно рассчитать мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от рН (рис.1).
Данные свидетельствуют, что при подкислении растворов гипохлоритов увеличивается доля неустойчивой хлорноватистой кислоты. При рН 7,58 существуют преимущественно гипохлорит-ионы.
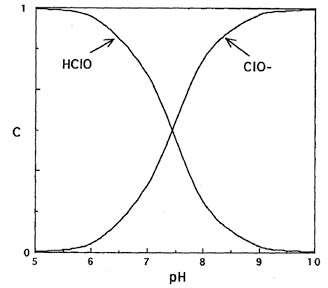
Рис. 1. Мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от кислотности среды.
Химические свойства
Гипохлориты являются неустойчивыми соединениями, легко разлагающимися с выделением кислорода. Разложение твердых гипохлоритов натрия и кальция можно представить уравнениями
2NaClO = 2NaCl + O 2 ↑ и 2Сa(ClO) 2 = СaCl 2 + O 2 ↑.
Процессы при комнатной температуре происходят медленно, а при нагревании могут протекать со взрывом. Параллельно реакциям, сопровождающимся образованием хлоридов и свободного кислорода, могут протекать реакции диспропорционирования
3NaClO = NaClO 3 + 2NaCl и 3Сa(ClO) 2 = Ca(ClO 3 ) 2 + 2СaCl 2 .
Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
4HClO = 2Cl 2 ↑ + O 2 ↑ + 2H 2 O.
Если при подкислении используется соляная кислота или в растворе присутствуют хлориды, образование кислорода не происходит
HClO + HCl = Cl 2 ↑ + H 2 O.
Хлорноватистая кислота очень слабая, поэтому она может быть вытеснена из раствора ее солей действием углекислого газа
ClO – + CO 2 + H 2 O = HCO 3 – + HClO.
В слабокислых и нейтральных средах при 3 2 ↑.
В нейтральных и щелочных растворах имеет место конкурирующая реакция образования хлоридов и хлоратов
3ClO – = ClO 3 – + 2Cl – .
При комнатной температуре реакция диспропорционирования протекает медленно, но при температурах выше 70°С эта реакция становится преобладающей.
В щелочных средах при рН > 7,5 в растворах преобладают гипохлорит-ионы, разлагающиеся следующим образом:
2ClO – = 2Cl – + O 2 ↑.
Стабилизация гипохлоритов в водных растворах . Соли хлорноватистой кислоты значительно устойчивее самой кислоты. С ростом рН уменьшается мольная доля хлорноватистой кислоты в растворе и тем самым повышается стабильность гипохлоритов (рис. 1). В области рН > 11 содержание хлорноватистой кислоты крайне низкое, однако, и при этой кислотности наблюдается медленное разложение соединений хлора(I). Протекающие реакции можно записать в виде:
2ClO – = ClO 2 – + Cl – , (1)
ClO 2 – + ClO – = ClO 3 – + Cl – , (2)
2ClO – = O 2 + 2Cl – . (3)
Около 95% от общего количества гипохлорит-ионов разлагается в результате последовательных реакций (1) и (2), причем реакция (1) является самой медленной (лимитирующей) и определяет общую скорость процесса. Реакция (3) не является основной, но отвечает за выделение кислорода, количество которого может быть значительным.
В присутствии некоторых ионов металлов, например, меди, никеля, кобальта наблюдается каталитическое разложение гипохлорит-ионов. Ионы железа обладают слабым каталитическим действием и являются сокатализаторами в сочетании с другими ионами металлов. В простейшем случае, при содержании ионов меди(II) в растворе в концентрации 1мг/кг порядки гомогенной реакции по гипохлориту и по меди(II) равны единице.
Гетерогенный катализ металлами и их нерастворимыми соединениями, является сложным и плохо воспроизводимым. Из нерастворимых катализаторов наибольшее мешающее влияние оказывает никель и его оксиды, которые попадают в растворы гипохлоритов при их контакте с легированными никелевыми сталями, используемыми для изготовления трубопроводов и резервуаров.
На константы скорости реакций (1)-(3) большое влияние оказывает ионная сила растворов. Высокие концентрации электролитов уменьшают константы скорости реакций и обеспечивают разумную стабильность при хранении растворов электролитов. Увеличение концентрации гипохлорит-ионов, напротив, уменьшает их стабильность в водных растворах. На рис. 2 показан феномен «кривой пересечения». Растворы гипохлорита натрия с концентрацией 9% и 5% при хранении разлагаются настолько, что через 50 недель показывают одинаковую концентрацию вещества, а через 100 недель первоначально более концентрированный раствор содержит гипохлорит-ионов меньше, чем разбавленный.
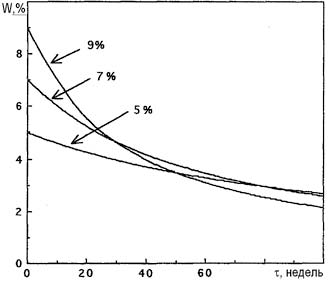
Рис. 2. Разложение гипохлорита натрия различных концентраций при 30°С.
Повышение температуры способствует ускорению процессов разложения гипохлоритов, поэтому целесообразно хранить растворы гипохлоритов в прохладном месте для обеспечения срока годности (рис. 3).

Рис. 3. Влияние температуры на разложение 5%-ного раствора NaClO.
Для стабилизации водных растворов гипохлоритов, а так же продуктов на их основе, каждый производитель применяет собственные методы, которые редко публикуются в виде статей. Однако известны некоторые запатентованные методы, которые, не претендуя на полноту, можно представить следующим списком:
- удаление хлорид-ионов, сопутствующих гипохлорит-ионам, методом кристаллизации;
- приготовление хлорноватистой кислоты, свободной от хлорид-ионов, методами электродиализа, дистилляции и жидкостной экстракции с последующей нейтрализацией щелочью;
- добавление многоатомных спиртов (например галактита, маннита, сорбита, инозита и пентаэритрита);
- добавление амидов;
- осаждение и фильтрация после добавления соединений щелочноземельных металлов;
- добавление перйодатов или перйодат-образующих соединений, способных образовывать комплексы с ионами металлов – катализаторов разложения гипохлоритов;
- добавление силикатов совместно с добавками или без добавок;
- добавление бромидов;
- добавление арилсульфаниламидов или их производных;
- увеличение светостойкости гипохлоритов путем добавления солей имидодисульфатов; солей церия и ЭДТА; феррицианидов; изоциануровой кислоты и цитрата натрия;
- добавление избытка хлорида железа с последующей фильтрацией;
- добавление гептоната натрия или боргептоната натрия;
- добавление 2-оксазолидинонов;
- добавление фосфата натрия;
- добавление бихромата калия;
- добавление солей кальция;
- добавление полидентатных гетероароматических соединений.
Направление окислительно-восстановительных процессов с участием гипохлорит-ионов и хлорноватистой кислоты обусловлены значениями стандартных электродных потенциалов полуреакций в водной среде:
2HClO + 2H + + 2e – = Cl 2 ↑ + 2H 2 O, E° = 1,630 В,
HClO + H + + 2e – = Cl – + H 2 O, E° = 1,500 В.
в нейтральной и щелочной среде
ClO – + H 2 O + 2e – = Cl – + 2OH – , E° = 0,890 В,
2ClO – + 2H 2 O + 2e – = Cl 2 ↑ + OH – , E° = 0,421 В.
Таким образом, гипохлорит-ионы и хлорноватистая кислота обладают выраженными окислительными свойствами, причем их окисляющая способность в кислой среде значительно выше, чем в нейтральной и щелочной средах.
Дезинфицирующее действие
Гипохлориты являются одними из лучших антибактериальных средств. Они убивают микроорганизмы очень быстро даже при очень низких концентрациях.
Наивысшее бактерицидное действие гипохлоритов проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты и гипохлорит-ионов приблизительно равны (рис. 1). Образующиеся при разложении гипохлоритов активные частицы (атомарный кислород и хлор) обладают высоким биоцидным действием. Они уничтожают микроорганизмы, взаимодействуя с биополимерами в их структуре, способными к окислению. Аналогичным образом, например, действуют клетки человека нейтрофилы, гепатоциты и др., которые синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Бактерицидная активность гипохлоритов настолько велика, что они способны привести к гибели дрожжеподобных грибов, вызывающих кандидоз, Candida albicans, в течение 30 секунд при действии 5,0 – 0,5%-го гипохлоритного раствора. Патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-ым раствором и через 30 минут после обработки 0,5%-ым раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 – 0,5%-м раствором гипохлорит-ионов.
Несмотря на высокую биоцидную активность гипохлоритов, некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, к сожалению, устойчивы к его действию.
При помощи гипохлорит-ионов можно успешно обезвреживать различные токсины (табл. 3).
Таблица 3. Результаты инактивации токсинов при 30-минутной экспозиции различных концентраций гипохлорита натрия («+» – токсин инактивирован; «–» – токсин остался активен).
| Токсин | 2,5% NaClO + 0,25 н. NaOH | 2,5% NaClO | 1,0% NaClO | 0,1% NaClO |
|---|---|---|---|---|
| Т-2 токсин | + | – | – | – |
| Бреветоксин | + | + | – | – |
| Микроцистин | + | + | + | – |
| Тетродотоксин | + | + | + | – |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
- окисление йодид-иона до йода в сильнокислой среде;
- выпадение коричневого осадка метагидроксида таллия(III) (TlO(OH)) при действии щелочного раствора соли таллия (I);
- цветная реакция с 4,4´-тетраметилдиаминодефенилметаном или N,N´-диокситрифенил метаном в присутствии бромата калия.
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на концентрацию «активного хлора» в ыделившегося при реакции
2H + + ClO – + Cl – = Cl 2 ↑ + H 2 O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.
Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения Лабарраком
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Существуют две производственные схемы данного метода:
- основной процесс, в результате которого производится 16%-ный раствор гипохлорита натрия в смеси с хлоридом натрия и гидроксидом натрия (рис. 4).
- низко-солевой или концентрированный процесс позволяет получить концентрированные растворы (25–40%) гипохлорита натрия с меньшим содержанием примесей. Его отличие от основного способа заключается в добавлении второй стадии хлорирования. Во второй реактор подается не гидроксид натрия, а раствор гипохлорита натрия из первого реактора, в результате происходит концентрирование готового продукта (рис. 5).
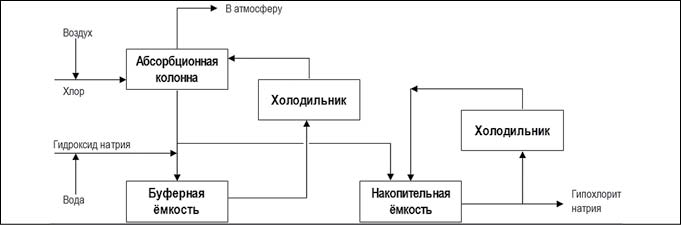
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
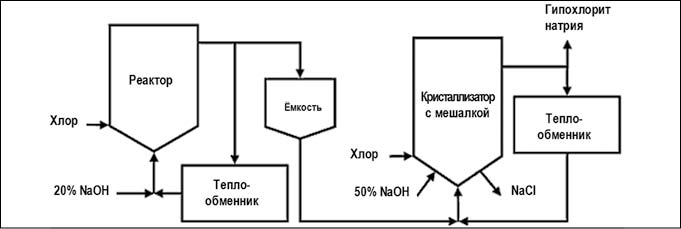
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)
При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процесса
NaCl + H 2 O = NaClO + H 2 ↑(суммарная реакция).
Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании
2Сa(OH) 2 + 2Cl 2 = Сa(ClO) 2 + СaCl 2 + 2H 2 O (суммарно).
Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.
Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|---|
| «Каустик» ЗАО, г. Стерлитамак | www.kaus.ru/ |
| «Каустик» ОАО, г. Волгоград | www.kaustik.ru/ |
| «Новомосковский хлор» ООО, г. Новомосковск | www.hlor.biz/ |
| «Сода-хлорат» ООО, г. Березняки | www.soda.perm.ru/ |
Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
В Российской Федерации гипохлориты производятся в соответствии с ГОСТ 11086–76 «Гипохлорит натрия. Технические условия» и ГОСТ 1692–85 «Известь хлорная. Технические условия». Гипохлорит натрия по назначению и показателям выпускается двух марок «А» и «Б» (табл. 5).
Таблица 5. Физико-химические показатели и назначение гипохлорита натрия по ГОСТ 11086–76
Источник