- Соляная Кислота
- Химическое название
- Химические свойства
- Получение соляной кислоты
- Фармакологическое действие
- Фармакодинамика и фармакокинетика
- Показания к применению
- Противопоказания
- Побочные действия
- Инструкция по применению (Способ и дозировка)
- Передозировка
- Взаимодействие
- Особые указания
- Описание соляной кислоты: формула, свойства и применение
- Формула и другие названия соляной кислоты
- Физические свойства
- Химические свойства
- Получение соляной кислоты
- Области применения
- В химической промышленности
- В металлургии
- В пищевой промышленности
- В быту
- В сельском хозяйстве
- В медицине
- В строительстве
- Интересные факты
Соляная Кислота
Химическое название
Химические свойства
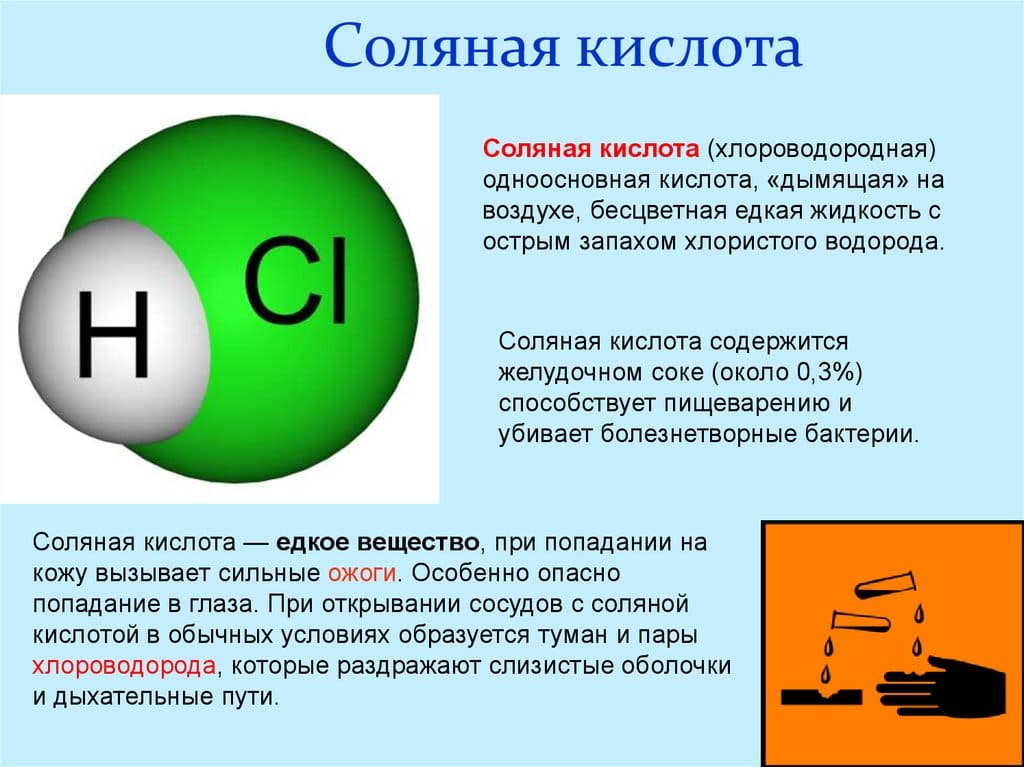
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Формула Соляной Кислоты в химии: HCl. В молекуле атомы водорода соединяются с атомами галогена – Cl. Если рассмотреть электронную конфигурацию этих молекул, то можно отметить, что в образовании молекулярных орбиталей соединения принимают участие 1s-орбитали водорода и обе 3s и 3p-орбитали атома Cl. В химической формуле Соляной Кислоты 1s-, 3s- и 3р-атомные орбитали перекрываются и образуют 1 , 2 , 3 -орбитали. При этом 3s-орбиталь не носит связывающий характер. Наблюдается смещение электронной плотности к атому Cl и снижается полярность молекулы, но увеличивается энергия связи молекулярных орбиталей (если рассматривать ее в ряду с другими галогеноводородами).
Физические свойства хлористого водорода. Это прозрачная бесцветная жидкость, обладающая способностью дымиться при соприкосновении с воздухом. Молярная масса химического соединения = 36,6 грамма на моль. При стандартных условиях, при температуре воздуха 20 градусов Цельсия, максимальная концентрация вещества составляет 38% по массе. Плотность концентрированной хлороводородной к-ты в такого рода растворе составляет 1,19 г/см³. В целом же, физические свойства и такие характеристики, как плотность, молярность, вязкость, теплоемкость, температура кипения и pН , сильно зависят от концентрации раствора. Эти величины подробнее рассматриваются в таблице плотностей. Например, плотность Соляной Кислоты 10% = 1,048 кг на литр. При затвердевании вещество образует кристаллогидраты разных составов.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H. С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует хлорид натрия и воду. Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. Карбонат кальция и карбонат натрия будут образовывать после реакции с HCl хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца, перманганатом калия: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O. Вещество реагирует с аммиаком, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония. Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца: MnO2+4HCl=Cl2+MnO2+2H2O (реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра выпадает белый осадок хлорида серебра и образуется азотная к-та. Уравнение реакции взаимодействия метиламина с хлористым водородом выглядит следующим образом: HCl + CH3NH2 = (CH3NH3)Cl.
Вещество реагирует со слабым основанием анилином. После растворения анилина в воде к смеси прибавляют Соляную Кислоту. В результате основание растворяется и образует солянокислый анилин (хлорид фениламмония): (С6Н5NH3)Cl. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3CH4+4AlCl3. Уравнение реакции карбоната калия с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Получение соляной кислоты
Чтобы получить синтетическую Соляную Кислоту сжигают водород в хлоре, а затем полученный газообразный хлороводород растворяется в воде. Также распространено производство реактива из абгазов, которые образуются в виде побочных продуктов при хлорировании углеводородов (абгазная Соляная Кислота). При производстве данного химического соединения применяют ГОСТ 3118 77 – на реактивы и ГОСТ 857 95 – для технической синтетической хлористоводородной кислоты.
В лабораторных условиях можно применять давний способ, при котором поваренная соль подвергается действию концентрированной серной к-ты. Также средство можно получить с помощью реакции гидролиза хлорида алюминия или магния. Во время реакции могут образоваться оксихлориды переменного состава. Для определения концентрации вещества применяют стандарт титры, которые выпускаются в запаянных ампулах, чтобы в последствии можно было получить стандартный раствор известной концентрации и использовать его для определения качества другого титранта.
У вещества имеется достаточно широкая область применения:
- его используют в гидрометаллургии, при декапировании и травлении;
- при очистке металлов при лужении и пайке;
- в качестве реактива для получения хлорида марганца, цинка, железа и других металлов;
- при изготовлении смесей с ПАВ-ами для очистки металлических и керамических изделий от инфекции и грязи (применяется Кислота Соляная ингибированная);
- в качестве регулятора кислотности E507 в пищевой промышленности, в составе содовой воды;
- в медицине при недостаточной кислотности желудочного сока.
Данное химическое соединение имеет высокий класс опасности – 2 (по ГОСТу 12Л.005). При работе с кислотой требуется спец. защита кожи и глаз. Достаточно едкое вещество при попадании на кожу или в дыхательные пути вызывает химические ожоги. Для ее нейтрализации применяют растворы щелочи, чаще всего – питьевую соду. Пары хлороводорода образуют с молекулами воды в воздухе едкий туман, который раздражает дыхательные пути и глаза. Если вещество вступает в реакцию с хлорной известью, перманганатом калия и прочими окислителями, то образуется токсичный газ — хлор. На территории РФ ограничен оборот Соляной Кислоты с концентрацией более 15%.
Фармакологическое действие
Повышает кислотность желудочного сока.
Фармакодинамика и фармакокинетика
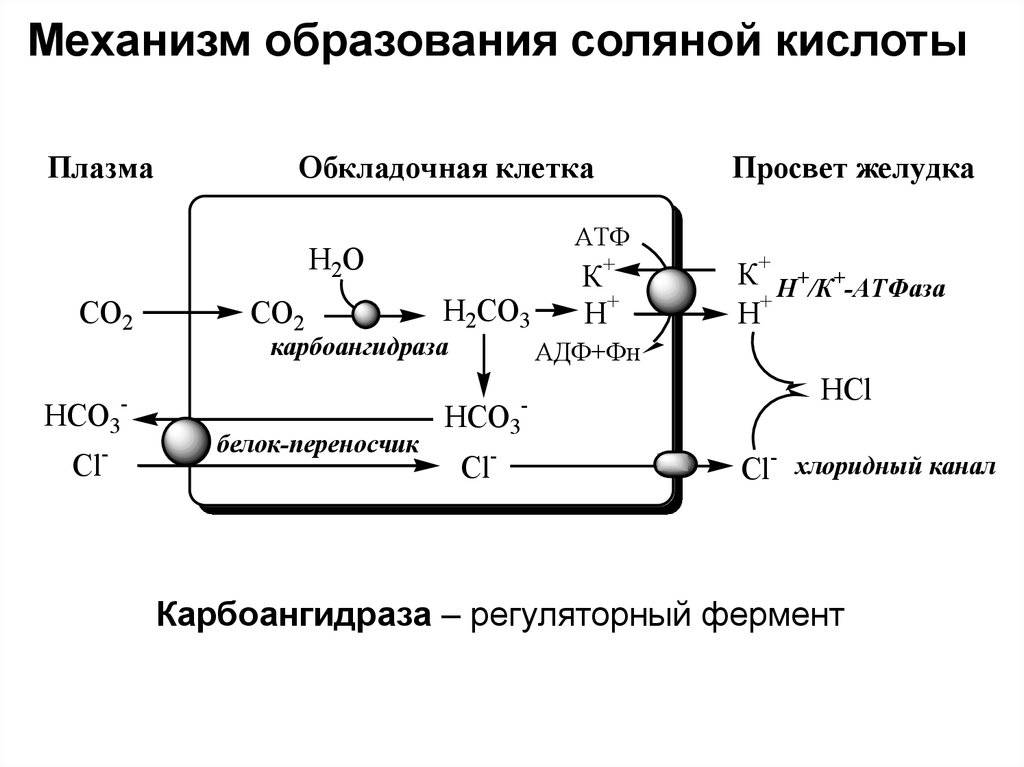
Что такое кислотность желудочного сока? Это характеристика концентрации Соляной Кислоты в желудке. Кислотность выражается в рН. В норме в составе желудочного сока должна вырабатываться кислота и принимать активное участие в процессах пищеварения. Формула хлороводородной кислоты: HCl. Ее продуцируют париетальные клетки, расположенные в фундальных железах, с участием Н+/К+-АТФазы. Эти клетки выстилают дно и тело желудка. Кислотность желудочного сока сама по себе изменчива и зависит от числа париетальых клеток и интенсивности процессов нейтрализации вещества щелочными компонентами желудочного сока. Концентрация продуцируемой к-ты стабильна и равняется 160 ммоль/л. У здорового человека в норме должно вырабатываться не более 7 и не менее 5 ммоль вещества в час.
При недостаточной или избыточной выработке Соляной Кислоты возникают заболевания пищеварительного тракта, ухудшается способность усваивать некоторые витамины и микроэлементы, например, железо. Средство стимулирует выделение желудочного сока, снижает рН. Активирует пепсиноген, переводит его в активный фермент пепсин. Вещество благоприятно воздействует на кислотный рефлекс желудка, замедляет переход не до конца переваренной пищи в кишечник. Замедляются процессы брожения содержимого пищеварительного тракта, исчезает боль, изжога и отрыжка, лучше усваивается железо.
После приема внутрь средство частично метаболизируется слюной и желудочной слизью, содержимым 12-перстной кишки. Несвязанное вещество проникает в 12-перстную кишку, где полностью нейтрализуется ее щелочным содержимым.
Показания к применению
Вещество входит в состав синтетических моющих средств, концентрата для полоскания ротовой полости ухода за контактными линзами. Разбавленная Соляная Кислота назначается при заболеваниях желудка, сопровождающихся пониженной кислотностью, при гипохромной анемии в сочетании с препаратами железа.
Противопоказания
Лекарство нельзя применять при аллергии на синтетическое вещество, при болезнях пищеварительного тракта, ассоциированных с повышенной кислотностью, при остром гастрите.
Побочные действия
Концентрированная Соляная Кислота при попадании на кожу, в глаза и дыхательные пути может вызывать сильные ожоги. В составе различных лек. препаратов используют разбавленное вещество, при длительном применении больших дозировок может возникнуть ацидоз, ухудшение состояния эмали зубов.
Инструкция по применению (Способ и дозировка)
Хлороводородную кислоту применяют в соответствии с инструкцией.
Внутрь лекарство назначают, предварительно растворив в воде. Обычно используют 10-15 капель препарата на пол стакана жидкости. Лекарство принимают во время еды, 2-4 раза в день. Максимальная разовая дозировка составляет 2 мл (около 40 капель). Суточная доза – 6 мл (120 капель).
Передозировка
Случаи передозировки не описаны. При бесконтрольном приеме вещества внутрь в больших количествах возникают язвы и эрозии в пищеварительном тракте. Следует обратиться за помощью к врачу.
Взаимодействие
Вещество часто используют в комбинации с пепсином и прочими лек. препаратами. Химическое соединение в пищеварительном тракте вступает во взаимодействие с основаниями и некоторыми веществами (см. химические свойства).
Особые указания
При лечении препаратами Соляной Кислоты необходимо четко придерживаться рекомендаций в инструкции.
Источник
Описание соляной кислоты: формула, свойства и применение
Кислоты – это химические соединения способные отдавать протон или принимать электронную пару с образованием ковалентной связи. Данный класс веществ имеет различные классификации: по числу атомов водорода, по происхождению, по силе. Соляная кислота является сильной, одноосновной неорганической кислотой.
Формула и другие названия соляной кислоты
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Физические свойства
Физические свойства HCl коррелируют с концентрацией данного соединения в растворе. Для того, чтобы не перегружаться цифрами, рассмотрим физические свойства хлористого водорода на примере его концентрированной формы (около 36%):
- низкая температура кипения (t=48 градусов по Цельсию);
- высокая температура плавления (t=30 градусов по Цельсию);
- плотность составляет 1,18 г/см 3 ;
- хлорид водорода обладает способностью к ионизации в водных растворах.
- при низкой температуре приобретает гидратную оболочку: HCL*H20 или HCl*2H2O;
- растворы хлороводородной кислоты бесцветные;
- в чистом виде находится в газообразном агрегатном состояние (а в растворах в жидкой форме);
- во влажном воздухе концентрированные растворы HCl могут сильно дымиться;
- соляная кислота – вещество, обладающее резким запахом.
Химические свойства
Химические свойства хлорида водорода можно подразделить на общие (характерные для всех соединений, основным свойство которых является отдача протона) и специфические (характерные только для HCl). Общие свойства:
- Изменение окраски индикаторов за счет присутствия в растворе H + .
- Взаимодействует с металлами, стоящими до водорода в электрохимическом ряду напряжения металлов, с образованием газообразного водорода: Mg + 2HCL = MgCl2 + H2(газ).
- Взаимодействует с растворами щелочей – реакция нейтрализации (образование соли и воды посредством взаимодействия кислоты и основания): 2NaOH + 2HCl = H2O + 2NaCl.
- Реагирует с основными оксидами с образование соли и воды: MgO + 2HCL = H2O + MgCl.
- Реагирует с растворами солей (реакция обмена): 2HCL + Na2SO4 = H2SO4 + 2NaCl.
- Взаимодействует с большинством органических соединений (спирты, алкены, алкины, галогенпроизводные и так далее): CH2=CH2 + HCl = CH3-CH2-Cl.
Специфические свойства соляной кислоты:
- Реагирует нитратом серебра (качественная реакция): AgNO3: AgNO3 + HCl = AgCl (осадок белого цвета) + HNO3;
- Вступает в реакцию с сильными окислителями (оксид марганца, перманганат калия и другие): MnO2+4HCl=4Cl2+MnCl2+2H2O. Данная реакция протекает в условия нагревания.
Получение соляной кислоты
Промышленный способ получения хлористого водорода заключается в горении водорода в хлоре и последующим растворением образовавшегося вещества в воде. Существует и другой способ получения хлороводородной кислоты, применяемый в лабораторных условиях. Суть способа заключается в реакции поваренной соли(NaCl) с концентрированно серной кислотой при нагревании. В результате получаются следующие соединения: гидросульфат натрия и хлорид водорода, если провести химическое взаимодействие между образовавшимися продуктами, то образуется сульфат натрия и 2 молекулы хлористого водорода. Приведем общее уравнение реакции: 2NaCl + H2SO4 = Na2SO4 + 2HCl.
Области применения
Хлорид водорода является ключевым реагентом в химической промышленности, однако данное соединение нашло себе применение во многих отраслях человеческого деятельности.
В химической промышленности
В химической промышленности хлористый водород применяют для синтез хлорорганических соединений, а хлорсодержащих солей различных металлов.
В металлургии
В металлургии HCl используется с целью очистки металла после лужения (процесса нанесения олова с целью защиты металла от коррозии).
В пищевой промышленности
33% раствор HCl активно применяют в пищевом производстве в качестве регулятора pH, предназначенного для очистки воды.
В быту
В домохозяйстве HCl используют в составе моющих, хлорсодержащих средств.
В сельском хозяйстве
В сельскохозяйственной деятельности HCl применяется в составе хлорорганических веществ, которые используются в качестве органических ядохимикатов.
В медицине
В медицинской практике применяют слабые растворы хлористого водорода с целью улучшения пищеварения.
В строительстве
В строительстве HCl используют для очистки красного кирпича от грязи. Также использование растворов HCl повышает морозостойкость и влагостойкость бетонных конструкций, что способствует постройке более долгоживущих зданий.
Интересные факты
Приведем ряд фактов о хлороводородной кислоте, которые удивят обывателя:
- Хлористый водород способен полностью исправиться. Дело в том, что при высоких температурах соединение переходит в свое основное агрегатное состояние – газообразное и насыщает атмосферу молекулами хлора и водорода.
- Соляная кислота вырабатывается париетальными клетками желудка человеческого организма в небольшой концентрации (0,3%). Она создает необходимую кислотность среды, в которой наиболее активно протекают ферментативные процессы расщепления питательных веществ.
- При пониженной кислотности желудка, в нем развиваются лактобактерии. Данный факт указывает на еще одно свойство HCl – способность уничтожать бактерии. Данное свойство выражает в еще одной её функции в организме человека – бактерицидной.
Источник