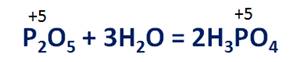- 1.4.6. Реакции ионного обмена.
- Типы химических реакций на примере свойств воды
- Урок 32. Химия 8 класс
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Типы химических реакций на примере свойств воды»
- Химические свойства воды
- Химические свойства воды
1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Как можно заметить из уравнения (2), что до реакции, что после в растворе находятся ионы NO3 − и K + . Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H + и OH − в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований (NH4OH и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Гидроксиду железа (III) соответствует в таблице растворимости обозначение «Н», что говорит нам о его нерастворимости, т.е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, NH4OH и H2SO3:
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
2) Для уравнения:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
3) для уравнения:
Молекулы воды и аммиака запишутся целиком, а NH4NO3, KNO3 и KOH запишутся в ионном виде , т.к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
Полное и сокращенное уравнение будут иметь вид:
2Na + + SO3 2- + 2H + + 2Cl − = 2Na + + 2Cl − + H2O + SO2 ↑
Источник
Типы химических реакций на примере свойств воды
Урок 32. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Типы химических реакций на примере свойств воды»
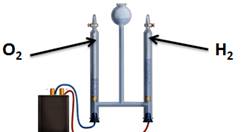
Для воды характерна реакция разложения – электролиз воды. Он протекает под действием электрического тока в специальном устройстве – электролизёре. В результате образуется два газа – кислород и водород.
2Н2О 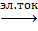
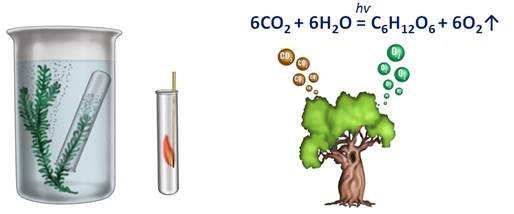
Растения также разлагают воду в процессе фотосинтеза.
Если веточку водного растения элодеи поместить в специальный прибор и выставить на яркий свет, то уже через 10-15 мин начнет выделяться кислород, в результате разложения воды на свету, т.е. происходит фотолиз воды (фотос – свет, лизос – разложение). Образовавшийся водород вместе с углекислым газом в результате биохимических реакций образует глюкозу. Совокупность всех этих реакций и называют процессом фотосинтеза. В результате фотосинтеза из углекислого газа и воды образуется глюкоза и кислород.
Для воды также характерны и реакции соединения. Если в фарфоровую чашечку поместить несколько кусочков негашеной извести, а затем прилить к ним немного воды, то когда вода впитается, над чашечкой появиться пар. Т.о. мы «погасили» негашеную известь водой. В результате этой реакции образуется новое вещество – гашеная известь.
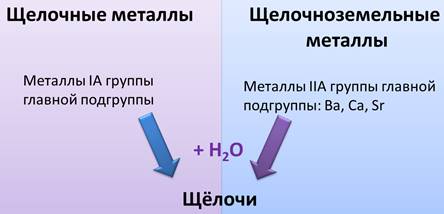
Все оксиды металлов I A группы главной подгруппы и металлы IIA группы: Ca, Ba, Sr при взаимодействии с водой образуют щёлочи. Поэтому металлы I A группы главной подгруппы называют щелочными металлами, а металлы II A группы, как Ba, Ca, Sr – щелочноземельными.
При взаимодействии с водой оксидов неметаллов будут образовываться соответствующие кислоты, где неметалл будет иметь туже степень окисления, как и в оксиде. Например, в реакции оксида фосфора (V) образуется фосфорная кислота, в которой степень окисления фосфора тоже +5.
Поэтому, основания и кислородсодержащие кислоты в химии называют гидроксидами.
Вода реагирует с оксидами металлов и неметаллов только в том случае, если образуется растворимый гидроксид. Например, с оксидом калия вода образует растворимое основание – гидроксид калия, а вот с оксидом меди (II) вода не реагирует, т.к. гидроксид меди (II) нерастворимое в воде основание. Аналогично и с оксидами неметаллов: вода реагирует с оксидом серы (VI) с образованием серной кислоты, а с оксидом кремния (IV) не реагирует, т.к. кремниевая кислота нерастворимая.
Реакции замещения идут тогда, когда с водой реагируют щелочные или щелочноземельные металлы. При взаимодействии натрия с водой образуется щёлочь и водород.
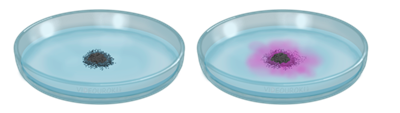
Эту реакцию можно наблюдать в следующем опыте: нальем в чашку Петри воды, добавим туда несколько капель фенолфталеина. Затем поместим маленький кусочек натрия. Кусочек натрия округляется, т.к. начинает плавиться из-за образования большого количества теплоты, «бегает» по поверхности воды, т.к. образующийся водород его выталкивает, раствор при этом окрашивается в малиновый цвет, из-за образования щёлочи.
Реакции обмена с участием воды – это реакции гидролиза. Если в таблице растворимости в клетке стоит прочерк, т.е. вещество в таком случае в водной среде гидролизуется (гидро – вода, лизос – разложение). Например, при гидролизе сульфида алюминия образуется гидроксид алюминия – нерастворимое в воде основание и газ – сероводород.
При гидролизе карбида кальция образуется газ – ацетилен и щелочь – гидроксид кальция. В этом легко убедиться, если воду добавить кусочек карбида кальция, то можно заметить выделение газа ацетилена, если в образовавшийся раствор капнуть несколько капель фенолфталеина, то он окрасится в малиновый цвет.
Гидролиз протекает и в живых организмах и составляет основу их жизнедеятельности, как гидролиз жиров и белков.
Поэтому вода не только самое важное вещество на планете, но и соединение, обладающее разнообразными химическими свойствами.
Источник
Химические свойства воды
Вода окружает нас повсюду, без неё человек не может жить. Мы на каждом шагу встречаемся с собственно водой и с водными растворами (например, морской водой или даже водопроводной). А может ли вода вступать в химические реакции и в каких случаях это происходит? Сейчас мы это и узнаем.
Химические свойства воды
1. Вода при высокой температуре или пропускании тока разлагается на газообразные водород кислород:
2. Вода взаимодействует с активными металлами с образованием гидроксидов и газообразного водорода. К активным металлам относятся металлы первой и второй групп таблицы Менделеева. С щелочными металлами (металлы первой группы) реакции идут довольно активно, поскольку газообразный водород выделяется бурно, поэтому проводить их нужно очень аккуратно. Уравнение реакции между щелочным металлом калием и водой выглядит так:
2К + 2Н2О = 2КОН + Н2
Аналогично протекают и реакции между щелочно-земельными металлами (металлами второй группы) и водой.
3. Вода взаимодействует с менее активными металлами с образованием оксидов и газообразного водорода. Например, цинк при взаимодействии с водой даёт оксид цинка и водород:
Zn + O2 = ZnO + H2
С инертными металлами (в ряду напряжений они стоят после водорода) вода не взаимодействует.
4. Вода взаимодействует с основными оксидами с образованием гидроксидов :
МgO + H2O = Mg(OH)2
5. Вода взаимодействует с кислотными оксидами с образованием кислот:
SO3 + H2O = H2SO4
А ещё воды является чуть ли не главным растворителем. В ней растворяются и газы, и жидкости и твёрдые вещества, причём в зависимости от условий можно получать самые разные растворы. С образованием растворов связано понятие массовой доли растворённого вещества . Понимать, как рассчитывать массовую долю растворённого вещества, очень важно, поскольку в неорганической химии много задач связано именно с этим.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник