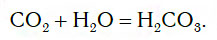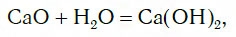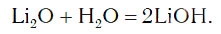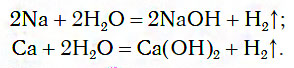- Химические реакции соединения с водой примеры
- Тема 33. Типы химических реакций на примере свойств воды.
- Урок 28. Химические свойства воды
- Взаимодействие с оксидами неметаллов
- Взаимодействие с оксидами металлов
- Взаимодействие с металлами
- § 34. Типы химических реакций на примере свойств воды
- Реакция разложения.
- Реакции соединения.
- Реакции замещения.
- Реакции обмена.
Химические реакции соединения с водой примеры
Тема 33. Типы химических реакций на примере свойств воды.
Часть I
1. Реакции разложения воды:
— под действием электрического тока называют электролизом;
— под действием света называют фотолизом.
Уравнение реакции: 2Н2О = 2Н2 + О2
2. Реакции соединения воды с оксидами:
металлов идут с образованием щелочей, например:
неметаллов идут с образованием кислоты, например:
3. Реакции замещения водорода в молекуле воды на металл идут с образованием щёлочи:
4. Реакции обмена — это реакции разложения веществ водой, или реакции гидролиза, например:
Часть II
1. «Химическим антонимом» реакции разложения воды является её синтез из соответствующих простых веществ. Напишите уравнение этого процесса:
2Н2 + О2=2Н2О
Придумайте и решите задачу, если известен объём одного из исходных веществ (н. у.), а требуется найти массу воды.
При взаимодействии 11,2 л углекислого газа с гидроксидом натрия, образовались соль и вода. Найти массу воды.
2. Запишите уравнения возможных реакций соединения с водой:
Распределите образовавшиеся гидроксиды на две группы.
3. Запишите уравнения реакций замещения с водой:
4. Запишите уравнения реакций гидролиза:
5. Запишите название продуктов гидролиза органических веществ, используя свои знания по теме «Пищеварительная система» из курса биологии.
1) Белки + вода→аминокислота.
2) Крахмал + вода→глюкоза.
3) Жиры + вода→глицерин + оксокислота.
6. Найдите массу фосфорной кислоты, которая образуется при растворении в воде 2,5 моль оксида фосфора (V).
7. Найдите массу щёлочи, которая образуется при растворении в воде 1,5 моль натрия.
Источник
Урок 28. Химические свойства воды
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.
При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).
При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):
Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
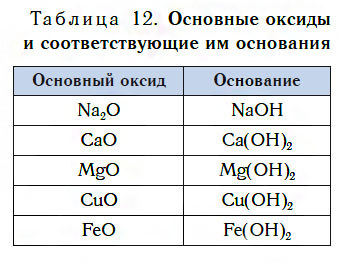
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
§ 34. Типы химических реакций на примере свойств воды
Вы уже познакомились с самым удивительным веществом на Земле — оксидом водорода, т. е. с водой Н2O.
Наша Родина занимает первое место в мире по запасам пресной воды — на территории России сосредоточена 1/5 её мировых ресурсов. Речной сток составляет 4270 км 3 в год, что соответствует 10% мирового речного стока, т. е. по 30 тысяч м 3 на каждого россиянина. Для сравнения укажем, что засушливые или полузасушливые регионы мира, которые составляют 40% суши, имеют только 2% мировых запасов пресной воды. За источники чистой воды в некоторых странах Азии и Африки идут настоящие войны. По прогнозам, к 2025 г. в странах, испытывающих умеренную или серьёзную нехватку воды, будут жить уже две трети населения планеты.
И хотя в России, кроме рек, сосредоточено также более 26 тысяч км 3 пресных вод в озёрах и существует 2000 водохранилищ, объём которых более 1 млн м 3 каждое, проблема загрязнения водоёмов и нехватки питьевой воды является одной из актуальных.
На примере химических свойств воды, этого важнейшего из веществ на нашей планете, повторим основные типы химических реакций по признаку «число и состав исходных веществ и продуктов реакции».
Реакция разложения.
С этой реакцией, которая протекает под действием постоянного электрического тока и называется электролизом, вы уже знакомились:
Растения разлагают воду на водород и кислород в процессе фотосинтеза. Если веточку водного растения элодеи поместить в прибор, изображённый на рисунке 112, и выставить на яркий солнечный свет, то уже через 10— 15 мин в верхней части пробирки соберётся кислород, который образовался в результате разложения воды на свету — фотолиза (фотос — свет, лизос — разложение). Как вы знаете из курса биологии, образовавшийся при этом водород с помощью многочисленных биохимических реакций образует с углекислым газом органическое вещество — глюкозу С6Н12O6. Совокупность всех этих процессов и называют фотосинтезом. Процесс фотосинтеза можно записать с помощью следующего обобщённого уравнения:
Реакции соединения.
Вы рассматривали этот тип реакций на свойстве воды соединяться с оксидами металлов и неметаллов с образованием соответственно щелочей и растворимых кислородсодержащих кислот.
Если в фарфоровую чашечку поместить несколько кусочков уже известной вам негашёной извести — оксида кальция СаО, а затем приливать к ним постепенно воду, давая ей впитываться, над чашкой появится пар. Кусочки оксида кальция начнут разогреваться и превратятся в пушистые хлопья или порошок нового вещества — гидроксида кальция, или гашёной извести (рис. 113):
Рис. 113.
Взаимодействие оксида кальция (негашёной извести) с водой
Теперь вам стало понятно, почему эту реакцию называют гашением извести.
Образуют щёлочи при взаимодействии с водой все оксиды металлов IA группы (главной подгруппы I группы) Периодической системы Д. И. Менделеева, поэтому эти элементы называют щелочными. Оксиды металлов главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева — кальция, стронция, бария (их в старину называли землями) — также образуют при взаимодействии с водой щёлочи. Поэтому эти элементы называют щёлочноземельными.
А вот оксиды неметаллов взаимодействуют с водой, образуя кислоты, в которых неметалл будет иметь ту же степень окисления, что и в соответствующем оксиде:
Теперь вам, очевидно, стало понятно, почему основания и кислородсодержащие кислоты называют в химии одним словом «гидроксиды».
| Гидроксидами называют кислородсодержащие кислоты и основания. |
Вам следует запомнить несложное правило: вода реагирует с оксидами металлов и оксидами неметаллов в том случае, если образуется растворимый гидроксид (щёлочь или кислородсодержащая кислота):
Реакции замещения.
Щелочные и щёлочноземельные металлы с водой могут образовывать щёлочи не только с помощью своих оксидов, но и при непосредственном взаимодействии. Только это будут уже реакции другого типа — реакции замещения, например:
Нальём в чашку Петри, находящуюся на столике кодоскопа, немного воды и добавим к ней несколько капель фенолфталеина. Затем поместим в сосуд кусочек очищенного натрия величиной со спичечную головку. На экране будет проецироваться происходящая при этом химическая реакция (рис. 114): кусочек натрия превращается в круглый шарик (плавится, так как реакция экзотермическая), бегает по поверхности воды (натрий легче воды и подталкивается образующимся в результате взаимодействия газообразным водородом), оставляя за собой малиновый след (это изменяет окраску фенолфталеина получившаяся в результате реакции щёлочь — гидроксид натрия).

Рис. 114. Взаимодействие натрия с водой
Реакции обмена.
Если вы обратите внимание на уже знакомую вам таблицу растворимости гидроксидов и солей в воде, то, очевидно, заметите, что в некоторых клетках этой таблицы стоят прочерки, которые обозначают, что данное вещество в водной среде разлагается, или, как говорят, гидролизуется (гидро — вода, лизос — разложение).
| Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. |
Гидролиз может быть обратимым (с ним вы будете знакомиться при изучении химии в старших классах) и необратимым. Например, необратимо гидролизуется сульфид алюминия:
Если в пробирку прилить на 1/3 её объёма дистиллированной воды, а затем поместить в неё кусочек карбида кальция СаС2 величиной с горошину, то можно заметить выделение газа — ацетилена С2Н2, а если затем в пробирку прилить раствор фенолфталеина, то появление малиновой окраски укажет на образование щёлочи — гидроксида кальция:
Гидролиз органических веществ — жиров, белков и углеводов, протекающий в живых организмах, — это основа их жизнедеятельности.
Следовательно, вода — не только самое важное вещество на Земле, но это и многоликое соединение, обладающее разнообразными химическими свойствами.
Ключевые слова и словосочетания
- Электролиз.
- Фотолиз.
- Фотосинтез.
- Щелочные и щёлочноземельные металлы.
- Гидроксиды (основания и кислородсодержащие кислоты).
- Условие взаимодействия оксидов металлов и неметаллов с водой.
- Гидролиз.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Закончите уравнения реакций, схемы которых:
Укажите типы реакций по признаку «число и состав исходных веществ и продуктов реакции». Назовите продукты реакций.
Укажите типы реакций по признаку числа и состава исходных веществ и продуктов реакции.
Источник