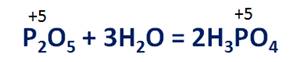- Химические реакции замещения с водой
- Тема 33. Типы химических реакций на примере свойств воды.
- Типы химических реакций на примере свойств воды
- Урок 32. Химия 8 класс
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Типы химических реакций на примере свойств воды»
- Химические свойства воды
- Химические свойства воды
- «Типы химических реакций на примере свойств воды».
Химические реакции замещения с водой
Тема 33. Типы химических реакций на примере свойств воды.
Часть I
1. Реакции разложения воды:
— под действием электрического тока называют электролизом;
— под действием света называют фотолизом.
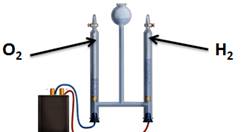
Уравнение реакции: 2Н2О = 2Н2 + О2
2. Реакции соединения воды с оксидами:
металлов идут с образованием щелочей, например:
неметаллов идут с образованием кислоты, например:
3. Реакции замещения водорода в молекуле воды на металл идут с образованием щёлочи:
4. Реакции обмена — это реакции разложения веществ водой, или реакции гидролиза, например:
Часть II
1. «Химическим антонимом» реакции разложения воды является её синтез из соответствующих простых веществ. Напишите уравнение этого процесса:
2Н2 + О2=2Н2О
Придумайте и решите задачу, если известен объём одного из исходных веществ (н. у.), а требуется найти массу воды.
При взаимодействии 11,2 л углекислого газа с гидроксидом натрия, образовались соль и вода. Найти массу воды.
2. Запишите уравнения возможных реакций соединения с водой:
Распределите образовавшиеся гидроксиды на две группы.
3. Запишите уравнения реакций замещения с водой:
4. Запишите уравнения реакций гидролиза:
5. Запишите название продуктов гидролиза органических веществ, используя свои знания по теме «Пищеварительная система» из курса биологии.
1) Белки + вода→аминокислота.
2) Крахмал + вода→глюкоза.
3) Жиры + вода→глицерин + оксокислота.
6. Найдите массу фосфорной кислоты, которая образуется при растворении в воде 2,5 моль оксида фосфора (V).
7. Найдите массу щёлочи, которая образуется при растворении в воде 1,5 моль натрия.
Источник
Типы химических реакций на примере свойств воды
Урок 32. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Типы химических реакций на примере свойств воды»
Для воды характерна реакция разложения – электролиз воды. Он протекает под действием электрического тока в специальном устройстве – электролизёре. В результате образуется два газа – кислород и водород.
2Н2О 
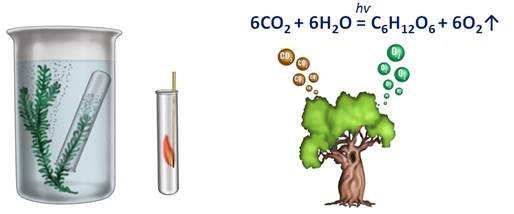
Растения также разлагают воду в процессе фотосинтеза.
Если веточку водного растения элодеи поместить в специальный прибор и выставить на яркий свет, то уже через 10-15 мин начнет выделяться кислород, в результате разложения воды на свету, т.е. происходит фотолиз воды (фотос – свет, лизос – разложение). Образовавшийся водород вместе с углекислым газом в результате биохимических реакций образует глюкозу. Совокупность всех этих реакций и называют процессом фотосинтеза. В результате фотосинтеза из углекислого газа и воды образуется глюкоза и кислород.
Для воды также характерны и реакции соединения. Если в фарфоровую чашечку поместить несколько кусочков негашеной извести, а затем прилить к ним немного воды, то когда вода впитается, над чашечкой появиться пар. Т.о. мы «погасили» негашеную известь водой. В результате этой реакции образуется новое вещество – гашеная известь.
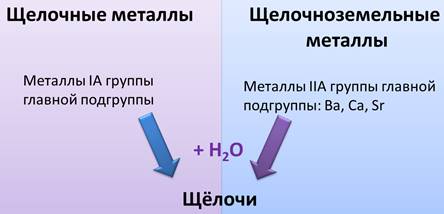
Все оксиды металлов I A группы главной подгруппы и металлы IIA группы: Ca, Ba, Sr при взаимодействии с водой образуют щёлочи. Поэтому металлы I A группы главной подгруппы называют щелочными металлами, а металлы II A группы, как Ba, Ca, Sr – щелочноземельными.
При взаимодействии с водой оксидов неметаллов будут образовываться соответствующие кислоты, где неметалл будет иметь туже степень окисления, как и в оксиде. Например, в реакции оксида фосфора (V) образуется фосфорная кислота, в которой степень окисления фосфора тоже +5.
Поэтому, основания и кислородсодержащие кислоты в химии называют гидроксидами.
Вода реагирует с оксидами металлов и неметаллов только в том случае, если образуется растворимый гидроксид. Например, с оксидом калия вода образует растворимое основание – гидроксид калия, а вот с оксидом меди (II) вода не реагирует, т.к. гидроксид меди (II) нерастворимое в воде основание. Аналогично и с оксидами неметаллов: вода реагирует с оксидом серы (VI) с образованием серной кислоты, а с оксидом кремния (IV) не реагирует, т.к. кремниевая кислота нерастворимая.
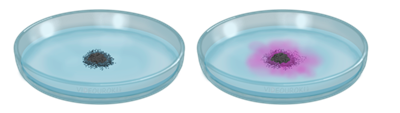
Реакции замещения идут тогда, когда с водой реагируют щелочные или щелочноземельные металлы. При взаимодействии натрия с водой образуется щёлочь и водород.
Эту реакцию можно наблюдать в следующем опыте: нальем в чашку Петри воды, добавим туда несколько капель фенолфталеина. Затем поместим маленький кусочек натрия. Кусочек натрия округляется, т.к. начинает плавиться из-за образования большого количества теплоты, «бегает» по поверхности воды, т.к. образующийся водород его выталкивает, раствор при этом окрашивается в малиновый цвет, из-за образования щёлочи.
Реакции обмена с участием воды – это реакции гидролиза. Если в таблице растворимости в клетке стоит прочерк, т.е. вещество в таком случае в водной среде гидролизуется (гидро – вода, лизос – разложение). Например, при гидролизе сульфида алюминия образуется гидроксид алюминия – нерастворимое в воде основание и газ – сероводород.
При гидролизе карбида кальция образуется газ – ацетилен и щелочь – гидроксид кальция. В этом легко убедиться, если воду добавить кусочек карбида кальция, то можно заметить выделение газа ацетилена, если в образовавшийся раствор капнуть несколько капель фенолфталеина, то он окрасится в малиновый цвет.
Гидролиз протекает и в живых организмах и составляет основу их жизнедеятельности, как гидролиз жиров и белков.
Поэтому вода не только самое важное вещество на планете, но и соединение, обладающее разнообразными химическими свойствами.
Источник
Химические свойства воды
Вода окружает нас повсюду, без неё человек не может жить. Мы на каждом шагу встречаемся с собственно водой и с водными растворами (например, морской водой или даже водопроводной). А может ли вода вступать в химические реакции и в каких случаях это происходит? Сейчас мы это и узнаем.
Химические свойства воды
1. Вода при высокой температуре или пропускании тока разлагается на газообразные водород кислород:
2. Вода взаимодействует с активными металлами с образованием гидроксидов и газообразного водорода. К активным металлам относятся металлы первой и второй групп таблицы Менделеева. С щелочными металлами (металлы первой группы) реакции идут довольно активно, поскольку газообразный водород выделяется бурно, поэтому проводить их нужно очень аккуратно. Уравнение реакции между щелочным металлом калием и водой выглядит так:
2К + 2Н2О = 2КОН + Н2
Аналогично протекают и реакции между щелочно-земельными металлами (металлами второй группы) и водой.
3. Вода взаимодействует с менее активными металлами с образованием оксидов и газообразного водорода. Например, цинк при взаимодействии с водой даёт оксид цинка и водород:
Zn + O2 = ZnO + H2
С инертными металлами (в ряду напряжений они стоят после водорода) вода не взаимодействует.
4. Вода взаимодействует с основными оксидами с образованием гидроксидов :
МgO + H2O = Mg(OH)2
5. Вода взаимодействует с кислотными оксидами с образованием кислот:
SO3 + H2O = H2SO4
А ещё воды является чуть ли не главным растворителем. В ней растворяются и газы, и жидкости и твёрдые вещества, причём в зависимости от условий можно получать самые разные растворы. С образованием растворов связано понятие массовой доли растворённого вещества . Понимать, как рассчитывать массовую долю растворённого вещества, очень важно, поскольку в неорганической химии много задач связано именно с этим.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
«Типы химических реакций на примере свойств воды».
Методическая разработка урока по химии
«Типы химических реакций на примере свойств воды». 8 класс.
Цель урока: Создать условия для систематизации и обобщения знаний учащихся об основных типах химических реакций на примере свойств воды.
Учебные задачи, направленные на развитие учащихся:
— В личностном направлении: способствовать формированию мотивации учебной деятельности учащихся; развивать интерес учащихся к изучаемому предмету; развивать рефлексивные умения (самооценка и самопознание).
— В метапредметном направлении: развивать умение анализировать информацию при работе с учебником и карточками; организовать применение учащимися полученных знаний в процессе самостоятельной работы; применять полученные знания при объяснении процессов из жизни;
развивать коммуникативные компетенции учащихся (умение точно и правильно выражать свои мысли, работать в сотрудничестве, слушать собеседника).
— В предметном направлении: совершенствовать знания, умения и навыки учащихся по теме «Типы химических реакций на примере свойств воды»; наблюдать и описывать химические реакции с помощью родного языка и языка химии; классифицировать изучаемые вещества по составу и свойствам.
Тип урока: урок систематизации и обобщения знаний и умений.
Формы работы учащихся: групповая и индивидуальная.
Техническое обеспечение : таблица «Периодическая система химических элементов Д. И. Менделеева», «Таблица растворимости кислот, оснований и солей», рабочая тетрадь , инструкции с заданиями, лист самоконтроля, мультимедийный проектор, компьютер, экран, презентация, видеофрагменты «Типы химических реакций Кирилл и Мефодий»
Структура и ход урока
Дидактические этапы с дозировкой времени :
Организационный этап – 1 мин.
Этап проверки домашнего задания -8 мин.
Этап изучения нового материала -25 мин.
Закрепление материала -10 мин.
Домашнее задание -1 мин.
Друзья мои! Я очень рада войти в приветливый ваш класс.
И для меня уже награда сиянье ваших добрых глаз. Ребята, проверьте все ли готово у вас к уроку: листы с заданием ( Приложение 1 ), инструкции для выполнения лабораторной работы (Приложение 2 ) , лотки с демонстрационным материалом, оценочный лист, в который вы будите вносить баллы за каждый вид деятельности на уроке. ( Приложение 3 ) , Так как обучающиеся с повышенной моторной активностью, поэтому вспоминаются советы учителя о том, как лучше организовать работу на уроке, чтобы сохранить свое здоровье и здоровье одноклассников.
Промежуточный контроль знаний.
Цель: определять тип химических реакций и продолжить формировать эти умения в случае недостаточной сформированности
На прошлом уроке вы изучили типы реакций по числу и составу исходных
веществ и продуктов реакции. Какие существуют типы химических реакций?
Ответ детей: соединение, разложение, замещение, обмена.
Дайте им определение.
Выполните тест «Типы химических реакций». Проведите взаимопроверку.
Баллы поставьте в оценочный лист. (Ответы на доске).
1.Стадия вызова направлена на организацию работы по теме, вызов интереса, демонстрация первичных знаний через устную речь.
Активизация познавательной деятельности (проблемная ситуация)
Звучит музыка «Живая вода», на экране картины природы. (слайд №2-3 )
Перед вами черный ящик. Ваша задача догадаться о каком веществе идет речь. У него есть свой день в календаре 22 марта. – Его оксид -самое распространенное вещество на нашей Земле. — Про него писатель Антуан де Сент- Экзепюри говорил, что у него нет ни вкуса, ни цвета, ни запаха, и оно является самым удивительным веществом.
Действительно в ящике – вода.
Ну и при чем тут вода, если мы изучаем типы химических реакций?
Ответы учащихся: Значит мы будем изучать типы химических реакций на примере свойств воды.
На доске: «Типы химических реакций на примере свойств воды» (слайд №5)
Давайте с формулируем цели урока.
Цель: определить характерны ли для воды, те типы реакций, которые мы изучили (разложения, соединения, замещения, обмена). (слайд №6 )
1.Физические свойства. (слайд №7)
Что вам известно о воде? А какими физическими свойствами она обладает?
Возможные ответы учащихся: вода – самое распространенное вещество на Земле, основа клетки, может находиться в трех агрегатных состояниях, универсальный растворитель, в растворах протекает большинство химических реакций, сильно загрязняется человеком, запасы ее на Земле ограничены…
Какое строение имеет молекула воды? Ответы: Формула воды – Н 2 О, это соединение, состоящее из двух атомов водорода и одного атома кислорода, соединенных ковалентной полярной связью (Н – О- Н). К какому классу соединений относится вода? Ответы: (оксиды)
Вообще вода -это уникальное соединение. Послушайте доклад вашего одноклассника « Самое удивительное вещество на нашей планете- H 2 O » и составьте конспект доклада в объеме пяти предложений. (слайд №8)
Источник