- Химия, Биология, подготовка к ГИА и ЕГЭ
- №80 Ртуть
- История открытия:
- Получение:
- Физические свойства:
- Химические свойства:
- Важнейшие соединения:
- Применение:
- О ртути
- Ртуть: общие понятия
- Химические свойства ртути
- Физические свойства ртути
- Воздействие ртути на человека и животных
- Мнение эксперта:
- Алена Парецкая, врач — педиатр
- Пролитая ртуть: как с ней бороться
- ОЧЕНЬ ВАЖНО!
- Ртуть
- Что такое ртуть
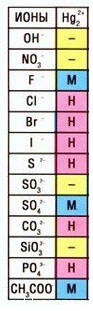
- Соли ртути
- Получение ртути
- Амальгама
- hg Меркурий или Ртуть
- Применение ртути
- Химические свойства ртути
- Похожие страницы:
- Leave a Comment Отменить ответ
Химия, Биология, подготовка к ГИА и ЕГЭ
Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии
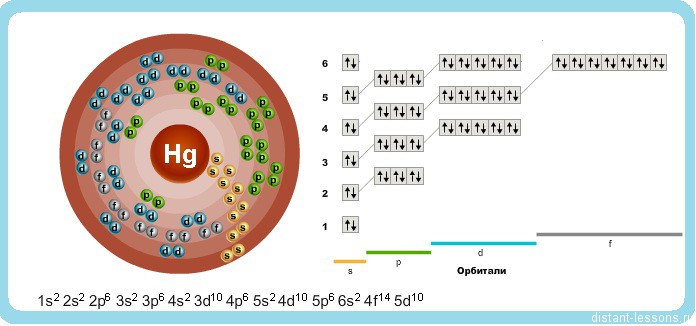
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1.
Физические свойства ртути:
- при комнатной температуре — сербристо-серая жидкость , легко переходящая в газообразное состояние ;
- электро- и теплопроводна;
- очень высокая плотность вещества;
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии.
Химические свойства ртути:
1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета);
2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути;
3) C неметаллами ( при нагревании): Hg + S = HgS
4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует
В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется:
Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде:
Степень окисления
Соединения ртути
+1
Оксид — не выделен;
Гидроксид — не выделен
Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2
Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости:
+2
Оксид — HgO (относят к слабым основным или даже амфотерным оксидам);Гидроксид — не выделен
Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная.
Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей
Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей).
- Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
Источник
№80 Ртуть
История открытия:
Ртуть известна с древнейших времен. Её находили в самородном виде (жидкие капли ртути в горных породах), получали при обжиге минералов, природных соединений ртути. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 г., ее металлические свойства (ковкость, электропроводность и др.) были доказаны трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть.
Русское название ртути происходит от праслав. *rьtоtь, связанного с лит. risti — «катиться». Латинское алхимическое название этого элемента Hydrargyrum происходит от др.-греч. слов «вода» и «серебро».
Получение:
Ртуть считается редким металлом (содержание в земной коре 8,3*10 -6 %). Хотя известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В России известно 23 месторождения ртути. Ртуть получают обжигом киновари (сульфида ртути(II)) HgS + O2 = Hg + SO2
или ее металлотермическим восстановлением: HgS + Fe = Hg + FeS
Образующиеся при этом пары ртути конденсируют и собирают. Эти способы применяли ещё алхимики древности.
Физические свойства:
Ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления 234,32 K (-38,83°C), температура кипения 630K (357°C). Плотность (13,55 г/см 3 ). Обладает высокой электропроводностью. Характерной особенностью ртути является ее способность растворять многие металлы, образует с ними жидкие и твёрдые сплавы — амальгамы.
Химические свойства:
При комнатной температуре не взаимодействует с кислородом, водой, растворами щелочей. При нагревании на воздухе при температуре около 300°C ртуть окисляется до оксида HgO, но при более высоких температурах оксид неустойчив и реакция не идет.
Растворяется в азотной кислоте, образуя нитрат ртути(I) Hg2(NO3)2 или ртути(II) Hg(NO3)2; растворение в царской водке идет с образованием комплексов: 3Hg + 2HNO3 + 12HCl -> 3H2[HgCl4] + 2NO +4H2O
В соединениях проявляет степень окисления +1 (образуя кластерный катион Hg2 2+ ) или +2.
Важнейшие соединения:
Соединения ртути(I) в большинстве неустойчивы, легко окисляются, восстанавливаются и диспропорционируют:
Оксид ртути(I), Hg2O, черный порошок, неустойчив, легко разлагается под действ. тепла или света, не растворим.
Нитрат ртути(I), Hg2(NO3)2, бесцветные кристаллы, растворим, гидролизуется по катиону.
Сульфат ртути(I), Hg2SO4, желто-белые кристаллы, нерастворим, образует кристаллогидрат Hg2SO4*2H2O.
Хлорид ртути(I), «каломель», Hg2Cl2 — бесцветные кристаллы, нерастворим.
Оксид ртути(II), HgO, существует в красной или желтой модификации, основной оксид, растворяясь в кислотах образует соли ртути(II), с водой не реагирует. При нагревании выше 300°C разлагается.
Нитрат ртути(II), Hg(NO3)2, бесцветные кристаллы, растворим, гидролизуется по катиону.
Хлорид ртути(II), «сулема», HgCl2 — бесцветные кристаллы, хорошо растворим.
Йодид ртути(II), HgI2 — ярко-красное вещество, нерастворимо в воде, но растворимо в избытке раствора KI? образуя комплексное соединение: HgI2 + 2KI = K2[HgI4].
Щелочной раствор этого комплексного соединения используется в аналитической химии для обнаружения аммиака и ионов аммония («реактив Несслера«): K2[HgI4] + NH3 + 3KOH = [Hg2N]I*H2O + 7 KI + 2H2O (образуется желтый осадок)
Применение:
Металлическая ртуть является незаменимой во многих технических и научно-исследовательских приборах (кварцевых лампах, ртутно-паровых выпрямителях, в реле, в регуляторах давления, для изготовления термометров).
В большом количестве ртуть используется при получении щелочей и хлора (электролиз раствора NaCl с ртутным катодом), в амальгамной металлургии, для извлечения металлов из руд, их очистки, получения сплавов. В лабораторных условиях амальгама натрия находит применение в качестве восстановителя.
Многие соединения ртути используются в медицине, как антисептики и лекарства.
Сама ртуть, ее пары, практически все соединения, особенно хорошо растворимые, чрезвычайно ядовиты.
Источник
О ртути
Ртуть: общие понятия
Консультация оперативного дежурного: +7(812)309-13-43
Химические свойства ртути
Ртуть – единственный из всех существующих в природе металлов, который остается жидким при комнатной температуре. В этих условиях на воздухе она не окисляется, в воде и щелочах не растворяется. Растворяется в холодной азотной кислоте и нагретой концентрированной серной. В обычных условиях активно испаряется, и скорость этого процесса прямо пропорциональна температуре и площади поверхности испарения. Пары ртути не имеют ни запаха, ни цвета, обнаружить их в воздухе можно только с помощью специальных приборов
Физические свойства ртути
Для ртути характерны низкая вязкость и высокое поверхностное натяжение. Эти свойства становятся причиной двух негативных с точки зрения ртутного загрязнения среды процессов:
- не ограниченная сосудом ртуть легко разделяется на мелкие шарики, тем самым резко увеличивая свою поверхность испарения;
- капли ртути очень подвижны и легко проникают в труднодоступные места, затрудняя их удаление.
Пары ртути отличает очень высокая летучесть, и слой воды или иной жидкости не представляет для них реальной преграды. То же самое можно сказать и о многих строительных материалах, таких как бетон, кирпич, лакокрасочное покрытие, линолеум или плитка. Ртутные пары равномерно пропитывают их на всю толщину, а также легко сорбируются из воздуха деревом, коврами и тканями. При повышении температуры или при механическом воздействии происходит обратная десорбция ртути в воздух помещения.
Чистая металлическая ртуть хорошо растворяет многие металлы, снижая тем самым прочность металлических конструкций, и образует непрочные соединения как с неорганическими, так и с органическими веществами.
Воздействие ртути на человека и животных
Для всего живого ртуть и ее соединения – это сильнейший яд, который может вызвать:
- общее отравление;
- угнетение половых желез;
- интоксикацию зародышей;
- пороки развития и уродства;
- мутацию генов, при которой дефекты становятся наследственными.
Основные пути попадания ртути в организм – это вдыхание ее паров с воздухом либо употребление с пищей или водой. Организм человека выводит не более 20% попавшей в него ртути, и она накапливается в почках и мозге, поражает плод, если женщина беременна, содержится в крови и грудном молоке. При концентрации паров ртути более 0,1 мг/м3 наступает острое отравление, признаки которого:
- возбуждение/угнетение центральной нервной системы (ЦНС);
- резкое снижение кровяного давления;
- поражение слизистых дыхательного и пищеварительного трактов;
- изменения формулы крови;
- повышенное содержание ртути в моче;
- тяжелое поражение почек;
- бронхит или даже пневмония.
Следствием длительного воздействия малых доз ртути является хроническое отравление, которое может проявиться с задержкой на несколько лет. Все это время в организме накапливаются необратимые нарушения с такими внешними признаками:
- общее недомогание;
- проблемы с пищеварением – потеря аппетита, поносы;
- проблемы с ЦНС – апатия, ртутная неврастения, головные боли, бессонница, повышенная психическая возбудимость, нарушение памяти;
- астеновегетативный синдром – тахикардия, неустойчивый пульс, ртутный тремор языка, век, конечностей и всего тела.
Мнение эксперта:
Алена Парецкая, врач — педиатр
Пролитая ртуть: как с ней бороться
Существуют как природные (месторождения), так и техногенные (места добычи, горнорудные и предприятия цветной металлургии, специальные полигоны-хранилища, отходы сжигания нефтепродуктов и т. д.) источники ртути, загрязняющей воздух, воду и почву. Бытовые и производственные помещения загрязняются ртутью при неправильной эксплуатации ртутных приборов и устройств, таких как термометры, манометры, выпрямители электрического тока. Статистика утверждает, что 80% всех работ МЧС в Санкт-Петербурге источники паров ртути. Если не принимать во внимание злоумышленные проливы ртути, то наиболее частая причина их существования – разбитый ртутный термометр и преступно халатное отношение к последствиям этого события
Ликвидация розлива ртути: +7(812)309-13-43
ОЧЕНЬ ВАЖНО!
Если у Вас в семье есть ребёнок, заранее объясните ему, что если он нечаянно
разобьёт термометр, его никто не будет за это ругать. В противном случае ваше чадо, испугавшись наказания за разбитый градусник, спрячет его остатки куда-нибудь под кровать или шкаф и ничего Вам не скажет – в итоге вся Ваша семья долгое время будет дышать ядовитыми парами ртути.
При прохождении теста нужно помнить: Предельно допустимая концентрация ртути 300нг/м3
Источник
Ртуть
Ртуть это уникальный металл который в нормальных условиях остается в жидком состоянии (расплавленном), известен с давних времен так как встречается в свободном состоянии и называется (меркурий), практически все соединения токсичны и ядовиты. Практическое применение его широко из за его свойств.
Что такое ртуть
(Hydrargyrum), Hg — хим. элемент II группы периодической системы элементов; ат. н. 80, ат. м. 200,59. Серебристо-белый жидкий металл. В соединениях проявляет степени окисления +1 и +2. Природная ртуть состоит из стабильных изотопов 198Hg, 198Hg, 199Hg, 200 Hg, 201Hg, 202Hg и 204Hg. Получены 18 радиоактивных изотопов, из которых наибольшее практическое значение имеют изотопы 203Hg и 205Hg с периодами полураспада соответственно 47 дней и 5,1 мин.
Ртуть и ее соединения известны с древнейших времен. Содержание Р. в земной коре 8,3 х 10-6. Известно около 30 минералов Р., включая ртуть самородную и амальгамы различных металлов. Некоторые из минералов (киноварь HgS, ее разновидность метациннабарит, ливингстонит HgS х 2Sb2S3 и тиманнит HgTe) встречаются в сравнительно больших количествах и являются источником пром. добычи металла.
Кристаллическая решетка Р. ромбоэдрическая, расстояние между атомами, равное постоянной решетки простейшего ромбоэдра, 2,999 А. Атомный радиус 1,60 А, ионный радиус Hg+ равен 1,12 А. Р.— единственный металл, к-рый остается жидким при низких т-рах (вплоть до т-ры — 38,87° С).
Потенциалы ионизации Hg° → Hg+ → Hg2+ Hg3+ → Н4+ составляют соответственно 10,41; 18,55; 32,43 и 45,98 в. Плотность при т-рах 0 и 20° С равна соответственно 13,5951 и 13,5459 г/см3; t кип 356,58° С; температурный коэфф. объемного расширения твердой Р. в интервале т-р от —89,9 до —39,5° С изменяется от 12,5 х 10-5 до 17,1 х 10 -5 град-1; температурный коэфф. объемного расширения жидкой Р. в интервале т-р от —38,87 до 350° С изменяется от 1,823 х 10-4 до 1,889 х 10-4 град-1; теплоемкость (кал/г- град): 0,0339 (т-ра —38,87° С); 0,03353 (т-ра 0° С); 0,03334 (т-ра 20° С); 0,03275 (т-ра 100° С) и 0,0324 (т-ра 350° С); удельное электрическое сопротивление (т-ры —30; 0 и 20° С) равно соответственно 0,91700; 0,94123 и 0,95833 ом-см. Металлическая Р. диамагнитна. Вязкость жидкой Р. (т-ра 20° С) 0,01544 г/см-сек, поверхностное натяжение 480 дин/см.
Ртутный пар при низких т-рах состоит в основном из атомов, с повышением т-ры степень ассоциации увеличивается, а при критической т-ре он почти целиком состоит из двухатомных молекул. Давление насыщенных паров Р. (мм рт-ст.): 1,447 х 10-8 (т-ра —70° С); 2,046 х 10 -4 (т-ра 0° С);1,2979 х 10 -3 (т-ра 20° С) и 1,3394 х 10-2 (т-ра 50° С). Твердую Р.,как и свинец, можно ковать, протягивать через фильеры, резать ножом и т. д. Твердость по Моосу замерзшей Р.— 1,5.
Сжимаемость жидкой Р. (т-ра 30° С, давление от 1 до 50 бар) 4,051 х 10 -6 бар , коэфф. сжимаемости твердой альфа-ртути (т-ра —73° С, норм, давление) 3,52 X 10 ат-1. При невысоких т-рах Р. инертна ко многим агрессивным жидкостям и газам, включая кислород воздуха. Она практически не взаимодействует с концентрированной серной и соляной к-тами, но хорошо растворяется в азотной к-те, «царской водке», в горячей концентрированной серной к-те.
При нагревании на воздухе окисляется. Если в Р. есть примеси свинца, цинка, меди, кадмия и др., поверхность ее покрывается серой пленкой окислов. С кислородом Р. образует окись HgO, имеющую красную и желтую кристаллические модификации, с галогенами — соединения типа Hg2Г2 и HgГ2 (где Г — фтор, хлор, бром и йод).
Наибольшее значение имеют хлориды ртути: Hg2Cl2 — каломель — белые кристаллы, мало растворимые в воде, а также HgCl2 — сулема — бесцветные кристаллы, растворимые в воде. При взаимодействии Р. с серой образуется сульфид HgS, известный в трех модификациях: альфа-киноварь — красная, метациннабарит — черная и бета-киноварь. Метациннабарит и бета-киноварь неустойчивы и со временем переходят в обыкновенную киноварь.
Соли ртути

Растворением окиси HgO в растворе синильной к-ты, а также взаимодействием щелочного цианида и соли двухвалентной Р. получают бесцветные кристаллы цианида Hg(CN)2. При нагревании смеси Р., концентрированной азотной к-ты и спирта образуется цианат Hg(CNO)2 — гремучая ртуть — белые кристаллы, взрывающиеся при ударе. Взаимодействуя с металлами, Р. образует амальгамы.
Известно большое количество ртуть-органических соединений, в к-рых атомы Р. непосредственно связаны с атомами углерода. Эти соединения находят применение в органическом синтезе при получении элементоорганических соединений.
Получение ртути
В пром-сти металлическую Р. получают гл. обр. пирометаллургическим способом — окислительным обжигом ртутных руд или их концентратов при т-ре 700— 800° С в пламенных, трубчатых, многоподовых и муфельных печах, а также в печах кипящего слоя. При обжиге руды, содержащей, напр., киноварь, Р. восстанавливается до металла, и ее пары вместе с сернистым газом, образующимся при разложении сульфида, попадают в конденсационную систему, где смесь газов охлаждается, пары Р. конденсируются и Р. стекает в приемники.
Для получения металла гидрометаллургическим способом сырье, содержащее Р. в виде сульфида, вначале обрабатывают водным раствором сульфида натрия и едкого натра. Получающийся при этом водный раствор соединения HgS х Na2S цементируют алюминием или подвергают электролизу; выделившуюся Р. фильтруют и затем перегоняют в вакууме. Весьма перспективен способ получения Р., основанный на обжиге ртутного сырья в вакууме.
Ртуть высоких марок чистоты, а также сверхчистая Р. может быть получена при комплексном использовании спец. хим. очистки, перегонки под пониженным давлением воздуха, электролитическим рафинированием в электролизерах с биполярными электродами и последующим перегревом паров Р. выше т-ры 1000° С. Металлическую Р. используют в химии, металлургии, энергетике, электро- и радиотехнике, в приборостроении, строительном деле и др. В хим. пром-сти ртутные катоды применяют для электрохим. получения едкого натра и хлора, а также многочисленных органических соединений.
Амальгама
Способность ртути образовывать амальгамы используют для комплексной переработки полиметаллического сырья методами амальгамной металлургии, для получения высокодисперсных металлических порошков, многокомпонентных сплавов заданных составов, чистых и сверхчистых металлов, содержание примесей в к-рых не превышает 10—6—10-8%. В энергетике Р. используют как рабочее тело в мощных бинарных установках пром. типа, где для генерации Электр, энергии на первых ступенях применяют ртутно-паровые турбины, а на второй — турбины, работающие на водяном паре.
Кроме того, Р. используют в ядерных реакторах для отвода тепла. Пары Р. применяют в люминесцентных лампах дневного света, а также в ртутных кварцевых лампах низкого, высокого и сверхвысокого давления. Помимо этого, пары Р. используют в газотронах, газонаполненных тиратронах и триодах. Особенно широко используют Р. в вакуумной технике.
Ртутные диффузионные насосы незаменимы при получении сверхвысокого (порядка 10-13 мм рт. ст.) вакуума. В лабораторной практике Р. применяют в барометрах, манометрах, вакуумметрах, термометрах, затворах, прерывателях, высоковакуумных насосах, всевозможных реле, терморегулирующих устройствах.
Ее используют в качестве балластной, термостатирую-щей и уплотняющей жидкости. Р. нашла применение в полярографическом анализе. Ртуть и амальгамы используют при амперометрическом и потенциометрическом титровании, кулонометрическом анализе. С помощью Р. определяют пористость материалов.
Р. применяют также для точной калибровки мерной посуды, для определения диаметров капиллярных трубок. Широкое применение находят также соединения Р.: напр.,окись HgO используют в качестве окислителя, для изготовления красок; искусственный сульфид HgS — составная часть люминофоров на основе сульфида кадмия и катализаторов в органическом синтезе.
hg Меркурий или Ртуть
Единственный металл , находящийся при обычной температуре в жидком состоянии (температура плавления ртути -38,8°C ) . Она имеет белый цвет и обладает меньшей восстановительной активностью чем цинк . В ряду напряжений ртуть расположена правее водорода , то есть не вытесняет не вытесняет его из воды и кислот .
Радиус атома ртути почти равен радиусу атому кадмия , а заряд ядра атома значительно больше , поэтому электроны внешнего слоя удерживаются ртутью значительно прочнее .
Природная ртуть состоит из смеси семи изотопов : 196Hg ( распространён 0,155% ) , 198Hg ( 10,04% ) , 199Hg ( 16,94% ) , 200Hg ( 23,14% ) , 201Hg ( 13,17% ) , 202Hg ( 29,74% ) , 204Hg ( 6,82% ) , так же были получены радиоактивные изотопы ртути с массовыми числами 171—210.
Ртуть легко образует с другими металлами сплавы , которые называются амальгамами , например с натрий Na , калий K , серебро Ag , золото Au , платина Pt , цинк Zn , кадмий Cd , олово Sn , свинец Pb образуя с ними жидкие и твердые сплавы.
В недавнем прошлом с помощью ртути получали золото , серебро , а реакции называется амальгамация золота и амальгамация серебра . Также на этой основе лежит покрытие металлических предметов золотом.
Hg химически малоактивна и на воздухе без изменений может хранится длительное время . Однако при длительном слабом нагревании может окислятся , образуя окись ртути :
При растирании в ступке ртуть очень легко взаимодействует с серой , образуя сульфид ртути ( II ) чёрного цвета :
С водой ртуть в реакцию не вступает , но хорошо реагирует с азотной кислотой и концентрированной серной кислотой , обладающие сильными окисляющими действиями . при этом в зависимости от того , при какой температуре ведётся реакция , образуются соли как одновалентные , так и двухвалентной ртути . Соединения как одновалентной , так и двухвалентной ртути достаточно устойчивы , хотя и могут превращаться друг в друга.
Ртуть сильно ядовита , которая даже при комнатной температуре легко испаряется и может вызвать тяжёлые отравления , оказывающие сильное влияние на сердце . При попадании соединений ртути внутрь возникает расстройство деятельности органов пищеварения и почек . Очень ядовиты и соединения ртути , такие как сулема.
Применение ртути
В промышленности применяется она как металл так и некоторые его соли . Металлическую ртуть используют при изготовлении термометров , барометров , в некоторых измерительных приборах , а также при добыче золота для его очистке от примесей , так как ртуть легко образует амальгамы с золотом и другими некоторыми благородными металлами . Так же использовалась в зубоврачебной практике для изготовления пломб.
Применение в медицине в качестве добавления в крема для борьбы со вшами.
Соли ртути также находят некоторое применение такие как сулема HgCl2 используется как дезинфицирующее средство но в последнее время предпочтение другим дез. средствам , каломель Hg2Cl2 ( Cl — Hg — Hg — Cl ) применялось как лёгкое слабительное.
В природе ртуть встречается изредка в самородном жидком состоянии , но в виде соединений , например киновари HgS . Для получения из неё ртути киноварь сначала обжигают :
а затем полученную окись ртути HgO разлагают нагреванием :
Обычно обе реакции протекают одновременно в едином процессе , такими же свойствами обладает оксид серебра при нагревании он восстанавливается до свободного состояния.
Химические свойства ртути
Ртуть при обычных условиях существует в жидком состоянии . Вступает в сплав с другими металлами образуя амальгаму . Жидкая ртуть устойчива на воздухе и в воде , хотя и не покрыта защитной оксидной плёнкой . Эти свойства ртути находятся в соответствии с её высокой ионизационным потенциалом .
Hg , стоящая в ряду напряжений правее водорода , растворяется только в концентрированной азотной и горячей концентрированной серной кислотах , образуя соответствующие соли :
При действии на избыток ртути разбавленной азотной кислоты образуется нитрат ртути ( I ) :
Атомы ртути ( в отличие от цинка и кадмия ) могут связываться друг с другом ковалентной связью , образуя группировку Hg : Hg · . Каждый атом ртути в этом комплексе имеет степень окисления 1+ . Окислители легко повышают степень окисления ртути :
а восстановители переводят Hg⁺ в Hg⁺² и далее в металлическую ртуть ;
Гидроксиды ртути весьма не стабильны и разлагаются уже в ходе реакции :
Нагревание приводит к восстановлению до свободного металла:
Все соединения ртути чрезвычайно ядовиты, а в случае если ртуть была разлита её можно связать (нейтрализовать ) с серой . Поэтому места , где разлита ртуть , посыпают порошком серы или для « демеркурирования » также применяют раствор хлорида железа FeCl3
Статья на тему Ртуть
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment Отменить ответ
Для отправки комментария вам необходимо авторизоваться.
Источник