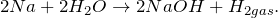- Натрий: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Натрий
- Уравнение реакции натрия с водой
- Реакции, взаимодействие натрия. Уравнения реакции натрия с веществами
- Реакции, взаимодействие натрия. Уравнения реакции натрия с веществами.
- Реакции, взаимодействие натрия с неметаллами. Уравнения реакции:
- Реакции, взаимодействие натрия с металлами и полуметаллами. Уравнения реакции:
- Реакции, взаимодействие натрия с оксидами. Уравнения реакции:
- Реакции, взаимодействие натрия с гидроксидами. Уравнения реакции:
- Реакции, взаимодействие натрия с солями. Уравнения реакции:
- Реакции, взаимодействие натрия с кислотами. Уравнения реакции:
- Реакции, взаимодействие натрия с водородосодержащими соединениями. Уравнения реакции:
- Реакции, взаимодействие натрия с органическими соединениями. Уравнения реакции:
Натрий: способы получения и химические свойства
Натрий — это щелочной металл, серебристо-белого цвета. Легкий, очень мягкий, низкая температура плавления.
Относительная молекулярная масса Mr = 22,990; относительная плотность по твердому состоянию d = 0,968; относительная плотность по жидкому состоянию d = 0, 27; tпл = 97,83º C; tкип = 886º C.
Способ получения
1. Натрий получают в промышленности электролизом расплава гидроксида натрия, в результате образуется натрий, кислород и вода:
4NaOH → 4Na + O2↑ + 2H2O
Качественная реакция
Качественная реакция на натрий — окрашивание пламени солями натрия в желтый цвет .
Химические свойства
Натрий — активный металл; на воздухе реагирует с кислородом и покрывается оксидной пленкой. Воспламеняется при умеренном нагревании; окрашивает пламя газовой горелки в темно-красный цвет.
1. Натрий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Натрий легко реагирует с галогенами с образованием галогенидов:
2Na + I2 = 2NaI
1.2. Натрий реагирует с серой с образованием сульфида натрия:
2Na + S = Na2S
1.3. Натрий активно реагирует с фосфором и водородом . При этом образуются бинарные соединения — фосфид натрия и гидрид натрия:
3Na + P = Na3P
2Na + H2 = 2NaH
1.4. С азотом натрий реагирует при температуре 100º С и электрическом разряде с образованием нитрида:
1.5. Натрий реагирует с углеродом с образованием карбида:
1.6. При взаимодействии с кислородом при температуре 250–400º C натрий образует пероксид натрия:
2. Натрий активно взаимодействует со сложными веществами:
2.1. Натрий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и водорода:
2Na 0 + 2 H2 O = 2 Na + OH + H2 0
2.2. Натрий взаимодействует с кислотами . При этом образуются соль и водород.
Например , натрий реагирует с разбавленной соляной кислотой :
2Na + 2HCl = 2NaCl + H2 ↑
2.3. Натрий может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Н атрий может взаимодействовать с гидроксидами:
Например , натрий взаимодействует с гидроксидом натрия при температуре 600º С:
2Na + 2NaOH = 2Na2O + H2
Источник
Натрий
Натрий — элемент 3-го периода и IA-группы Периодической системы, порядковый номер 11. Электронная формула атома [10Ne]3s 1 , степени окисления +1 и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде.
В природе — пятый по химической распространенности элемент (второй среди
металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко-желтый цвет (качественное обнаружение).
Натрий Na. Серебристо-белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав — амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):
Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °С), реагирует с неметаллами:
2Na + O2 = Na2O2 2Na + H2 = 2NaH
2Na + CI2 = 2NaCl 2Na + S = Na2S
6Na + N2 = 2Na3N 2Na + 2C = Na2C2
Очень бурно и с большим экзо-эффектом натрий реагирует с водой:
2Na + 2H2O = 2NaOH + Н2^ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из-за выделения Н2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н2 + O2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот НС1 и H2SO4 вытесняет водород (за счет Н20 и Н ).
Получение натрия в промышленности:
(см. также ниже получение NaOH).
Натрий применяется для получения Na2O2, NaOH, NaH, а также в органическом синтезе. Расплавленный натрий служит теплоносителем в ядерных реакторах, а газообразный — используется как наполнитель желтосветных ламп наружного освещения.
Оксид натрия Na2O. Основный оксид. Белый, имеет ионное строение (Na + )2O 2- . Термически устойчивый, при прокаливании медленно разлагается, плавится под избыточным давлением пара Na. Чувствителен к влаге и углекислому газу в воздухе. Энергично реагирует с водой (образуется сильнощелочной раствор), кислотами, кислотными и амфотерными оксидами, кислородом (под давлением). Применяется для синтеза солей натрия. Не образуется при сжигании натрия на воздухе.
Уравнения важнейших реакций:
Получение: термическое разложение Na2O2 (см.), а также сплавление Na и NaOH, Na и Na2O2:
2Na + 2NaOH = 2NaаO + H2 (600 °C)
2Na + Na2O2 = 2NaаO (130-200 °C)
Пероксид натрия Na2O2. Бинарное соединение. Белый, гигроскопичный. Имеет ионное строение (Na + )2O2 2- . При нагревании разлагается, плавится под избыточным давлением О2. Поглощает углекислый газ из воздуха. Полностью разлагается водой, кислотами (выделение О2 при кипячении — качественная реакция на пероксиды). Сильный окислитель, слабый восстановитель. Применяется для регенерации кислорода в изолирующих дыхательных приборах (реакция с СО2), как компонент отбеливателей ткани и бумаги. Уравнения важнейших реакций:
Получение: сжигание Na на воздухе.
Гидроксид натрия NaOH. Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Na + )(OH — ). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NaHCО3). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с экзо-эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов:
Раствор NaOH разъедает стекло (образуется NaSiО3), корродирует поверхность алюминия (образуются Na[Al(OH)4] и Н2).
Получение NaOH в промышленности:
а) электролиз раствора NaCl на инертном катоде
б) электролиз раствора NaCl на ртутном катоде (амальгамный способ):
(освобождающуюся ртуть возвращают в электролизер).
Едкий натр — важнейшее сырье химической промышленности. Используется для получения солей натрия, целлюлозы, мыла, красителей и искусственного волокна; как осушитель газов; реагент в извлечении из вторичного сырья и очистке олова и цинка; при переработке руд алюминия (бокситов).
Источник
Уравнение реакции натрия с водой
Запишите уравнение реакции натрия с водой; дайте название продукту взаимодействия. Какую химическую связь называют ковалентной. Расскажите о процессе образования ковалентной связи с позиции метода валентных связей
Уравнение реакции натрия с водой, в результате которой образуется гидроксид натрия и выделяется водород, имеет вид:
Для описания ковалентной связи существуют два основных метода: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО). Согласно первому из них связь осуществляется за счет пары электронов, находящихся на орбитали, образовавшейся за счет перекрывания двух атомных орбиталей.
Суть метода ММО заключается в следующем: в молекуле образуется собственная система молекулярных орбиталей, на которых находятся все электроны данной молекулы.
МВС можно рассматривать как современное развитие теории Льюиса, в соответствии с которой два атома совместно владеют одной или несколькими парами электронов. Известны два механизма образования такой связи: либо оба атома предоставляют в общее пользование по одному электрону, либо один атом (донор) предоставляет пару электронов, а другой (акцептор) — пустую орбиталь (донорно-акцепторный механизм). Результат один и тот же: две орбитали перекрываются, и на них находятся два электрона. Например, в ионе аммония три связи Н-N образованы перекрыванием одноэлектронных облаков, а четвертая — по донорно-акцепторному механизму. В результате все четыре связи неразличимы и равноценны.
В МВС ковалентная связь характеризуется насыщаемостью, поляризуемостью и направленностью.
Источник
Реакции, взаимодействие натрия. Уравнения реакции натрия с веществами
Реакции, взаимодействие натрия. Уравнения реакции натрия с веществами.
Натрий реагирует, взаимодействует с неметаллами, металлами, полуметаллами, оксидами, кислотами, гидроксидами, солями, органическими соединениями и пр. веществами.
Реакции, взаимодействие натрия с неметаллами. Уравнения реакции:
1. Реакция взаимодействия натрия и кислорода:
Реакция взаимодействия натрия и кислорода происходит с образованием пероксида натрия. Реакция представляет собой сжигание натрия на воздухе. В ходе реакции также образуется примесь – оксид натрия Na2O.
2. Реакция взаимодействия натрия и селена:
2Na + Se → Na2Se (t > 130 °C).
Реакция взаимодействия натрия и селена происходит с образованием селенида натрия.
3. Реакция взаимодействия натрия и углерода:
Реакция взаимодействия натрия и углерода происходит с образованием ацетиленида натрия.
4. Реакция взаимодействия натрия и кремния:
Реакция взаимодействия кремния и натрия происходит с образованием силицида натрия . Реакция протекает при сплавлении реакционной смеси.
5. Реакция взаимодействия натрия и красного фосфора:
3Na + P → Na3P (t = 200 °C).
Реакция взаимодействия натрия и красного фосфора происходит с образованием фосфида тринатрия. Реакция протекает в атмосфере аргона.
6. Реакция взаимодействия натрия и хлора:
Реакция взаимодействия натрия и хлора происходит с образованием хлорида натрия. Реакция протекает при комнатной температуре.
7. Реакция взаимодействия натрия и водорода:
2Na + H2 → 2NaH (t = 300 °C).
Реакция взаимодействия натрия и водорода происходит с образованием гидрида натрия.
8. Реакция взаимодействия натрия и брома:
2Na + Br2 → 2NaBr (t = 150-250 °C).
Реакция взаимодействия натрия и брома происходит с образованием бромида натрия.
9. Реакция взаимодействия натрия и йода:
I2 + 2Na → 2NaI (t = 100 °C).
Реакция взаимодействия йода и натрия происходит с образованием йодида натрия.
10. Реакция взаимодействия натрия и фтора:
Реакция взаимодействия фтора и натрия происходит с образованием фторида натрия. Реакция протекает при комнатной температуре.
11. Реакция взаимодействия натрия, кислорода и воды:
Реакция взаимодействия натрия, кислорода и воды происходит с образованием гидроксида натрия .
12. Реакция взаимодействия натрия, бора и водорода:
Реакция взаимодействия натрия, бора и водорода происходит с образованием тетрагидридобората (III) водорода . Реакция протекает при кипении в диоксане.
Аналогичным образом натрий вступает в реакции и с другими неметаллами: мышьяком, серой, азотом.
Реакции, взаимодействие натрия с металлами и полуметаллами. Уравнения реакции:
1. Реакция взаимодействия натрия и свинца:
Реакция взаимодействия натрия и свинца происходит с образованием металлида натрия/свинца. Реакция протекает в жидком аммиаке.
2. Реакция взаимодействия натрия и сурьмы:
Реакция взаимодействия натрия и сурьмы происходит с образованием металлида натрия/сурьмы. Реакция протекает в жидком аммиаке.
3. Реакция взаимодействия натрия и висмута:
Реакция взаимодействия натрия и висмута происходит с образованием металлида натрия/висмута. Реакция протекает в жидком аммиаке.
4. Реакция взаимодействия натрия и теллура:
2Na + Te → Na2Te (t = 130°C).
Реакция взаимодействия натрия и теллура происходит с образованием теллурида натрия.
5. Реакция взаимодействия натрия, алюминия и водорода:
Na + Al + 2H2 → Na[AlH4] (t = 140 °C, p = 350 атм.).
Реакция взаимодействия натрия, алюминия и водорода происходит с образованием тетрагидридоалюмината (III) натрия . Реакцию проводят в тетрагидрофуранена на протяжении 3-х часов. Данная реакция представляет собой метод промышленного многотоннажного производства тетрагидридоалюмината (III) натрия.
6. Взаимодействие натрия и ртути:
Натрий с ртутью образует амальгаму натрия.
7. Взаимодействие натрия и калия:
При сплавлении натрия и калия образуется жидкий натрий-калиевый сплав – NaK.
Реакции, взаимодействие натрия с оксидами. Уравнения реакции:
1. Реакция взаимодействия натрия и оксида азота (IV):
Реакция взаимодействия оксида азота (IV) и натрия происходит с образованием оксида азота (II) и нитрата натрия. В ходе реакции используется жидкий оксид азота (IV).
2. Реакция взаимодействия натрия и оксида азота (V):
Реакция взаимодействия натрия и оксида азота (V) происходит с образованием нитрата натрия и оксида азота.
3. Реакция взаимодействия натрия и воды:
Реакция взаимодействия натрия и воды происходит с образованием гидроксида натрия и водорода. Реакция протекает бурно.
4. Реакция взаимодействия натрия и оксида фосфора (V):
Реакция взаимодействия оксида фосфора (V) и натрия происходит с образованием метафосфата натрия и фосфида натрия.
5. Реакция взаимодействия натрия, оксида бора и водорода:
Реакция взаимодействия натрия, оксида бора и водорода происходит с образованием тетрагидридобората (III) водорода и воды.
Реакции, взаимодействие натрия с гидроксидами. Уравнения реакции:
1. Реакция взаимодействия натрия и гидроксида калия:
KOH + Na → NaOH + K (t = 380-450 °C).
Реакция взаимодействия гидроксида калия и натрия происходит с образованием гидроксида натрия и калия.
2. Реакция взаимодействия натрия и гидроксида натрия:
2Na + 2NaOH → 2Na2O + H2 (t = 600 °C).
Реакция взаимодействия натрия и гидроксида натрия происходит с образованием оксида натрия и водорода.
Реакции, взаимодействие натрия с солями. Уравнения реакции:
1. Реакция взаимодействия натрия и хлорида калия:
KCl + Na → K + NaCl (t = 760-890 °C).
Реакция взаимодействия хлорида калия и натрия происходит с образованием калия и хлорида натрия. В ходе реакции газообразным натрием воздействуют на расплав хлорида калия.
2. Реакция взаимодействия хлорида циркония (IV) и натрия:
ZrCl4 + 4Na → Zr + 4NaCl (t = 500 °C).
Реакция взаимодействия хлорида циркония (IV) и натрия происходит с образованием циркония и хлорида натрия. Реакция протекает в вакууме.
3. Реакция взаимодействия хлорида титана (IV) и натрия:
TiCl4 + 4Na → Ti + 4NaCl (t°).
Реакция взаимодействия хлорида титана (IV) и натрия происходит с образованием титана и хлорида натрия.
4. Реакция взаимодействия натрия и додекакарбонилтрижелеза:
Реакция взаимодействия додекакарбонилтрижелеза и натрия происходит с образованием тетракарбонилферрата натрия. Реакция протекает в жидком аммиаке.
5. Реакция взаимодействия натрия и фторида кремния (IV):
SiF4 + 4Na → Si + 4NaF (t = 500°C).
Реакция взаимодействия фторида кремния (IV) и натрия происходит с образованием кремния и фторида натрия.
Реакции, взаимодействие натрия с кислотами. Уравнения реакции:
1. Реакция взаимодействия натрия и ортофосфорной кислоты:
6Na + 2H₃PO₄ → 2Na₃PO₄ + 3H₂
Реакция взаимодействия натрия и ортофосфорной кислоты происходит с образованием ортофосфата натрия и водорода .
2. Реакция взаимодействия натрия и азотной кислоты:
Реакция взаимодействия натрия и азотной кислоты происходит с образованием нитрата натрия, оксида азота (II), оксида азота (I) и воды . В ходе реакции используется 20%-й раствор азотной кислоты.
Аналогичные реакции протекают и с другими минеральными кислотами.
Реакции, взаимодействие натрия с водородосодержащими соединениями. Уравнения реакции:
1. Реакция взаимодействия натрия и сероводорода:
Реакция взаимодействия натрия и сероводорода происходит с образованием гидросульфида натрия и водорода. Реакция протекает в бензоле.
Аналогичные реакции протекают и с другими водородосодержащими соединениями: хлороводородом, селеноводородом.
Реакции, взаимодействие натрия с органическими соединениями. Уравнения реакции:
1. Реакция взаимодействия натрия и этанола:
Реакция взаимодействия натрия и этанола происходит с образованием этанолята натрия и водорода. Реакция протекает при комнатной температуре.
2. Реакция взаимодействия натрия с другими органическими соединениями:
Натрий реагирует также со спиртами, фенолами, карбоновыми кислотами с образованием солей.
Источник