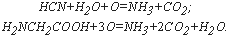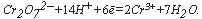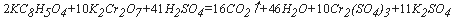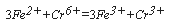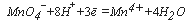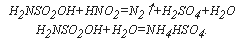- Химическое потребление кислорода водой
- Что такое ХПК и БПК, как определить, нормы?
- Критерии загрязнения вод
- Чем опасно загрязнение вод?
- Человеку
- Природе
- Химическое потребление кислорода
- БПК, БПК полное и БПК-5
- Методы определения и расчета ХПК
- Типы вод
- Питьевая и техническая
- Природные воды
- Поверхностные пресные
- Подземные грунтовые
- Сточные воды
- Промышленные стоки
- Хозяйственно-бытовые
- Ливневые и очищенные
- Нормы ХПК, БПК для разных вод
- Соотношение норм БПК и ХПК
- ПДК, критичные значения ХПК и БПК
- Как снизить загрязнение вод?
- Способы очистки вод
- Стадии снижения ХПК и БПК
- Оборудование для анализа воды
- Какое бывает?
Химическое потребление кислорода водой
Присутствующие в воде органические соединения могут претерпевать не только аэробное биохимическое окисление в результате жизнедеятельности бактерий, используемое при определении БПК (см. раздел 6.2.5). При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК). Являясь интегральным (суммарным) показателем, ХПК в настоящее время считается одним из наиболее информативных показателей антропогенного загрязнения вод. Этот показатель, в том или ином варианте, используется повсеместно при контроле качества природных вод, исследовании сточных вод и др. Результаты определения окисляемости выражаются в миллиграммах потребленного кислорода на 1 л воды (мгО/л).
Однако не все органические вещества в равной степени участвуют в реакции химического окисления. Так же, как и при биохимическом окислении, при химическом окислении можно выделить группы легко, нормально и тяжело окисляющихся органических веществ. Поэтому всегда существует разница между теоретически возможным и практически достигаемым значениями ХПК.
Теоретическим значением ХПК (ХПКтеор) называют количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе органических веществ, т.е. всех способных окисляться элементов из состава органического соединения. При таком окислении углерод теоретически количественно окисляется до CO2, а сера и фосфор (если они присутствуют в соединении) – до SO3 и P2O5. Азот превращается в аммонийную соль; кислород, входивший в состав окисляемых органических молекул, является «строительным материалом» для образующихся продуктов окисления, а водород переходит в структуру H2O или аммонийной соли.
Например, при окислении синильной кислоты и гликоколя протекают реакции:
Практически используемые методы определения ХПК дают результаты, близкие к ХПКтеор, но всегда отклоняющиеся в ту или иную сторону. При наличии трудно окисляющихся органических веществ их окисление за время реакции проходит неполностью, и это приводит к занижению результата. В то же время, при наличии в пробе неорганических восстановителей, также потребляющих кислород на собственное окисление, результат получается завышенный. Совместное действие обоих факторов и вызывает отклонение реального ХПК от ХПКтеор.
Таким образом, окисляемость, или ХПК, характеризует общее количество содержащихся в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями. В качестве таких окислителей обычно используют бихромат- и перманганат-анионы, и соответственно называются основные методы определения ХПК – бихроматный и перманганатный. Следует отметить, что результаты определения окисляемости одной и той же воды с помощью разных окислителей обычно неоднозначны из-за неодинаковой степени окисления веществ, присутствующих в воде. Результаты зависят также от свойств окислителя, его концентрации, температуры, рН, продолжительности окисления и др. Получаемые результаты сопоставимы только в том случае, когда точно соблюдены все условия проведения анализа.
Бихроматная окисляемость позволяет получить значение ХПК, наиболее приближенное к ХПКтеор, т.е. наиболее полное окисление достигается бихроматом калия. Поэтому определение бихроматной окисляемости является основным методом определения ХПК. Именно бихроматную окисляемость часто называют «химическим потреблением кислорода»*. В условиях этого метода большинство органических соединений окисляется на 95% и более, однако окисляются не все соединения (толуол, бензол, пиридин, парафин и др. практически не окисляются). Катализатором окисления является сульфат серебра, который добавляется в аналитическую рецептуру для ускорения реакции и повышения полноты окисления органических веществ. Избыток бихромата оттитровывается раствором соли Мора. Реакцию проводят в жестких условиях – в 50%-ной (18-нормальной, разбавление 1:1) серной кислоте при кипячении. Содержание неорганических восстановителей в пробе определяют отдельно специальными методами и вычитают из ХПК пробы.
Бихромат при этом восстанавливается согласно уравнению:
В таких условиях получаемый результат обычно составляет 95–98% от ХПКтеор.
На примере окисления фталата калия бихроматом реакцию можно записать следующим образом:
Из уравнения реакции следует, что на окисление 2 молекул фталата калия расходуется 16 молекул кислорода, связанного в бихромате. В весовом отношении ХПКтеор для 1 мг фталата калия составляет 1,175 мгО.
Значения ХПКтеор (в мг кислорода на 1 мг вещества) для разных соединений по данным [12] приведены в табл. 14.
Значения ХПКтеор для разных соединений
| Соединение | ХПКтеор , мгО/л |
| Щавелевая кислота | 0,18 |
| Синильная кислота | 0,59 |
| Гликоколь | 0,64 |
| Глюкоза | 1,07 |
| Уксусная кислота | 1,07 |
| Сахароза | 1,12 |
| Масляная кислота | 1,82 |
| Этанол | 2,09 |
| Додецилбензоат натрия | 2,34 |
| Фенол | 2,38 |
| Бутанол | 2,59 |
Бихроматная окисляемость определяется методом титрования. Соответствующие методики, с незначительными различиями, регламентированы как отечественными руководящими документами, так и международным стандартом ИСО 6060. Согласно методу титрования, избыток бихромата калия после операции окисления (уравнение реакции см. выше) оттитровывают солью Мора в присутствии индикатора, в качестве которого обычно используется ферроин – комплекс 1,10-фенатролина с сульфатом железа (II) (в качестве индикатора может быть также использована N-фенилантраниловая кислота). При этом катион Fe 2+ в титранте реагирует с катионом хрома:
Индикатор образует интенсивно окрашенное соединение с Fe 2+ , и бесцветное – с Fe 3+ . По этой причине, когда восстановление Cr 6+ до Cr 3+ завершено, Fe 2+ реагирует с индикатором с образованием ферроинового комплекса. При этом окраска раствора отчетливо изменяется от синевато-зеленой до красно-коричневой, что указывает момент окончания титрования. Момент окончания титрования может быть установлен также потенциометрически.
Для определения ХПК, наряду с окислением бихроматом, проводят также окисление перманганатом. Соответствующий показатель называется перманганатной окисляемостью (за рубежом также используют термин «перманганатный индекс»). Перманганатная окисляемость является мерой загрязнения воды окисляемыми органическими и неорганическими веществами, способными к окислению в условиях анализа, и такими условиями являются окисление 0,01 ммоль/л экв. раствором перманганата калия в сернокислой среде или кипячение в течении 10 мин.
Уравнение реакции при окислении пробы перманганатом можно записать следующим образом:
Для определения перманганатной окисляемости используется более простой метод, чем для бихроматной окисляемости, однако он имеет ограниченное применение. Так, определение перманганатной окисляемости может быть рекомендовано (и широко используется) лишь при анализе природных вод для контроля за динамикой содержания легкоокисляющихся веществ природного происхождения (например, гуминовых кислот). И это понятно, т.к. «жестко» окисляющиеся органические загрязнители, часто присутствующие в сточных водах, в природной воде практически не встречаются. Следует отметить также, что именно перманганатная окисляемость является единственным показателем ХПК, регламентирующим качество питьевой воды согласно СанПиН 2.1.4.559-96 (норматив составляет 5,0 мгО/л).
Перманганатная окисляемость может давать некорректные результаты при анализе сточных вод по следующим причинам:
перманганат – недостаточно сильный окислитель, поэтому окисление многих веществ проходит неполно или совсем не проходит;
при кипячении растворов, содержащих перманганат, последний разлагается до диоксида марганца и кислорода (как в кислой, так и в щелочной средах). Выпадающий диоксид марганца каталитически ускоряет процесс, однако в холостой пробе или относительно чистой воде этого не происходит. Процесс осложняется тем, что количество выпадающего диоксида марганца зависит от условий и состава анализируемой пробы.
Как уже отмечалось, в природных водах содержание трудно окисляющихся органических веществ обычно крайне мало, и результаты, получаемые при анализе природных вод бихроматным и перманганатным методами, практически достаточно близки.
Перманганатную окисляемость используют для оценки качества питьевой, водопроводной воды, природной воды источников водоснабжения и др. Ее определение предусмотрено ГОСТом 2761 при обследовании источников хозяйственно-питьевого водоснабжения. Более загрязненные поверхностные и сточные воды** также, с известным приближением, можно анализировать этим методом, однако их необходимо разбавлять. Перманганатную окисляемость нельзя рассматривать как меру теоретического потребления кислорода или общего содержания органических веществ в воде, т.к. ряд органических соединений в условиях этого метода окисляются лишь частично.
Таким образом, для характеристики ХПК как показателя химической активности пробы, традиционно используются методы «мокрой» химии. Тем не менее ХПК определяют также и «сухими» приборными методами. Например, методами сжигания органических веществ пробы в токе кислорода или СО2. Эти методы также позволяют получить результаты, близкие ХПКтеор, однако требуют приборного оснащения, а приборы – соответствующего обслуживания, поверки и т.п.
Мешающее влияние при определении ХПК оказывают, в первую очередь, хлорид-анионы, как правило, содержащиеся в природных и, особенно, в сточных водах. Хлориды окисляются в условиях анализа до элементарного хлора, поэтому при содержании в пробе в концентрации свыше 300 мг/л их влияние устраняется (или минимизируется) путем добавления сульфата ртути (II) в количестве 22,2 мг HgSO4 на 1 мг Cl – . Образующийся малодиссоциированный хлорид ртути (II) устойчив в присутствии большой концентрации серной кислоты и бихромата.
Определению также мешают нитриты, часто присутствующие в водах, прошедших биохимическую очистку. Для их устранения в пробу вводят по 10 мг сульфаминовой кислоты на 3 мг NO 2– . При кипячении раствора нитрит-анионы удаляются в виде азота, а избыток сульфаминовой кислоты переходит в сульфат аммония:
Помимо хлоридов и нитритов, определению мешают сульфиды, сероводород и железо (2). Все указанные соединения, при их присутствии в пробе, могут быть определены индивидуально, и результат анализа на окисляемость в таком случае уменьшают на величину потребления кислорода этими соединениями. В частности, 1 мг H2S соответствует 0,47 мгО, 1 мг NO 2– – 0,35 мгО, 1 мг Fe 2+ – 0,14 мгО.
Нормативы на ХПК в воде водоемов: для питьевой воды – 5,0 мгО/л (для перманганатной окисляемости), ХПН – 15 мгО/л; КБН – 30 мгО/л (для бихроматной окисляемости).
* Показатель ХПК по международной терминологии (англ.) называется «Сhemical oxyden demand» (COD). При этом имеется в виду исключительно бихроматная окисляемость.
** Для оценки загрязненности сточных вод органическими веществами используют обычно бихроматную окисляемость.
Источник
Что такое ХПК и БПК, как определить, нормы?
Критерии загрязнения вод
Загрязнение вод относится к ряду наиболее важных проблем экологии. Для определения и выбора наиболее эффективных способов защиты водной среды необходим постоянный контроль её состояния и анализ причин загрязнения. Основным критерием загрязнённости служит концентрация органических и неорганических загрязнителей в составе воды.
Чем опасно загрязнение вод?
Загрязнение водной среды ухудшает экологическое состояние планеты, разрушает её естественную красоту и делает менее пригодной для жизни. Ухудшение состояния гидросферы приводит к постоянно нарастающему дефициту пресной воды.
Человеку
Ухудшение качества питьевой воды грозит человеку попаданием в организм химических элементов и соединений, которые являются причинами различных нарушений здоровья:
- при избытке железа в воде — заболевания сердечно-сосудистой, мочевыводящей системы, кожные заболевания, аллергические реакции;
- при потреблении алюминия уменьшается содержание кальция, сказывающееся на состоянии костей, ногтей и волос;
- хлор ослабляет стенки кровеносных сосудов;
- нитраты в организме человека преобразуются в канцерогены.
Природе
Загрязнение водного бассейна планеты приводит к болезням и гибели животных и растений. Целые ареалы обитания различных видов становятся непригодными для их существования. В перспективе процесс грозит превращением в пустыню всё большей территории земли.
Химическое потребление кислорода
Непосредственное определение концентрации загрязняющих веществ в воде — это трудновыполнимая в техническом отношении задача. Для оценки степени загрязнения вод применяются наиболее удобные и легко реализуемые способы, основанные на анализе косвенных показателей, одним из которых является химическое потребление кислорода (ХПК).
Химические реакции окисления органических и неорганических соединений, содержащихся в воде, сопровождаются потреблением кислорода, расход которого функционально связан с концентрацией разлагаемых веществ. То есть, оценить концентрацию загрязняющих соединений можно по затратам кислорода в процессе их окисления.
Таким образом, ХПК — это количество кислорода, которое участвует в химических реакциях окисления органических и неорганических соединений и отражающее их исходную концентрацию в воде.
БПК, БПК полное и БПК-5
Процесс окисления загрязнителей может происходить не только под воздействием чисто химических реакций, но и как результат жизнедеятельности микроорганизмов, обитающих в водной среде. При этом микроорганизмы, осуществляющие биохимическое окисление загрязняющих веществ, используют кислород, находящийся в воде.
Биохимическое потребление кислорода (БПК) — это количество кислорода, потреблённого микроорганизмами при биохимическом окислении веществ – загрязнителей. БПК служит показателем концентрации в воде органических соединений, подвергающихся биологическому разложению.
Биохимическое окисление занимает более продолжительное время по сравнению с окислением химическим, так как связано с жизнедеятельностью микрофлоры. Поэтому для оценки исходной концентрации органики важно учитывать условия и время протекания процессов биодеградации.
В результате наблюдений за протеканием процессов биохимического окисления при температуре 20°С, установлено следующее:
- в течение пяти суток происходит окисление порядка 70% органических веществ, содержащихся в воде;
- за десять суток разлагается 90% органики;
- реакция, протекающая на протяжении 20-ти суток, приводит практически к полному разложению (99%) органических примесей.
Примечание. БПК отражает содержание в воде только тех веществ, которые подвержены биохимическому разложению. Отдельные устойчивые органические соединения не распадаются под воздействием микроорганизмов.
На практике используется два вида показателей БПК:
БПК полное. Этот показатель определяется как потребление кислорода при протекании биохимических реакций в течение 20-ти суток.
БПК-5. Определяет биохимическое потребление кислорода в период 5-ти суточной инкубации. Ввиду того, что для определения полного БПК требуется более длительное время, для практической оценки чаще применяется показатель БПК-5.
Методы определения и расчета ХПК
Существует две методики определения химического потребления кислорода, отличающиеся применяемыми окислителями:
- перманганатная методика, использующая в качестве окислителя перманганат калия в сернокислой среде;
- бихромная, в основе которой лежит применение бихромата калия с серной кислотой.
Перманганатная окисляемость определяется следующим образом. В пробу исследуемой воды добавляют раствор серной кислоты в дистиллированной воде (1:3). После этого пробирка нагревается и в неё добавляется раствор перманганата калия. Далее раствор обесцвечивается оксалатом натрия или щавелевой кислотой. Обесцвеченный раствор титрируют рабочим раствором перманганата калия до появления бледно-розового оттенка.
Аналогичным образом параллельно основному опыту проводят так называемый холостой опыт, в котором вместо пробы исследуемой воды используется пробирка с дистиллированной водой.
Значение перманганатной окисляемости, измеряемой в мгО/дм 3 , вычисляется по формуле:
где V3 и V0 — титрирующий объём перманганата калия соответственно в основном и холостом опытах, V4 — объём пробы воды, подвергающейся анализу. Таким образом, количество потреблённого кислорода определяется путём сопоставления с титрирующим объёмом перманганата калия. Значения коэффициентов в приведенной формуле принимаются в соответствии с ГОСТ Р 55684 – 2013.
Определение ХПК бихромным методом регулируется ГОСТ 31859 – 2012. Суть методики заключается в том, что в пробу воды, предназначенной для исследования, добавляется серная кислота и бахромат калия. В качестве катализатора окислительной реакции используется сульфат серебра, а для нейтрализации влияния хлоридов, искажающих результаты исследования, — сульфат ртути.
Определение ХПК производится путём измерения оптической проницаемости раствора. А так как оптические свойства раствора имеют функциональную связь с концентрацией в нём кислорода, то ХПК находится по специальной градуировочной шкале. При этом в зависимости от предполагаемого диапазона, в котором находится истинное значение ХПК, измерение проводится на одной из двух значений длины волны оптического излучения:
- 440 нм в случаях, когда значение ХПК лежит в пределах 10 – 160 мгО/дм 3 ;
- 600 нм, если предполагаемое значение ХПК находится в диапазоне от 80 до 800 мгО/дм 3 ;
- в зоне значений ХПК 80 – 160 мгО/дм 3 допускается использование любой из рекомендованных длин волн.
Основным средством измерения является фотометрический анализатор, адаптированный для измерения оптической плотности водных растворов.
Определение БПК производится согласно РД 52.24.420-2006.
В основе метода — измерение концентрации кислорода путём титрования йодидом калия исследуемых проб до инкубации и после неё. Таким способом определяется разность концентрации кислорода между исходной пробой и пробой, прошедшей инкубацию. Инкубация осуществляется в течение 5-ти суток (в случае определения БПК-5) при температуре 20°С без доступа освещения и воздуха. Для этого исследуемые пробы помещаются в термостат. Для определения полной БПК инкубационный период устанавливается в 20 суток.
Типы вод
Питьевая и техническая
С точки зрения пригодности для питья вода подразделяется на питьевую и техническую. Требования, предъявляемые к питьевой воде, определяются действующими санитарными нормами и содержат ряд критериев, среди которых отсутствие:
- болезнетворных микроорганизмов;
- веществ, отнесённых к 1-й группе опасности — фосфора, фторида, соединений ртути, свинца и т.п.;
- радионуклеидов.
Также установлены предельные нормы минерализации питьевой воды.
Техническая вода может использоваться для орошения, применяться в качестве энергоносителя в системах кондиционирования воздуха, обеспечивать технологические потребности производственных процессов.
Природные воды
К природным водам относятся все водные запасы планеты, включая моря и океаны, пресные водоёмы, ледники, почвенную и атмосферную влагу.
Поверхностные пресные
Пресные поверхностные воды — это водоёмы с пресной водой, которые находятся на поверхности земли. В эту категорию входят реки, озёра, болота и другие поверхностные скопления пресной влаги.
Подземные грунтовые
Запасы воды планеты сосредоточены не только на её поверхности. Значительная их часть находится в толще земной коры в различных агрегатных состояниях. Ближе всего к поверхности залегают грунтовые воды, которые образуют первый водоносный слой.
Сточные воды
Сточные воды подразделяются на естественные стоки (дождевые и талые) и образованные системами водоотведения.
Промышленные стоки
Производственные или промышленные сточные воды образуются после использования воды в технологических процессах предприятий и отводятся через специализированные системы отведения или общую канализацию.
Хозяйственно-бытовые
Хозяйственно-бытовые стоки образуются при смешивании в единой системе водоотведения стоков бытового и промышленного происхождения.
Ливневые и очищенные
Воды, образующиеся в результате выпадения атмосферных осадков, таяния снега и льда образуют ливневые стоки, которые отводятся специальными системами ливневой канализации, которые при необходимости могут оснащаться очистными сооружениями.
Нормы ХПК, БПК для разных вод
Значения ХПК и БПК служат критериями оценки водного загрязнения, для воды различного назначения установлены их предельные нормы.
Соотношение норм БПК и ХПК
Использование двух различных показателей — потребления кислорода биохимическими и химическими процессами, не случайно. Соотношение БПК и ХПК позволяет определить характер загрязнения воды и выбрать эффективный метод очистки. Значение ХПК, как правило, больше, чем БПК. Небольшая разница между этими показателями указывает на то, что биологические способы очистки приведут к хорошему результату и наоборот, большой отрыв значения ХПК говорит о том, что наиболее эффективна химическая очистка.
ПДК, критичные значения ХПК и БПК
Правилами водоснабжения и водоотведения установлены требования, предъявляемые к качеству сточных вод. В частности, для стоков систем водоотведения установлены критические значения ХПК и БПК и предельно допустимые концентрации отдельных веществ, часть которых приведена в таблице:
| № | Наименование фактора | Предельное значение, мг/дм 3 |
| 1. | Содержание взвешенных веществ | 300 |
| 2. | БПК-5 | 300 (для общесплавных систем – 500) |
| 3. | ХПК | 500 (для общесплавных систем – 700) |
| 4. | Концентрация азота | 50 |
| 5. | Концентрация фосфора | 12 |
Как снизить загрязнение вод?
Решение глобальной проблемы загрязнения водных ресурсов может быть только комплексным. Никакая отдельно взятая мера не способна привести к успеху. Усилия общества должны быть приложены по всем направлениям:
- совершенствование технологических процессов с целью уменьшения количества промышленных стоков и снижения их загрязнённости (применение оборотного технического водоснабжения и т.п.);
- рациональное использование пестицидов и минеральных удобрений в сельском хозяйстве;
- снижение вредных выбросов в воздух, так как значительная их часть попадает в водоёмы;
- совершенствование технологий очистки сточных вод.
Способы очистки вод
Существующие технологии очистки стоков основаны на отдельном или комбинированном применении нескольких способов:
- механического — применение отстойников, песколовок и т.п.;
- физико-химического, использующего флотацию, сорбцию, ионный обмен;
- химического — коагулирование, нейтрализация;
- биологического, основанного на биохимических процессах с участием микроорганизмов.
Стадии снижения ХПК и БПК
При осуществлении очистки сточных вод ХПК и БПК снижается на трёх начальных этапах:
- в процессе грубой фильтрации, отделения плёнок и крупных загрязнений;
- при растворении и окислении органики специальными препаратами;
- при удалении солей металлов с применением электродиализа, абсорбции, обратного осмоса.
Оборудование для анализа воды
Какое бывает?
Для анализа воды используется большое количество разнообразных приборов, основанных на разных принципах действия, среди которых:
- фотометры, фотометрические анализаторы, измеряющие оптическую плотность водных растворов;
- электронные солемеры, определяющие концентрацию растворённых в воде веществ;
- комплексные измерители параметров, определяющие несколько показателей: температуру, содержание солей, показатель кислотности, минерализацию, электропроводность и т.п.;
- комплекты приборов для оснащения лабораторий.
Где лучше всего заказать?
Заказ приборов контроля качества воды лучше производить непосредственно у производителя или его официального представителя в регионе. В этом случае отсутствует вероятность приобретения подделки, кроме этого, на всё оборудование предоставляется гарантия производителя и сервисное обслуживание.
Источник