- Урок 27. Состав и физические свойства воды
- Состав и строение воды
- Физические свойства воды
- Вода как растворитель
- Химия 8 класс определения вода
- 8 класс. Химия. Вода и ее свойства
- 8 класс. Химия. Вода и ее свойства
- Вопросы
- Поделись с друзьями
- Комментарии преподавателя
- Химия 8 класс определения вода
- Физические свойства воды
- Химические свойства воды
- Вода в жизнедеятельности человека. Водные растворы
Урок 27. Состав и физические свойства воды
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Состав и строение воды
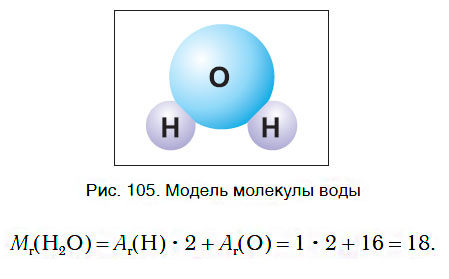
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
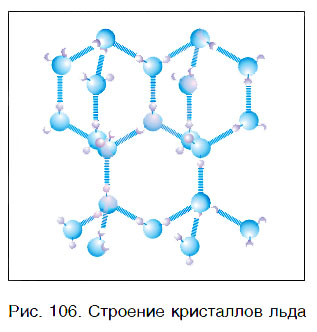
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.
Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см 3 , а плотность жидкой воды — примерно 1,00 г/см 3 . Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.
При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается. Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время. И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально. Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки. Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).
Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Химия 8 класс определения вода
Вода (химия, 8 класс):
Мы уже много говорили об этом полезном веществе (и вы наверняка о нем уже многое слышали), теперь посмотрим на воду подробнее, с позиции химии.
Формула воды, как вам уже известно, H2O (аш два о)
Около 75% Земли покрыто водой. Примерно такое же количество воды и в человеке.
Даже сухие на вид вещества удерживают в себе много влаги, например, высушенная на воздухе древесина еще содержит 15% воды. Для выпаривания всей воды из древесины требуется еще несколько часов подержать древесину при высокой температуре. И все равно, даже после этого, древесина будет стараться поглотить влагу из воздуха, как и подобные ей гидроскопичные вещества. Также хорошо поглощает из воздуха воду сахар, соль, силикагель (мешочки с шариками в обуви и по совместительству наполнитель для кошачьего туалета) и т.д.
— выше 0 °C и до 100 °C вода жидкая
— при превышении 100 °C кипит
— при 0 °C и ниже превращается в лед. Удивительное качество воды, при замерзании становиться больше (обычно все вещества на холоде уменьшаются), поэтому плотность льда меньше плотности воды и мы ежегодно видим подтверждение этому, ведь лёд не тонет
— при 2500 °C вода разлагается на водород и кислород.
— под действием электрического тока вода также способна к разложению (это реакция электролиза)
— плотность воды 1 г/см 3
— имеет высокую теплоемкость (медленно нагревается, медленно остывает)
— вода без примесей плохо проводит электрический ток и тепло (меньше всего примесей в дождевой воде)
Если в воде растворены минеральные соли из источников, то такая вода называется минеральной.
Вода, которая течет в домах из кранов, предварительно фильтруется, обеззараживается хлором на водоочистительных станциях. Но все равно её качество не всегда удовлетворительное из-за труб и других факторов. Поэтому желательно производить дополнительную обработку воды, пропуская её через собственные фильтры или производя кипячение.
Чистейшую воду для опытов, медицинских и других целей получают дистилляцией (перегонкой). Т.е. нагревают воду, она переходит в пар, пар охлаждается и опять переходит в жидкость. Соли и другие примеси не могут испариться вместе с водой, поэтому такая вода становится практически чистой и называется дистиллированной.
Для питья дистиллированная вода не очень подходит, так как нам необходима вода с солями. При этом количество солей в питьевой воде не должно быть слишком большим. Например, от морской воды быстро становится плохо.
Для нас пригодна речная, ключевая вода, вода из источников, но, к сожалению, постоянные выбросы из канализаций, с заводов, поступление в воды удобрений с полей и другие факторы, портят качество всей воды на планете.
В некоторых регионах мира проблема с водой катастрофическая, например, в большей части Африки, в Китае,…. Китай, в связи с этим, даже начал закупать воду в России из озера Байкал.
Редактировать этот урок и/или добавить задание Добавить свой урок и/или задание
Добавить интересную новость
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
user->isGuest) < echo (Html::a('Войдите', ['/user/security/login'], ['class' =>»]) . ‘ или ‘ . Html::a(‘зарегистрируйтесь’, [‘/user/registration/register’], [‘class’ => »]) . ‘ , чтобы получать деньги $$$ за каждый набранный балл!’); > else < if(!empty(\Yii::$app->user->identity->profile->first_name) || !empty(\Yii::$app->user->identity->profile->surname))< $name = \Yii::$app->user->identity->profile->first_name . ‘ ‘ . \Yii::$app->user->identity->profile->surname; > else < $name = ''; >echo ‘Получайте деньги за каждый набранный балл!’; > ?>—>
При правильном ответе Вы получите 2 балла
Отметьте верные утверждения о воде
Выберите те ответы, которые считаете верными.
Добавление комментариев доступно только зарегистрированным пользователям
Lorem iorLorem ipsum dolor sit amet, sed do eiusmod tempbore et dolore maLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborgna aliquoLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempbore et dLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborlore m mollit anim id est laborum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Lorem ipsum dolor sit amet, consectetu sed do eiusmod qui officia deserunt mollit anim id est laborum.
28.01.17 / 22:14, Иван ИвановичОтветить -2
Lorem ipsum dolor sit amet, consectetur adipisicing sed do eiusmod tempboLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod temLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborpborrum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Источник
8 класс. Химия. Вода и ее свойства
8 класс. Химия. Вода и ее свойства
Вопросы
Задай свой вопрос по этому материалу!
Поделись с друзьями
Комментарии преподавателя
Вода – самое распространенное вещество на Земле. Поверхность земного шара на 3/4 покрыта водой, в довольно больших количествах вода находится в атмосфере, а также в земной коре. Основное количество воды содержится в океанах (около 97,6%), запасы же пресной воды достаточно ограничены. Около 85% всех запасов пресной воды сосредоточено в ледниках.
Вода – единственное вещество, которое встречается на Земле в трех агрегатных состояниях: твердом (лед), жидком и газообразном (водяной пар).
Состав молекулы воды вам хорошо знаком: на два атома водорода в молекуле воды приходится один атом кислорода, е химическая формула – Н2О. Такой состав был установлен еще А.Л. Лавуазье и подтверждается результатами эксперимента по разложению воды, когда на 1 объем выделяющегося кислорода приходится два объема выделяющегося водорода.
Вы уже знакомы с некоторыми химическими свойствами воды. При пропускании через воду электрического тока (или при нагревании до 2000˚С) вода разлагается на водород и кислород. Вода может вступать в реакцию соединения со многими оксидами.
Пример такой реакции вам хорошо знаком. Так называемое «гашение извести» — взаимодействие оксида кальция с водой. В результате этой реакции образуется гашеная известь – гидроксид кальция. Эта реакция является экзотермической, т.е. протекает с выделением тепла.
СаО + Н2О = Са(ОН)2 + Q
Вода способна вступать в реакции замещения с активными металлами. Например, кальций взаимодействует с водой с образованием гидроксида кальция и водорода.
Са + 2Н2О = Са(ОН)2 + Н2↑ + Q
В результате этой реакции выделяется большое количество теплоты.
Вода из природных источников не всегда пригодна для питья и даже промышленных процессов. Поэтому ее подвергают очистке. Питьевая вода не должна содержать нерастворенных примесей и болезнетворных микроорганизмов. Сначала воду из рек, озер и прудов отстаивают в специальных бассейнах и фильтруют через слой песка. Затем обрабатывают хлором, а иногда озоном или ультрафиолетом, для уничтожения микроорганизмов.
Рис. 3. Станция очистки воды
Роль воды в промышленности, быту и сельском хозяйстве сложно переоценить. Развитие всех отраслей хозяйства страны, рост городов нередко приводят к загрязнению водоемов. Поэтому в каждом государстве должны приниматься меры по охране и рациональному использованию водных природных ресурсов.
Источник
Химия 8 класс определения вода
Ключевые слова конспекта: вода, физические и химические свойства воды, водные растворы.
Физические свойства воды
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха, плотность 1 кг/л, температура кипения 100 °С при 1 атм, температура плавления 0°С. У воды высокая удельная теплоемкость — 4,12 кДж/кг К), поэтому она долго нагревается и медленно остывает. У воды большая теплота испарения. На испарение 1 г воды требуется 2,25 кДж теплоты.
Атомы Н и О в молекуле воды соединены полярными ковалентными связями. На атоме водорода в молекуле Н2О имеется небольшой положительный заряд δ+, а на атоме кислорода — небольшой отрицательный δ-. Поскольку молекула воды имеет уголковое строение, она представляет собой двухполюсную частицу — диполь: 
Химические свойства воды
Вода реагирует со многими металлами по типу реакций замещения.
С наиболее активными металлами — от Li по Аl в ряду активности металлов при комнатной температуре протекают реакции замещения одного атома Н в молекуле Н2O. С магнием реакция идет при нагревании, с алюминием — после снятия защитной оксидной пленки. В реакции образуются гидроксиды металлов — соединения, содержащие гидроксогруппу ОН, и водород:
2Li + 2Н2O = 2LiOH + Н2↑,
Са + 2Н2O = Са(ОН)2 + Н2↑.
Менее активные металлы — Zn, Mo, W, Fe — взаимодействуют с водой при высокой температуре (400-600 °С). В этих реакциях образуются оксиды металлов и водород:
Zn + Н2O = ZnO + Н2↑,
3Fe + 4Н2O = Fe3O4 + 4Н2↑
Вода реагирует с оксидами активных металлов (реакция гидратации). При этом получаются растворимые в воде гидроксиды металлов — щелочи:
Na2O + Н2O = 2NaOH,
СаО + Н2O = Са(ОН)2.
Вода соединяется с оксидами многих неметаллов. При этом получаются растворимые в воде гидроксиды неметаллов — кислоты:
СO2 + Н2O = Н2СO3,
SO3 + Н2O = H2SO4.
Гидролиз — это обратимая реакция обмена, например соли с водой. При этом происходит расщепление молекул воды на Н и ОН, которые входят в состав двух новых веществ:
К2СO3 + Н2O = КНСО3 + КОН,
РСl3 + ЗН2O = Н3РО3 + ЗНСl.
Вода в жизнедеятельности человека. Водные растворы
Вода — жизненная среда всех живых организмов. Человек живет на суше, но его организм на 65-70% состоит из воды. Все процессы в живой клетке осуществляются в водной среде. В сутки человеку необходимо 2 л питьевой воды. Кроме того, вода нужна, чтобы варить пищу, стирать белье, умываться. Большие количества пресной воды расходуются в промышленности и сельском хозяйстве (растворитель). Отметим, что соленая вода морей и океанов для этих целей непригодна. Доля пресной воды в общих запасах воды на Земле составляет менее 3% от всех водных ресурсов.
Вода — химический реагент. Соединяясь с оксидами активных металлов, вода образует щелочи, а в реакциях с оксидами неметаллов дает кислоты — два больших и важных в деятельности человека класса веществ. Один из способов синтеза этилового спирта (этанола) C2H5OH — реакция этилена С2Н4 с водой:
Жесткость воды — это свойства воды, обусловленные содержанием в ней ионов Са 2+ , Mg 2+ , Fe 2+ . Если концентрация этих ионов велика, то воду называют жесткой, если мала — мягкой. При стирке с мылом в жесткой воде образуются осадки, часть мыла уходит в осадок и ухудшается качество ткани. Такая вода непригодна для охлаждения в радиаторах автомобилей, в паровых котлах и стиральных машинах. При нагревании жесткой воды образуется накипь, которая забивает трубы и ускоряет изнашивание механизмов. Различают временную и постоянную жесткость воды.
Временная или карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Са(НСО3)2, магния Mg(HCO3)2 и железа Fe(HCO3)2. При кипячении воды гидрокарбонаты разлагаются с образованием осадка карбоната, и жесткость воды снижается:
Са(НСO3)2 = СаСО3↓ + СO2↓ + Н2O,
Fe(HCO3)2 = FeCO3↓ + CO2↓ + Н2O.
Другой способ устранения временной жесткости — действие известкового молока или соды:
Постоянная жесткость воды обусловлена присутствием в ней хлоридов, сульфатов и других растворимых солей кальция, магния и железа. Ее устраняют действием соды:
СаСl2 + Na2CO3 = СаСO3↓ + 2NaCl.
Водный раствор — разновидность раствора, в котором растворителем служит вода. Будучи превосходным растворителем, именно вода используется для приготовления большинства растворов в химии.
Вещества, которые плохо растворяются в воде, называют гидрофобными (‘боящимися воды’), а хорошо в ней растворяющиеся — гидрофильными (‘любящими воду’). Примером типичного гидрофильного соединения может служить хлорид натрия (поваренная соль).
Если вещество образует водный раствор, который хорошо проводит электрический ток, то он называется сильным электролитом; в противном случае — слабым.
Конспект урока по химии «Вода. Свойства воды. Водные растворы». Выберите дальнейшее действие:
Источник