§ 53. Вода — оксид водорода. Пероксид водорода (окончание)
Итак, молекула воды полярна (диполь). Этим объясняется её универсальная способность к растворению всех веществ, имеющих полярное строение. Мы уже вспоминали, что во времена алхимии было сформулировано «золотое правило» растворения: подобное растворяется в подобном. Вода блестяще подтверждает это правило: в ней растворяются оксиды, кислоты, соли, щёлочи — вещества, для которых характерна ионная или полярная ковалентная связь.
Химические свойства воды
1. Взаимодействие воды с металлами. Эти реакции относятся к окислительно-восстановительным. При комнатной температуре с водой реагируют лишь наиболее активные — щелочные и щёлочноземельные — металлы:
При нагревании в реакцию с водой вступают магний и цинк:
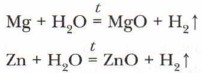
Алюминий будет взаимодействовать только после удаления с его поверхности оксидной плёнки:
Железо вступает в реакцию с водой только при температуре красного каления, образуя оксид металла:
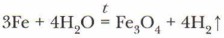
2. Вода взаимодействует с растворимыми кислотными оксидами с образованием соответствующих кислот:
3. Вода взаимодействует с оксидами щелочных и щёлочноземельных металлов с образованием растворимых или малорастворимых в воде оснований:
Пероксид водорода. Помимо воды, существует ещё одно кислородное соединение водорода. Это пероксид (или перекись) водорода. Состав вещества выражается формулой Н2O2. Структурная формула выглядит следующим образом:
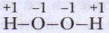
В лаборатории обычно используют 3 %-й и 30 %-й (последний называется пергидролем) растворы пероксида водорода.
Пероксид водорода — очень непрочное химическое соединение. Оно способно разлагаться со взрывом. В результате реакции образуются вода и кислород:
Пероксид водорода — сильный окислитель. Он используется для отбеливания мехов и тканей; в сельском хозяйстве находит применение для протравливания семян с целью их дезинфекции. В медицине 3 %-й раствор пероксида водорода используют в качестве дезинфицирующего средства.
В качестве сильного окислителя Н2O2 применяют в ракетной технике.
Строение молекулы воды • Химические свойства воды
Вопросы и задания



Источник
Водород. Физические и химические свойства, получение

Водород занимает первое место в периодической системе (Z = 1). Он имеет простейшее строение атома: ядро атома – 1 протон, окружено электронным облаком, состоящим из 1 электрона.
В одних условиях водород проявляет металлические свойства (отдает электрон), в других — неметаллические (принимает электрон).
В природе встречаются изотопы водорода: 1Н — протий (ядро состоит из одного протона), 2Н — дейтерий (D — ядро состоит из одного протона и одного нейтрона), 3Н — тритий (Т — ядро состоит из одного протона и двух нейтронов).
Простое вещество водород
Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.
Физические свойства. Водород — бесцветный нетоксичный газ без запаха и вкуса. Молекула водорода не полярна. Поэтому силы межмолекулярного взаимодействия в газообразном водороде малы. Это проявляется в низких температурах кипения (-252,6 0С) и плавления (-259,2 0С).
Водород легче воздуха, D (по воздуху) = 0,069; незначительно растворяется в воде (в 100 объемах H2O растворяется 2 объема H2). Поэтому водород при его получении в лаборатории можно собирать методами вытеснения воздуха или воды.
Получение водорода
1.Действие разбавленных кислот на металлы:
Zn +2HCl → ZnCl2 +H2↑
2.Взаимодействие щелочных и щ-з металлов с водой:
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов: гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
NaH +H2O → NaOH +H2↑
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
5. Электролиз воды. Для увеличения электрической проводимости воды к ней добавляют электролит, например NаОН, Н2SO4 или Na2SO4. На катоде образуется 2 объема водорода, на аноде — 1 объем кислорода.
2H2O → 2H2+О2
Промышленное получение водорода
1. Конверсия метана с водяным паром, Ni 800 °С (самый дешевый):
CH4 + H2O → CO + 3 H2
CO + H2O → CO2 + H2
2. Пары воды через раскаленный кокс при 1000 о С:
С + H2O → CO + H2
CO +H2O → CO2 + H2
Образующийся оксид углерода (IV) поглощается водой, этим способом получают 50 % промышленного водорода.
3. Нагреванием метана до 350°С в присутствии железного или никелевого катализатора:
СH4 → С + 2Н2↑
4. Электролизом водных растворов KCl или NaCl, как побочный продукт:
2Н2О + 2NaCl→ Cl2↑ + H2↑ + 2NaOH
Химические свойства водорода
- В соединениях водород всегда одновалентен. Для него характерна степень окисления +1, но в гидридах металлов она равна -1.
- Молекула водорода состоит из двух атомов. Возникновение связи между ними объясняется образованием обобщенной пары электронов Н:Н или Н2
- Благодаря этому обобщению электронов молекула Н2 более энергетически устойчива, чем его отдельные атомы. Чтобы разорвать в 1 моль водорода молекулы на атомы, необходимо затратить энергию 436 кДж: Н2 = 2Н, ∆H° = 436 кДж/моль
- Этим объясняется сравнительно небольшая активность молекулярного водорода при обычной температуре.
- Со многими неметаллами водород образует газообразные соединения типа RН4, RН3, RН2, RН.
1) С галогенами образует галогеноводороды:
Н2 + Cl2 → 2НСl.
При этом с фтором — взрывается, с хлором и бромом реагирует лишь при освещении или нагревании, а с йодом только при нагревании.
2) С кислородом:
2Н2 + О2 → 2Н2О
с выделением тепла. При обычных температурах реакция протекает медленно, выше 550°С — со взрывом. Смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом.
3) При нагревании энергично реагирует с серойь(значительно труднее с селеном и теллуром):
Н2 + S → H2S (сероводород),
4) С азотом с образованием аммиака лишь на катализаторе и при повышенных температурах и давлениях:
ЗН2 + N2 → 2NН3
5) С углеродом при высоких температурах:
2Н2 + С → СН4 (метан)
6) С щелочными и щелочноземельными металлами образует гидриды (водород – окислитель):
Н2 + 2Li → 2LiH
в гидридах металлов ион водорода заряжен отрицательно (степень окисления -1), то есть гидрид Na + H — построен подобно хлориду Na + Cl —
Со сложными веществами:
7) С оксидами металлов (используется для восстановления металлов):
CuO + H2 → Cu + H2O
Fe3O4 + 4H2 → 3Fe + 4Н2О
8) с оксидом углерода (II):
CO + 2H2 → CH3OH
Синтез — газ (смесь водорода и угарного газа) имеет важное практическое значение, тк в зависимости от температуры, давления и катализатора образуются различные органические соединения, например НСНО, СН3ОН и другие.
9)Ненасыщенные углеводороды реагируют с водородом, переходя в насыщенные:
СnН2n + Н2 → СnН2n+2.
Источник
Водород
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).
Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
Методом газификации угля, торфа, сланца
Электролизом водных растворов щелочей
Каталитическим окислением кислородом (неполное окисление)
Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
Взаимодействием активных металлов с водой
Реакцией цинка или алюминия с раствором щелочи
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных реакция идет только со фтором.
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
Na + H2 → NaH (гидрид натрия)
Химические свойства:
- Реакция с металлами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Реакции с основными и кислотными оксидами
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами — с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой — по аниону (Na2CO3).
Реакция с гидридами активных металлов
Реакции с C, CO, CH4
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)
Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.
В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.
Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник












