- Экологическая химия область исследования и применения
- Экологическая химия атмосферы
- -стратосфера
- Озоновый слой
- -тропосфера
- Токсичные газы
- Кислотный дождь
- Глобальное потепление
- Экологическая химия гидросферы
- -Пресная вода
- -Водный цикл
- -Антропологические воздействия на водный цикл
- Модификация поверхности земли
- Загрязнение водного цикла
- Добыча воды с овердрафтом в водных ресурсах
- Экологическая химия почвы
- Пол
- Антропологические воздействия на землю
- Химико-экологические отношения
- -Модель Гаррелса и Лермана
- Накопление СО2 в атмосфере
- Размер биосферы
- Приложения химии окружающей среды
- Вода и ее химические свойства
- Библиографическое описание:
Экологическая химия область исследования и применения
химия окружающей среды Он изучает химические процессы, которые происходят на уровне окружающей среды. Это наука, которая применяет химические принципы для изучения экологических характеристик и воздействий, вызываемых деятельностью человека..
Кроме того, экологическая химия разрабатывает методы предотвращения, смягчения и восстановления существующего ущерба окружающей среде..
Химия окружающей среды может быть разделена на три основных дисциплины:
- Экологическая химия атмосферы.
- Экологическая химия гидросферы.
- Экологическая химия почвы.
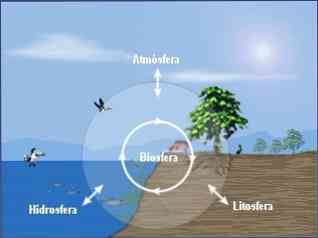
Комплексный подход к химии окружающей среды также требует изучения взаимосвязей между химическими процессами, происходящими в этих трех отсеках (атмосфера, гидросфера, почва), и их связями с биосферой..
- 1 Экологическая химия атмосферы
- 1.1 -Стратосфера
- 1.2 -Тропосфера
- 2 Экологическая химия гидросферы
- 2.1 — Пресная вода
- 2.2 — Водный цикл
- 2.3 — Антропологические воздействия на водный цикл
- 3 Экологическая химия почвы
- 3.1 Почва
- 3.2 Антропологические воздействия на почву
- 4 Отношения между химией и окружающей средой
- 4.1 -Модель Гаррелс и Лерман
- 5 Применение химии окружающей среды
- 6 Ссылки
Экологическая химия атмосферы
Атмосфера — это слой газов, который окружает Землю; это очень сложная система, где температура, давление и химический состав изменяются с высотой в очень широких пределах.
Солнце бомбардирует атмосферу радиацией и частицами высокой энергии; этот факт оказывает очень существенное химическое воздействие на все слои атмосферы, но, в частности, на верхний и внешний слои.
-стратосфера
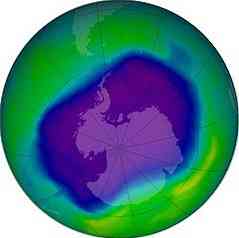
Реакции фотодиссоциации и фотоионизации происходят во внешних областях атмосферы. В области высотой от 30 до 90 км, измеренной от поверхности земли, в стратосфере расположен слой, содержащий в основном озон (ИЛИ3), называемый озоновым слоем.
Озоновый слой
Озон поглощает ультрафиолетовое излучение высокой энергии, которое исходит от Солнца, и если бы не существование этого слоя, ни один из известных способов жизни на планете не мог бы существовать..
В 1995 году химики-атмосферщики Марио Дж. Молина (мексиканец), Фрэнк С. Роуланд (американец) и Пол Крутцен (голландец) получили Нобелевскую премию по химии за исследования по разрушению и истощению озона в стратосфере..
В 1970 году Крутцен показал, что оксиды азота разрушают озон посредством каталитических химических реакций. Впоследствии Молина и Роуланд в 1974 году показали, что хлор хлорфторуглеродных соединений (ХФУ) также способен разрушать озоновый слой.
-тропосфера
Атмосферный слой непосредственно над поверхностью земли, высотой от 0 до 12 км, называемый тропосферой, состоит в основном из азота (N2) и кислород (O2).
Токсичные газы
В результате деятельности человека в тропосфере содержится много дополнительных химических веществ, которые считаются загрязнителями воздуха, таких как:
- Двуокись и окись углерода (СО2 и СО).
- Метан (СН4).
- Оксид азота (NO).
- Диоксид серы (SO)2).
- Озон О3 (считается загрязняющим веществом в тропосфере)
- Летучие органические соединения (ЛОС), порошки или твердые частицы.
Среди многих других веществ, которые влияют на здоровье человека, растений и животных.
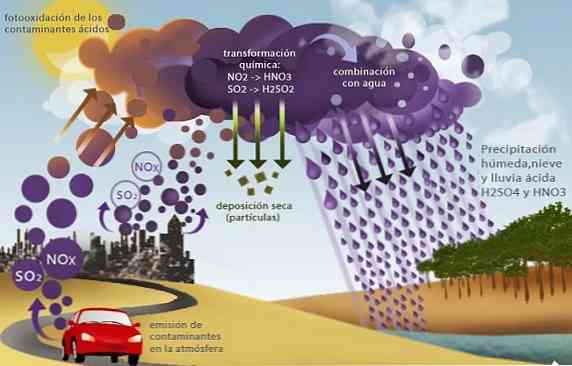
Кислотный дождь
Оксиды серы (SO2 и так3) и азотные, такие как закись азота (NO2), вызвать еще одну экологическую проблему под названием кислотные дожди.
Эти оксиды, присутствующие в тропосфере в основном как продукты сгорания ископаемого топлива в промышленной деятельности и на транспорте, вступают в реакцию с дождевой водой с образованием серной кислоты и азотной кислоты с последующими кислотными осадками.
Высаживая этот дождь, содержащий сильные кислоты, он вызывает ряд экологических проблем, таких как подкисление морей и пресных вод. Это вызывает гибель водных организмов; подкисление почв, что вызывает гибель сельскохозяйственных культур и разрушение вследствие химического коррозионного воздействия зданий, мостов и памятников.
Другие атмосферные проблемы окружающей среды — фотохимический смог, вызванный главным образом оксидами азота и тропосферным озоном.
Глобальное потепление
Глобальное потепление вызвано высокими концентрациями СО2 атмосферные и другие парниковые газы (ПГ), которые поглощают большую часть инфракрасного излучения, испускаемого поверхностью Земли, и задерживают тепло в тропосфере. Это вызывает изменение климата на планете.
Экологическая химия гидросферы
Гидросфера соответствует всем водоемам Земли: поверхностным или огромным — океанам, озерам, рекам, родникам — и подземным или водоносным слоям..
-Пресная вода
Вода является наиболее распространенным жидким веществом на планете, покрывает 75% поверхности Земли и абсолютно необходима для жизни..
Все формы жизни зависят от пресной воды (определяется как вода с содержанием соли менее 0,01%). 97% воды планеты — соленая вода.
Из оставшихся 3% пресной воды 87% находится в:
- Полюса Земли (которые тают и вливаются в моря из-за глобального потепления).
- Ледники (также в процессе исчезновения).
- Подземные воды.
- Вода в форме пара присутствует в атмосфере.
Только 0,4% всей пресной воды планеты доступно для потребления. Испарение воды из океанов и выпадение осадков постоянно обеспечивают этот небольшой процент.
Экологическая химия воды изучает химические процессы, которые происходят в водном цикле или гидрологическом цикле, а также разрабатывает технологии для очистки воды для потребления человеком, очистки промышленных и городских сточных вод, опреснения морской воды, рециркуляции и сохранение этого ресурса, среди прочего.
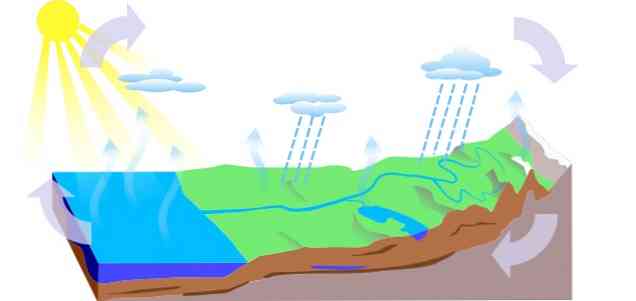
-Водный цикл
Водный цикл на Земле состоит из трех основных процессов: испарения, конденсации и осадков, из которых происходят три контура:
- Поверхностный сток
- Эвапотранспирация растений
- Инфильтрация, при которой вода проходит на подземные уровни (подземные воды), циркулирует через каналы водоносного горизонта и выходит через источники, источники или колодцы..
-Антропологические воздействия на водный цикл
Деятельность человека оказывает влияние на круговорот воды; Некоторые из причин и следствий антропологического действия следующие:
Модификация поверхности земли
Это вызвано уничтожением лесов и полей с обезлесением. Это влияет на круговорот воды, устраняя эвапотранспирацию (забирая воду через растения и возвращаясь в окружающую среду через испарение и испарение) и увеличивая сток.
Увеличение поверхностного стока вызывает увеличение речного стока и наводнений.
Урбанизация также изменяет поверхность земли и влияет на круговорот воды, поскольку пористая почва заменяется цементом и непроницаемым асфальтом, что делает невозможным проникновение.
Загрязнение водного цикла
Водный цикл включает в себя всю биосферу и, следовательно, отходы, генерируемые человеком, включаются в этот цикл различными процессами..
Химические загрязнители в воздухе попадают в дождь. Агрохимикаты, наносимые на почву, страдают от выщелачивания и инфильтрации в водоносные горизонты или стекают в реки, озера и моря.
Кроме того, отходы жиров и масел и выщелачивание свалок вывозятся путем инфильтрации в грунтовые воды..
Добыча воды с овердрафтом в водных ресурсах
Такая практика с использованием овердрафта вызывает истощение запасов подземных и поверхностных вод, влияет на экосистемы и вызывает локальное оседание почвы..
Экологическая химия почвы
Почвы являются одним из важнейших факторов баланса биосферы. Они обеспечивают растения, воду и питательные вещества для растений, которые являются производителями в наземных трофических цепях.
Пол
Почву можно определить как сложную и динамичную экосистему из трех фаз: твердой фазы минерального и органического носителя, водной жидкой фазы и газовой фазы; характеризуется наличием определенной фауны и флоры (бактерии, грибы, вирусы, растения, насекомые, нематоды, простейшие).
Свойства почвы постоянно меняются из-за условий окружающей среды и биологической активности, которая в ней развивается..
Антропологические воздействия на землю
Деградация почвы — это процесс, который снижает продуктивность почвы, способную вызвать глубокие и негативные изменения в экосистеме..
Факторы, которые вызывают деградацию почвы: климат, физиография, литология, растительность и деятельность человека.
В результате действий человека могут возникнуть:
- Физическая деградация почвы (например, уплотнение из-за неадекватного культивирования и практики животноводства).
- Химическая деградация почв (подкисление, подщелачивание, засоление, загрязнение агрохимикатами, стоки от промышленной и городской деятельности, разливы нефти и др.).
- Биологическая деградация почвы (снижение содержания органического вещества, деградация растительного покрова, потеря азотфиксирующих микроорганизмов и др.).
Химико-экологические отношения
Экологическая химия изучает различные химические процессы, которые происходят в трех средах: атмосфере, гидросфере и почве. Интересно рассмотреть дополнительный акцент на простой химической модели, которая пытается объяснить глобальные переносы вещества, которые происходят в окружающей среде..
-Модель Гаррелса и Лермана
Гаррелс и Лерман (1981) разработали упрощенную модель биогеохимии земной поверхности, которая изучает взаимодействие между атмосферой, гидросферой, земной корой и включенными биосферными отсеками..
Модель Гаррелса и Лермана рассматривает семь основных составляющих минералов планеты:
Органическое вещество, составляющее биосферу (живое и мертвое), представлено как СН2Или, который является приблизительным стехиометрическим составом живых тканей.
В модели Гаррелса и Лермана геологические изменения изучаются как чистые переносы вещества между этими восемью компонентами планеты посредством химических реакций и чистого баланса сохранения массы..
Накопление СО2 в атмосфере
Например, проблема накопления СО2 в атмосфере изучается по этой модели, утверждая, что: в настоящее время мы сжигаем органический углерод, хранящийся в биосфере в виде угля, нефти и природного газа, отложенных в недрах в прошлые геологические времена.
В результате этого интенсивного сжигания ископаемого топлива концентрация СО2 Атмосфера увеличивается.
Увеличение концентрации СО2 в земной атмосфере это происходит потому, что скорость сжигания ископаемого углерода превышает скорость поглощения углерода другими компонентами биогеохимической системы Земли (например, фотосинтезирующими организмами и гидросферой).
Таким образом, выброс СО2 в атмосферу в результате деятельности человека, превосходит регуляторную систему, которая модулирует изменения на Земле.
Размер биосферы
Модель, разработанная Гаррелсом и Лерманом, также считает, что размер биосферы увеличивается и уменьшается в результате баланса между фотосинтезом и дыханием..
В течение истории жизни на Земле масса биосферы увеличивалась поэтапно с высокими показателями фотосинтеза. Это привело к чистому хранению выбросов органического углерода и кислорода:
Дыхание как метаболическая активность микроорганизмов и высших животных, превращает органический углерод обратно в диоксид углерода (CO2) и вода (H2О), то есть полностью изменяет предыдущую химическую реакцию.
Наличие воды, хранение органического углерода и производство молекулярного кислорода имеют основополагающее значение для существования жизни.
Приложения химии окружающей среды
Экологическая химия предлагает решения для предотвращения, смягчения и устранения ущерба окружающей среде, вызванного деятельностью человека. Среди некоторых из этих решений мы можем упомянуть:
- Дизайн новых материалов под названием MOF’s (для его аббревиатуры на английском языке: Металлические Органические Каркасы). Они очень пористые и обладают способностью: поглощать и удерживать СО2, получить H2Или пары воздуха из пустынных районов и хранилища H2 в маленьких контейнерах.
- Переработка отходов в сырье. Например, использование изношенных шин при производстве искусственной травы или подошв для обуви. Также использование отходов обрезки сельскохозяйственных культур, при производстве биогаза или биоэтанола.
- Химический синтез заменителей ХФУ.
- Развитие альтернативных источников энергии, таких как водородные элементы, для производства чистого электричества.
- Контроль загрязнения атмосферы с помощью инертных фильтров и реактивных фильтров.
- Опреснение морской воды методом обратного осмоса.
- Разработка новых материалов для флокуляции коллоидных веществ, взвешенных в воде (процесс очистки).
- Возврат эвтрофикации озер.
- Развитие «зеленой химии», тенденции, предполагающей замену токсичных химических соединений менее токсичными, и «экологически чистые» химические процедуры. Например, он применяется при использовании менее токсичных растворителей и сырья, в промышленности, при химической чистке прачечных и других..
Источник
Вода и ее химические свойства
Дата публикации: 25.02.2019 2019-02-25
Статья просмотрена: 6385 раз
Библиографическое описание:
Калякин, С. Н. Вода и ее химические свойства / С. Н. Калякин, С. Л. Покутняя. — Текст : непосредственный // Юный ученый. — 2019. — № 3 (23). — С. 20-23. — URL: https://moluch.ru/young/archive/23/1404/ (дата обращения: 21.10.2021).
Понять воду, значит понять Вселенную.
Масару Эмото (1943–2014), японский исследователь
Вода — один из самых распространённых соединений на нашей планете. Именно она является главной составляющей всего живого на планете, но также вода входит в состав комет, большинства планет солнечной системы и их спутников. Без воды нет жизни: ведь жизнь на Земле появилась только тогда, когда на ней появилась вода. Вся жизнь зародилась в воде, поскольку она является естественным универсальным растворителем, а значит вода растворяет питательные вещества и обеспечивает ими клетки живых организмов. Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75 % от общей массы. По примерным подсчетам ученых на планете 1.4087 млрд. км 3 воды (причем соленой воды от общего объема примерно 97 %, пресной всего 3 %).
Да и сам человек на 60–80 % (в зависимости от возраста) состоит из воды. Большая часть воды — это кровь, жидкость в выделительной системе, мускулах, мозге и других органах, а также в костях и коже.
В понятии химии вода — это H2O, то есть две молекулы водорода и одна молекула кислорода. Но это дистиллированная вода. В природе вода содержит различные примеси и очень редко встречается в чистом виде. При взаимодействии водорода с кислородом происходит выделение большого количества тепла. Это соединение очень устойчивое, молекулы которого распадаются только при температуре 1500°С.
Каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Оксид построен в форме тетраэдра — атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма. Угол между центром атома кислорода и ядрами водородов составляет 104,5 0 . Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды — диполь. Это определяет то, какой может быть вода и ее свойства. Для живых существ эти особенности играют жизненно важную роль.
Рис. 1 Строение атома воды и оксид в виде тетраэдра
Вода — весьма активное в химическом отношении вещество. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ, именно поэтому вода — это определяющий характер химии. Вода имеет различные физические и химические свойства, но посмотрим на воду с химической точки зрения.
- Биохимические свойства воды.
Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой. Вода способна растворять некоторые кислоты, основания и соли, представляющие ионные соединения и некоторые полярные неионные образования (простые спирты, сахара и аминокислоты). Благодаря воде сохраняется упругость и объем живой клетки, многие химические процессы организма протекают именно в водных растворах. Эти свойства дают клеткам теплопроводимость и теплоемкость, обеспечивающие терморегуляцию и защищает от температурных перепадов.
Без воды невозможен гидролиз — химическая реакция, которая сопровождает усвоение белков, жиров, углеводов, а ведь именно они являются обязательным компонентом нашей пищи, так, например, белок распадается на аминокислоты, углевод на глюкозу, жиры на глицерин. В результате этого процесса сложные органические вещества распадаются до простых веществ, которые, легко усваиваются живым организмом.
- Вода-растворитель
Вода является наиболее распространённым растворителем на нашей планете. По растворимости в воде вещества делятся на три группы:
1) Хорошо растворимые: (сахар (С12Н22О11), гидроксид натрия (NaOH), спирт (C2H5OH), хлороводород (HCl).
2) Мало растворимые: (гипс, сульфат свинца (PbSO4), бензол (C6H6), метан (СH4), кислород).
3) Практически не растворимые: (стекло, серебро (Ag), золото (Au), керосин, растительное масло).
Из этого можно сделать вывод, что растворимость вещества прежде всего зависит от природы этого вещества, а также от температуры и давления окружающей среды. Сам процесс растворения обуславливается взаимодействием частиц растворителя и растворяемого вещества.
- Вода— активное химическое вещество.
Вода может взаимодействовать:
1) с металлами с выделением водорода:
− с активными 2Na + 2H2O → H2 + 2NaOH (бурно)
− со средней активностью до H 3Fe + 4H2O → 4H2 + Fe3O4 (только при нагревании)
− с малоактивными после H (не взаимодействуют) Cu+ H2O ≠
Достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
2) с неметаллами:
Из неметаллов с водой реагируют углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O → H2 + CO (при сильном нагревании)
3) с оксидами неметаллов:
Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
4) с оксидами металлов
Некоторые оксиды металлов также могут вступать в реакции соединения с водой.
CaO+ H2O → Ca(OH)2 гидроксид кальция (гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует: ZnO, TiO2, Cr2O3, из которых изготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) с газами
Как говорилось в подпункте 4 вода взаимодействует с оксидами неметаллов. В данном случае CO2 — это газ. Если струю газообразного оксида углерода (IV) CO2 направить в воду, то часть его раствориться в ней. В этом растворе произойдет химическая реакция соединения и образуется вещество — угольная кислота H2CO3. Собирая углекислый газ над водой, ученый Джозеф Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути, Пристли впервые получил напиток газированный или содовой воды. Позже ученый Торберн Бергман создал аппарат, позволяющий насыщать жидкость углекислым газом под давлением и назвав его сатуратором.
Рис. 2 Джозеф Пристли и его прибор для исследования газов.
6) Гидраты.
Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом.
NaOH + H2O → NaOH . H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью удаляют водяные пары из влажного атмосферного воздуха.
7) Фотосинтез растений.
Фотосинтез — процесс, протекающий в зеленных листьях растений с использованием энергии света, при котором из углекислого газа и воды образуются органические вещества и кислород. Синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
Рис. 3. Фотосинтез растений, как химическая реакция.
8) Электролиз воды.
Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду — отрицательно заряженные анионы.
Схема электролиза воды:
Вода — слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока, катионы которого будут иметь меньший электродный потенциал, чем H+ воды.
- Минерализация воды
Минерализация — это показатель количества содержащихся в воде растворенных веществ (неорганические соли неорганические вещества). Как правило, это бикарбонаты, хлориды, сульфаты кальция, магния, калия, натрия и других веществ. Минерализацию считают в грамм на литр (г/л) или грамм на дециметр в кубе (г/дм 3 ). С точки зрения бальнеологии по степени минерализации воду классифицируют на:
− Столовую — минерализация до 1 г/л
− Лечебно-столовую — минерализация от 1 г/л до 10 г/л
− Лечебная — минерализация более 10 г/л или высокое содержание биологически активных элементов: железо, брома, йода, сероводорода, фтора и т. д., при этом общая минерализация может быть невысокой.
Свойство минерализации основано на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
- Жесткость воды.
Жесткость воды — совокупность свойств, обусловленных содержанием в воде катионов кальция Ca 2+ и магния Mg 2+ (так называемых солей жесткости).
Из-за разного объема различных примесей в воде, она делится на два типа-жесткую и мягкую. Соли попадают в воду из-за того, что часть дождевых вод превращаются в грунтовую воду. Они протекают в недрах Земли, соприкасаются с минералами кальция и магния, вымывая из них мелкие частички. В воде, насыщенной углекислотой, карбонаты калия и магния растворяются, так как превращаются в кислые соли. В таком растворимом виде гидрокарбонаты металлов остаются в воде и обуславливают временную жесткость. При кипячении такой воды гидрокарбонаты разлагаются и выпадают в осадок. Но также существует постоянная жесткость, обуславливая присутствием в природной воде растворимых хлоридов и сульфатом кальция и магния. Жесткость воды количественно выражают числом ммоль эквивалентов (ммоль/экв) ионов кальция Ca 2+ и магния Mg 2+ .
В жесткой воде плохо мылится мыло, которое представляет собой натриевые соли высших карбонатных кислот. Для устранения жесткости воды (ее умягчения) необходимы ионы Ca 2+ и Mg 2+ перевести в осадок. Временную карбонатную жесткость устраняют кипячение:
Ca(HCO3)2 
Постоянную жесткость кипячением устранить нельзя. Для этого добавляют в воду смесь гашенной извести Ca(OH)2 или соды Na2CO3
Са(НСО3)2 + Са(ОН)2 → 2СаСO3↓ + 2Н2O
- Теория Льюиса
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания. С точки зрения теории Льюиса — вода — это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоторой амфотерности воды в химических свойствах.
Подводя итог вышесказанного можно сказать, что вода — это самое уникальное вещество на земле. Академик Владимир Иванович Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы с ней сравниться по влиянию на ход основных, самых грандиозных, геологических процессов. Не только земная поверхность, но и глубокие — в масштабе биосферы — части планеты определяются, в самых существенных своих проявлениях, ее существованием и ее свойствами». Действительно, нет более важного для нас вещества на Земле, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, как в свойствах воды.
Источник