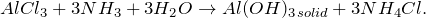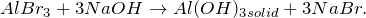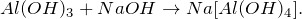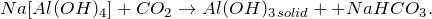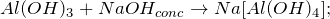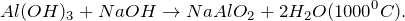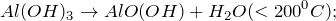- Аммиак. Задача № 34 из ФИПИ 2020 с объяснениями
- AlCl3 + NH3 + H2O = ? уравнение реакции
- Как протекают различные химические процессы
- Уравнения реакций хлорида алюминия с аммиаком и щелочью
- Расчет энергии Гиббса
- Определение массы электрода гальванического элемента
- Хлорид алюминия аммиачная вода
- Гидроксид алюминия: получение и свойства
- Гидроксид алюминия
- Способы получения
- Химические свойства
Аммиак. Задача № 34 из ФИПИ 2020 с объяснениями
Сегодня мы будем решать и разбирать очередную задачу № 34 из ЕГЭ 2020 года.
Задача:
Насыщенный раствор хлорида алюминия (растворимость 46 грамм в 100 граммах воды при 20 С) массой 50,85 грамм разлили в две колбы: в первую добавили избыток раствора Na2CO3, во вторую 20,4 грамма 25%-ного раствора аммиака. Во второй колбе осадок в 2 раза тяжелее, чем в первой. Найдите концентрацию аммиака во второй колбе после окончания реакции.
Решение:
Для начала необходимо составить уравнения химических реакций (как и в других реакциях, где есть химический процесс).
В условии сказано, что есть хлорид алюминия (AlCl3), который разлили в две колбы: в первой был раствор карбонат натрия, во второй — раствор аммиака.
Если ты забыл как аммиак реагирует с различными веществами, в то числе, с солями, рекомендую освежить знания по теме: Аммиак
А пока мы запишем две реакции:
Объяснять, как уравнивать я не буду, ты это уже знаешь.
А по поводу воды в этих двух реакциях уточняю: если у тебя в условии указан раствор какого — то вещества, то химическая реакция однозначно будет с участием H2O .
Идем дальше!
Первое вещество, с которого мы начнем расчеты — это хлорид алюминия.
Сначала ищем его массу с учетом растворимости (см. условие), для этого составляем пропорцию:
46 / (46 + 100) = x / 50,85,
x = 46 * 50,85 / 146 = 16,02 грамм.
Теперь находим количество вещества AlCl3:
Молярная масса хлорида алюминия (по таблице ПСЭ) равна 133,5 грамм/ моль; n (AlCl3) = 16,02 / 133,5 = 0,12 моль.
Мы нашли моль AlCl3, но вопрос — к какой именно реакции его отнести?
У нас ведь две реакции, с карбонатом натрия и аммиаком, и в обеих есть хлорид алюминия.
Как же быть? Верный ответ — 0,12 моль представляет собой общее количество хлорида, и нужно составить маленькое уравнение (без него никак):
Возьмем количество AlCl3 из первой реакции за x, а этот же хлорид из второй реакции — за y.
В итоге пишем: x + y = 0,12 моль.
Если посмотреть на данные химические реакции, то заметим, что количество хлорида алюминия в первой и второй реакциях не равны:
— в первой перед AlCl3 стоит 2,
— во второй — 1.
Это означает, что мы имеем две соли, которые взяты в неравных количествах, и данную деталь нельзя игнорировать.
Поэтому, пишем так: y = 2x.
Теперь соединяем эти два действия в одно уравнение:
Решив их, получаем:
Что делаем теперь?
Через количество хлорида алюминия мы можем найти все остальное, но нам не нужно искать все вещества, мы ищем аммиак:
1) Вначале вычисляем массу аммиака (чистого): m (NH3) =0,25 * 20,4 = 5,1 грамм.
(По условию аммиак был взят 25%-й в массой 20,4 грамма, нужно узнать его чистую массу)
2) Молярная масса аммиака: 17 грамм / моль; n (NH3) = 5,1 / 17 = 0,3 моль.
3) Теперь необходимо узнать, сколько аммиака прореагировало. Но здесь есть вопрос — а как мы это узнаем?
Ответ прост: по уравнению, моль хлорида алюминия (по которому мы и находим все остальные вещества) во второй реакции = 0,08 моль. Значит, моль аммиака будет в три раза больше (см. на реакцию, перед аммиаком стоит цифра 3).
Путем нехитрого действия находим: 0,08 моль * 3 = 0,24 моль.
4) Далее вычитаем от начального количества аммиака его прореагировавшее количество: 0,3 — 0,24 = 0,06 моль.
Так как аммиак взят в избытке, то решаем по недостатку(Al(OH)3 по второй реакции). Однако, без аммиака нельзя, так как в задаче его и нужно найти.
5) Следующим шагом находим массу аммиака: 0,06 * 17 = 1,02 грамма.
В условии задачи необходимо найти массовую долю аммиака, но без массы это невозможно.
Следующий шаг.
С NH3 мы пока закончили, на очереди — гидроксид алюминия (Al(OH)3) , который выпал в осадок, и мы не имеем права не учитывать его по причине того, что при нахождении общей массы раствора необходимо убрать все вещества, которые являются осадками или газами.
1) Получим его моль: n (Al(OH)3) = n (AlCl3) = 0,08 моль.
Смотри на вторую реакцию, перед гидроксидом алюминия, как и перед хлоридом алюминия нет коэффициентов, а значит, их взято одинаковое количество, отсюда и равное число моль.
2) Молярная масса Al(OH)3 = 78 грамм / моль; m ( Al(OH)3 ) = 0,08 * 78 = 6,24 грамм.
Далее:
Учитывая, что моли хлорида алюминия в двух реакциях одинаковы, значит, концентрация так же одинакова.
0,12 / 50,85 = 0,08 / x;
x = 0,08 * 50,85 / 0,12 = 33,9 грамм.
Рассмотрим подробнее данное действие:
- 0,12 — это моль хлорида алюминия (общий),
- 50,85 — это масса AlCl3 по условию (общая),
- 0,08 моль — это количество вещества хлорида алюминия.
Через пропорцию находим массу AlCl3.
Осталось самое последнее действие!
Найдем массовую долю аммиака:
ω (NH3) = 1,02 / (33,9 + 20,4 – 6,24) = 1,02 / 48,06 = 0,0212, или 2,12%.
Здесь мы делим полученную массу аммиака на массу раствора (без осадка).
Массу раствора найдем по формуле:
масса хлорида алюминия + масса аммиака — осадок Al(OH)3 .
Источник
AlCl3 + NH3 + H2O = ? уравнение реакции
Подскажите, какое вещество образуется в результате взаимодействия хлорида алюминия с водным раствором аммиака (AlCl3 + NH3 + H2O= ?). Приведите основные физические параметры твердого продукта реакции, расскажите о химических свойствах и его способах получения.
В результате взаимодействия хлорида алюминия с водным раствором аммиака (AlCl3 + NH3 + H2O= ?) наблюдается выпадение студенистого осадка белого цвета – гидроксида алюминия, также происходит образование средней соли – хлорида аммония. Молекулярное уравнение реакции имеет вид:
Гидроксид алюминия представляет собой термически неустойчивый порошок белого цвета. Не растворяется в воде. Он существует в виде четырех полиморфных модификаций, каждую из которых можно выделить при конкретной температуре.
Гидроксид алюминия может быть получен обработкой солей алюминия щелочами.
В этом случае необходимо избегать избытка щелочи, в которой гидроксид алюминия растворяется:
При слабом подкислении тетрагидроксоалюмината разрушаются:
Гидроксид алюминия – типичный амфотерный гидроксид. С кислотами он образует соли, содержащие катион алюминия, со щелочами – алюминаты; при взаимодействии с водными растворами щелочей образуются гидроксоалюминаты:
При нагревании гидроксид алюминия разлагается.
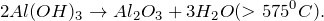
Источник
Как протекают различные химические процессы
Уравнения реакций хлорида алюминия с аммиаком и щелочью
Задача 1052.
Чем различается действие избытка водных растворов NH3 и NаОН на раствор АIСI3? Написать уравнения соответствующих реакций.
Решение:
При действии избытка водного раствора аммиака на хлорид алюминия образуется гель гидроксида алюминия:
При действии избытка водного раствора гидроксида натрия на хлорид алюминия образуется комплексный ион [Al(OH)4(H2O)2] − :
Расчет энергии Гиббса
Задача 1053.
Пользуясь табличными данными приложения, установить, возможно ли самопроизвольное протекание реакции:
4А1 + 3СО2 = 2А12О3 + 3С.
Решение:
Уравнение реакции:
Находим стандартные значения энергии Гиббса образования веществ, участвующих в реакции из таблиц, учитывая, что значения энергии Гиббса простых веществ равны нулю. ΔG 0 (СО2) = -394,6 кДж/моль; ΔG 0 (Al2O3) = -1583,3 кДж/моль.
ΔG 0 = 2ΔG 0 (Al2O3) — 3ΔG 0 (СО2) = 2(-1583,3) – 3(-394,6) = -19823,8 кДж.
Определение массы электрода гальванического элемента
Задача 1054.
При работе гальванического элемента: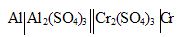
Решение:
MЭ(Al 3+ ) = M(Al 3+ )/3 = 26, 981/3 = 8,999 г/моль; MЭ(Cr 3+ ) = M(Cr 3+ )/3 = 51,998/3 = 17,332 г/моль.
При работе гальванического элемента на электродах, согласно закону эквивалентов, происходит эквивалентное окисление и восстановление металлов, получим:
Находим массу алюминия, на которую уменьшился алюминиевый электрод, получим:
m(Al) = m(Cr 3+ )/MЭ(Cr 3+ ) . MЭ(Al 3+ ) = 31,2/17,332 . 8,999 = 16,198 г.
Источник
Хлорид алюминия аммиачная вода
Задача 1. Запишите уравнения реакций взаимодействия между следующими веществами:
а) растворами нитрата алюминия и сульфида натрия;
б) растворами хлорида алюминия и аммиака.
А) В результате взаимодействия растворов нитрата алюминия и сульфида натрия образуются гидроксид алюминия, сероводород и нитрат натрия; образование сульфида алюминия по обменной реакции не происходит вследствие взаимного усиления гидролиза ионов Al 3+ и S 2- :
Б) При взаимодействии растворов хлорида алюминия и аммиака образуется гидроксид алюминия и хлорид аммония:
Задача 2. При полном растворении алюминия в 200 г раствора соляной кислоты образовалось 23,52 л водорода (н. у.) (кислота прореагировала полностью). Вычислите массовую долю хлорида алюминия в полученном растворе.
Запишем уравнение реакции взаимодействия алюминия с соляной кислотой:
Для определения массовой доли хлорида алюминия в полученном растворе необходимо знать массу образовавшегося хлорида алюминия и массу раствора:

Вычислим массу образовавшегося хлорида алюминия. По уравнению реакции 2 моль хлорида алюминия соответствует 3 моль водорода. Определим количество вещества, выделившегося водорода:
следовательно, образовалось 0,7 моль хлорида алюминия (1,05 · 2/3 = 0,7). Вычислим массу хлорида алюминия:
Масса полученного раствора сложится из массы образовавшегося хлорида алюминия и воды, которая содержалась в растворе кислоты. Вычислим массу воды. По уравнению реакции 6 моль HCl соответствует 3 моль водорода; если образовалось 1,05 моль водорода, то прореагировало 2,1 моль HCl (1,05 · 2 = 2,1). Масса прореагировавшего HCl равна:
m (HCl) = n (HCl) · M (HCl) = 2,1 · 36,5 = 76,65 (г),
тогда масса воды, содержащейся в растворе кислоты, равна:
Определим массовую долю хлорида алюминия в полученном растворе:

Источник
Гидроксид алюминия: получение и свойства
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например , хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например , хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например , гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли . При этом гидроксид алюминия проявляет кислотные свойства.
Например , гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
4. Г идроксид алюминия разлагается при нагревании :
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Источник