- Хлорид аммония
- Характеристики и физические свойства хлорида аммония
- Получение хлорида аммония
- Химические свойства хлорида аммония
- Применение хлорида аммония
- Примеры решения задач
- Хлорид аммония
- Содержание
- Физические свойства
- Химические свойства
- Получение
- Хлорид аммония — формула, свойства и применение вещества
- Основные понятия о соединении
- Физические свойства NH4CL
- Химические особенности связи
- Получение и практическое применение
- Синтезирование вещества
- Использование хлорида аммония
- Роль в медицине
Хлорид аммония
Характеристики и физические свойства хлорида аммония
Рис. 1. Хлорид аммония. Внешний вид.
Основные характеристики хлорида аммония приведены в таблице ниже:
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Растворимость в воде (20 o С), г/100 мл
Получение хлорида аммония
Получение хлорида аммония в промышленных масштабах заключается в упаривании маточного раствора, остающегося после отделения гидрокарбоната натрия, образующегося по следующей реакции:
В лабораторных условиях эту соль получают, используя такие реакции, как
Химические свойства хлорида аммония
Хлорид аммония – это средняя соль, образованная слабым основанием – гидроксидом аммония (NH4OH) и сильной кислотой – соляной (хлороводородной) (HCl). В водном растворе гидролизуется. Гидролиз протекает по катиону. Наличие катионов Н + свидетельствует о кислом характере среды.
NH4 + + Cl — + HOH ↔ NH4OH + Cl — + H + ;
При нагревании хлорид аммония как бы возгоняется – разлагается на аммиак и хлороводород, которые на холодных частях сосуда вновь соединяются в хлорид аммония:
Хлорид аммония разлагается концентрированной серной кислотой и щелочами:
Он реагирует с хлором (1), типичными металлами (2), оксидами (3) и нитритами металлов (4):
NH4Cl + 3Cl2 = Cl3N↑ + 4HCl (t = 60 – 70 o C) (1);
2NH4Cl + 4CuO = N2 + 4H2O + CuCl2 + 3Cu (t = 300 o C) (3);
Применение хлорида аммония
Хлорид аммония, или нашатырь, применяется в красильном деле, в ситцепечатании, при паянии и лужении, а также в гальванических элементах. Применение хлорида аммония при паянии основано на том, что он способствует удалению с поверхности металла оксидных пленок, благодаря чему припой хорошо пристает к металлу. При соприкосновении сильно нагретого металла с хлоридом аммония оксиды, находящиеся на поверхности металла, либо восстанавливаются, либо переходят в хлориды. Последние, будучи более летучи, чем оксиды, удаляются с поверхности металла. Для случая меди и железа основные происходящие при этом процессы можно выразить такими уравнениями:
Примеры решения задач
| Задание | Какую массу хлорида аммония можно получить при взаимодействии 17,7 г хлороводорода и 12 л аммиака (н.у.)? Какой объем 0,06М раствора можно приготовить из этой массы соли? |
| Решение | Запишем уравнение реакции: |
Найдем количество моль хлороводорода (молярная масса – 36,5 г/моль) и аммиака, вступивших в реакцию используя данные указанные в условии задачи:
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 17,7 / 36,5 = 0,5моль.
n (NH3) = 12 / 22,4 = 0,54 моль.
Согласно уравнению задачи n (HCl):n (NH3) = 1:1. Это означает, что аммиак находится в избытке и все дальнейшие расчеты следует вести по хлороводороду. Найдем количество вещества и массу образовавшегося хлорида аммония (молярная масса 53,5 г/моль):
n (NH4Cl) = n (HCl) = 0,5моль.
Рассчитаем объем 0,06М раствора, который можно получить из 26,75 г хлорида аммония:
| Задание | Вычислите массовую долю хлорида аммония в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18г/моль): |
m (H2O)= 20 × 18 = 360 г.
Рассчитаем массу раствора хлорида аммония:
msolution(NH4Cl) = 40 + 360 = 400 г.
Вычислим массовую долю хлорида аммония в растворе:
ω (NH4Cl)=40 / 400 × 100% = 10%.
| Понравился сайт? Расскажи друзьям! | |
| Систематическое наименование | Хлорид аммония |
|---|---|
| Хим. формула | NH4Cl |
| Состояние | бесцветные кубические кристаллы |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| Т. плав. | возгонка при 337,6 °C |
| Т. субл. | 662 ± 1 градус Фаренгейта |
| Энтальпия образования | -314,2 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст. |
| Растворимость в воде | (при 20 °C) 37,2 г/100 мл |
| Рег. номер CAS | ГОСТ 3773-72 ГОСТ 2210-73 |
| Рег. номер CAS | [12125-02-9] |
| PubChem | 25517 |
| Рег. номер EINECS | 235-186-4 |
| SMILES | |
| Кодекс Алиментариус | E510 |
| RTECS | BP4550000 |
| ChEBI | 31206 |
| ChemSpider | 23807 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлорид аммония (хлористый аммоний; техническое название — нашатырь; NH4Cl) — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
Физические свойства
Бесцветные или белые кубические кристаллы. Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Химические свойства
- реагирует с щелочами с выделением аммиака:
NH4Cl + NaOH → NaCl + H2O + NH3↑
- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света:
NH4Cl + AgNO3 → AgCl↓ + NH4NO3
- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
NH4Cl + NaNO2 → NaCl + N2↑ + 2H2O
- под действием электрического тока разлагается с образованием хлористого азота NCl3
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Реакция взаимодействия аммиака и соляной кислоты:
Источник
Хлорид аммония — формула, свойства и применение вещества
Основные понятия о соединении
О том, что представляет собой рассматриваемая химическая связь, можно понять уже по одной только структурной формуле хлорида аммония — NH4CL, притом что это вещество реально получить не только посредством искусственного синтезирования, но и в природной среде, в которой он представляется в виде минерального нашатыря. При нормальном температурном режиме являет собой белые кристаллы без запаха и присутствия соли.
Физические свойства NH4CL
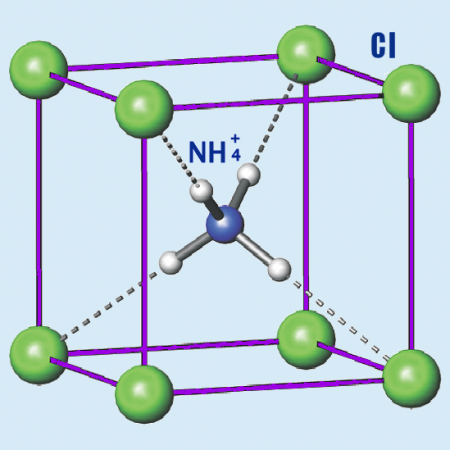
Объем одной кубической сингонии хлористого аммония, под которой подразумевается элементарная ячейка кристалла, определяется по актуальной для простейшего геометрического куба формуле, где a возводится в третью степень. Чтобы вычислить эту величину рассматриваемого соединения, достаточно просто знать, чему равно a, которое является константой, соответствуя 0,38758 нанометра при z=1. Что касается остальных физических свойств и параметров, то среди ключевых из них стоит выделить:
- Показатель относительной плотности взаимодействия азота, водорода и хлора, дающего хлорид аммония, равен 1,526 кг на метр кубический.
- Молярная масса хлорида аммония соответствует 53,5 грамма на моль.
- Сохранение структуры кубической кристаллизации наблюдается при любых температурах до отметки в плюс 184,3 градуса Цельсия. При дальнейшем нагревании имеет свойство быстро улетучиваться. К примеру, уже после достижения столбика термометра 337, 6 градуса вещество моментально возгоняется, переходя из твердого состояния в летучий газ даже без промежуточного преобразования в жидкий раствор. При этом связь не остается в исходном виде, так как высокие температуры приводят к разложению хлорида аммония на такие вещества, имеющие высокий класс опасности, как чистый аммиак и соляная кислота.
- При замерзании образует ионную кристаллическую решетку. Что касается температурного режима, при котором происходят подобные изменения, то обычно все зависит от концентрации раствора и, к примеру, 10-процентная жидкость кристаллизуется уже при минус 6,95 градусах Цельсия.
Среди прочих особенностей NH4CL стоит выделить его высокую степень растворимости как в холодной, так и в горячей воде. К примеру, при нулевой температуре жидкости в ее 100 граммах растворяется 29,4 грамма вещества, тогда как в кипятке расходится уже 77,3 грамма. Стоит отметить, что, помимо обычной воды, соединение легко растворяется в жидком аммиаке, а также в безводных растворителях, но только при условии использования связи в порошкообразном виде, а не в концентрированном водном растворе.
В этом случае в 100 граммах этанола удастся растворить до 0,6 грамма кристаллов, а в метаноле до 3,3 грамма. Если же использовать водные растворы, то в процессе гидролиза, подразумевающего собой сольволиз водой, в них будет неизменно наблюдаться слабокислая реакция.
Что касается температуры кипения таких растворов, то она превышает стандартные 100 градусов, достигая на столбике термометра отметки в 116 градусов Цельсия.
Химические особенности связи
Вещество имеет множество химических особенностей, среди которых — вступление в реакцию со щелочными соединениями. К примеру, с тем же нитритом натрия хлористый аммоний начинает реагировать при достижении 100-градусной температуры, образуя не только воду и азот, но и новое соединение хлорида и натрия. Среди прочих свойств связи стоит необходимо обозначить:
- Если пропустить через соединение разряд электрического тока, то произойдет его разложение с дальнейшим преобразованием в хлористый азот (NCL3).
Гидролиз хлорида аммония происходит только по катиону при устойчивом поддержании кислой среды. В этом случае актуальным будет следующее уравнение: NH4Cl + H2O ↔ NH4OH +HCl.
Помимо прочего, связь имеет свойство вступать в реакцию с азотнокислым серебром (NH4CL+AgNO3 → AgCl ↓ +NH4NO3) и нитритом натрия (NH4CL+NaNO2 → NaCl+N2 ↑ +2H20). В первом случае в качестве реакции можно наблюдать выпадение хлористого серебра в виде характерного белого осадка, который моментально темнеет при воздействии естественных источников света, тогда как для второго актуальным остается разложение на натрия хлорид, воду и азот.
Получение и практическое применение
Удивительно, но хлористый аммиак научились добывать еще древние греки и египтяне, соскребавшие ценное вещество со стен застывших вулканических пород. Естественно, сегодня технологии таковы, что использовать подобные природные образования для того, чтобы получать нашатырь, не приходится.
Синтезирование вещества
В настоящее время хлорид аммония добывают в промышленных масштабах для разных нужд, используя для этого такой универсальный метод, как нагревание и упаривание маточного раствора, для получения которого приходится добиваться других химических реакций. Речь идет о выработке сырьевых остатков, образующихся в процессе разложения соединения гидрокарбоната натрия, а попросту пищевой соды, для чего необходимо пропустить диоксид углерода (углекислый газ) через раствор натрия хлорида и аммиака.
Если же на повестке дня стоит вопрос синтезирования соединения в лабораторных условиях, то тогда можно ограничиться более простыми решениями, которые чаще всего сводятся к соединению хлорводорода с аммиаком, предварительно пропускаемых через раствор натрия хлорида. Кроме того, вполне реально вывести связь посредством прямого контакта таких элементов, как аммиак и хлор.
Стоит отметить, что в современной химической промышленности активно используются всевозможные производные соединения, будь то диметиламмоний, метиламмоний, этиламмоний и прочие вариации. Объясняется такой спрос довольно просто, ведь они получили широкое применение в фармакологии, легкой и пищевой промышленности, виноделии и других производственных сегментах, продолжая находить для себя новые сферы использования.
Использование хлорида аммония
В Древнем Египте хлористый аммоний использовался в качестве ароматных курений для божества по имени Аммоний, откуда, собственно, и пошло наименование самого вещества. Чуть позже его применение освоили и на Востоке, так как название «нашатырь» имеет арабское происхождение. Научно-технический прогресс расширил сферы применения соединения, продолжая открывать для него новые горизонты. Так, в настоящее время NH4CL активно используется в следующих сферах с соблюдением всех соответствующих ГОСТов:
- В качестве универсального азотного удобрения с процентным содержанием основного элемента, составляющего четверть от общей доли. Минеральная добавка идеально подходит для щелочных почвенных пород, слабо реагирующих на перенасыщение хлором, при посадке таких популярных культур, как рис, сахарная свекла, кукуруза и пр.
- В пищевой промышленности используется в качестве стабилизатора E510 и как усилитель вкуса, входящий в состав лакричных сладостей в Финляндии и некоторых странах Скандинавии.
- В металлургической промышленности применяется в качестве флюса, используемого для пайки и очищения поверхности от образующейся оксидной пленки с железа, меди и других металлов и сплавов. Кроме того, вещество может быть задействовано для обеспечения электролитного компонента в отдельных гальванических элементах, эксплуатируемых как химический источник электрического тока.
Соединение имеет довольно широкую область применения и во многих других сферах. К примеру, сегодня его активно используют для изготовления красителей в легкой промышленности, печати на ситце и других тканях, в лужении, для проведения лабораторных исследований, для дымообразования, проявления фотографических пленок, так как связь прекрасно фиксирует изображение, и пр.
Роль в медицине
Нельзя не отметить и фармакологические свойства вещества, которое обладает довольно мощным отхаркивающим и диуретическим эффектом. В виде медикаментозного препарата хлористый аммоний быстро абсорбируется стенками кишечника, проникая в общий кровяной ток, и метаболизируется в печени до состояния мочевины, после чего наступает период полураспада и вывод из организма. При этом может наблюдаться подкисление урины и учащенное мочеиспускание без изменений выделяемого объема в меньшую сторону. Во время каждого такого мочеиспускания происходит обильное выведение калийных ионов.
Действие препаратов неизменно сопровождается антисептическим эффектом и умеренным раздражением для некоторых органов и систем. Применение медикаментов на основе NH4CL способствует разжижению и выходу мокроты из верхних и нижних дыхательных путей. Что касается выраженности диуретического эффекта, то не последнюю роль в этом вопросе играет состояние почек пациента и характер текущего заболевания. Если же говорить о назначении лекарственного средства, то оно становится актуальным в следующих случаях:
- Постменструальный синдром.
- Болезнь Меньера.
- Интоксикация медикаментозными препаратами в условиях комплексной терапии (в частности, речь идет о передозировке лекарствами фенциклидиновой группы).
- Алкалоз метаболического и гипохлоремического типов.
- Отечность, спровоцированная патологиями сердечно-сосудистой системы.
- Комплексное лечение мочегонными препаратами.
- Комплексная терапия воспалительных заболеваний легких и других органов дыхательной системы.
Препараты на основе хлористого аммония запрещены к приему в случаях ярко выраженных отклонений в работе печени и почек, при обильном выделении соляной кислоты в урине на фоне устойчивого развития дефицита натрия, а также во время беременности и лактации. Кроме того, возможны патологические проявления, которые могут выражаться в виде расстройств диспептического характера, повышенного потоотделения, общей слабости, изменения цвета кожных покровов на более бледные, мышечного тремора, брадикардии, чреватой переходом в коматозное состояние, и общей интоксикации организма.
Источник