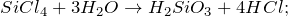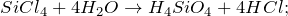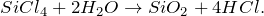- SiCl4 + H2O = ? уравнение реакции
- Необратимый гидролиз бинарных соединений.
- Общая информация по гидролизу бинарных соединений
- Какие ионные бинарные соединения способны вступать в реакцию необратимого гидролиза?
- Какие ковалентные бинарные соединения вступают в реакцию гидролиза?
- Гидролиз бинарных соединений действием растворов кислот и щелочей
- Кислотный гидролиз ионных бинарных соединений
- Щелочной гидролиз ковалентных бинарных соединений
- Тест на гидролиз бинарных соединений и взаимное усиление гидролиза.
SiCl4 + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме SiCl4 + H2O = ? Запишите уравнение реакции в ионной форме, если это возможно. Укажите основные физические и химические свойства бинарного соединения, получаемого в качестве одного из продуктов реакции.
В результате взаимодействия тетрахлорсилана с водой (гидролиз) (SiCl4 + H2O = ?) может происходить образование различных продуктов реакции (мета- и ортокремниевой кислоты, диоксида кремния). Второй продукт в каждой из описанных реакций – хлороводород. Молекулярные уравнения реакций имеют вид:
Записать уравнение реакции в ионном виде в данном случае не предоставляется возможным, поскольку взаимодействие протекает не в растворе, а на границе раздела фаз твердое-жидкое.
Оксид кремния (IV) представляет собой вещество белого цвета. Может существовать как в кристаллическом виде (малореакционноспособный), так и в аморфной форме — более активный. В очень незначительной степени химически растворяется в воде. Не реагирует с кислотами (кроме фтороводородной кислоты), гидратом аммиака; из галогенов реагирует только со фтором. Проявляет кислотные свойства, реагирует со щелочами в растворе и при сплавлении. Легко фторируется и хлорируется, восстанавливается углеродом и типичными металлами. Распространен в природе в виде кварца (имеет много окрашенных примесями разновидностей).
Источник
Необратимый гидролиз бинарных соединений.
Бинарные соединения – соединения, образованные двумя химическими элементами.
Бинарные соединения делят на ионные и ковалентные.
Ионными называют такие бинарные соединения, которые образованы атомами металла и неметалла.
Ковалентными называют бинарные соединения, образованные двумя неметаллами.
Общая информация по гидролизу бинарных соединений
Многие бинарные соединения способны разлагаться под действием воды. Такая реакция бинарных соединений с водой называется необратимым гидролизом.
Необратимый гидролиз практически всегда протекает с сохранением степеней окисления всех элементов. В результате взаимодействия бинарных соединения с водой всегда:
✓ элемент в отрицательной степени окисления переходит в состав водородного соединения;
✓ элемент в положительной степени окисления переходит в состав соответствующего гидроксида.
Напомним, что гидроксид неметалла – это ни что иное, как соответствующая кислородсодержащая кислота. Так, например, гидроксид серы (VI) — это серная кислота H2SO4.
Так, например, попробуем записать уравнение необратимого гидролиза фосфида кальция Ca3P2, опираясь на информацию, представленную выше.
В фосфиде кальция мы имеем кальций в степени окисления «+2» и фосфор в степени окисления «-3». Как уже было сказано, в результате взаимодействия с водой должно образоваться водородное соединение элемента в отрицательной степени окисления (т.е. фосфора) и соответствующий гидроксид элемента в положительной степени окисления.
Также сказано, что в результате реакции гидролиза практически всегда сохраняются степени окисления элементов.
Это значит, что в образующемся водородном соединении фосфор будет иметь ту же степень окисления, что и в исходном фосфиде, т.е. «-3», исходя из чего легко записать формулу самого водородного соединения – PH3 (газ фосфин).
В то же время, кальций, как элемент в положительной степени окисления, должен перейти в состав соответствующего гидроксида с сохранением степени окисления «+2», т.е. в Ca(OH)2.
Таким образом, без расстановки коэффициентов реакция будет описываться следующей схемой:
Расставив коэффициенты получаем уравнение:
Используя аналогичный алгоритм, запишем уравнение гидролиза пентахлорида фосфора PCl5.
В данном соединении мы имеем фосфор в степени окисления «+5» и хлор в степени окисления «-1».
Очевидно, что водородным соединением хлора с хлором в степени окисления «-1» будет HCl.
В свою очередь, поскольку элемент в положительной степени окисления относится к неметаллам, его гидроксидом будет кислородсодержащая кислота с фосфором в той же степени окисления «+5».
При условии, что вы знаете формулы всех неорганических кислот, несложно догадаться, что данным гидроксидом является фосфорная кислота H3PO4.
Само уравнение при этом после расстановки коэффициентов будет иметь вид:
Как видите, если вам дали формулу бинарного соединения и попросили записать уравнения его гидролиза, то ничего сложного в этом нет.
Какие ионные бинарные соединения способны вступать в реакцию необратимого гидролиза?
Для успешной сдачи ЕГЭ нужно запомнить, что из ионных бинарных соединений в реакцию необратимого гидролиза водой вступают:
1) нитриды щелочных металов (ЩМ), щелочноземельных металлов (ЩЗМ) и магния:
2) фосфиды ЩМ, ЩЗМ и магния:
3) силициды ЩМ, ЩЗМ и магния:
4) карбиды ЩМ, ЩЗМ и магния. Знать нужно формулы только двух карбидов — Al4C3 и CaC2 и, соответственно, уметь записывать уравнения их гидролиза:
5) сульфиды алюминия и хрома:
6) гидриды ЩМ, ЩЗМ, Mg, Al:
Гидролиз гидридов металлов – редкий пример окислительно-восстановительного гидролиза. Фактически, в данной реакции объединяются ионы водорода H + и анионы водорода H — , в следствие чего образуются нейтральные молекулы H2 с водородом в степени окисления, равной 0.
Какие ковалентные бинарные соединения вступают в реакцию гидролиза?
Из ковалентных бинарных соединений, способных вступать в реакцию необратимого гидролиза, нужно знать про:
1) галогениды фосфора III и V.
2) галогениды кремния:
Гидролиз бинарных соединений действием растворов кислот и щелочей
Помимо обычного гидролиза водой существует также вариант гидролиза, при котором бинарное соединение обрабатывают водным раствором щелочи или кислоты.
Как в таком случае записать уравнение гидролиза?
Для того, чтобы записать уравнение гидролиза бинарного соединения водным раствором щелочи или кислоты, нужно:
1) в первую очередь, представить, какие продукты образовались бы при обычном гидролизе водой.
Например, мы хотим записать уравнение щелочного гидролиза соединения PCl5 действием водного раствора KOH.
Тогда, согласно этому пункту, мы должны вспомнить какие продукты образуются при обычном гидролизе. В нашем случае это HCl и H3PO4
2) посмотреть на отношение этих продуктов к средообразователю (кислоте или щелочи) – реагируют они или нет. Если продукты обычного гидролиза реагируют со средообразователем, то запомнить продукты этого взаимодействия.
Возвращаясь к нашему случаю с PCl5, мы должны посмотреть на то, как относятся к щелочи продукты обычного гидролиза, т.е. HCl и H3PO4. Оба данных соединения в водном растворе являются кислотами, в связи с чем существовать в щелочной среде не могут. В частности, с гидроксидом калия они прореагируют, образуя соответственно соли KCl и K3PO4
3) в конечном уравнении в качестве продуктов записать то, что получается при взаимодействии со средообразователем. Воду при этом мы пока не пишем, вывод о том, писать ее или нет, делаем после попытки уравнивания реакции без нее.
Таким образом, следуя этому принципу, запишем:
Уже до начала расстановки коэффициентов очевидно, что есть необходимость в записи в качестве одного из продуктов реакции воды, поскольку в левой части присутствует водород, а в правой его нет.
Таким образом, суммарная схема реакции будет иметь вид:
А само уравнение после расстановки коэффициентов будет выглядеть так:
Следует отметить, что щелочной гидролиз ионных соединений чаще всего не отличается от обычного гидролиза действием воды, поскольку чаще всего ни один продукт обычного гидролиза с щелочью не взаимодействует.
Аналогично, можно сказать, что кислотный гидролиз ковалентных бинарных соединений не будет отличаться от водного.
В связи с этим имеет смысл более детально рассмотреть кислотный гидролиз ионных бинарных соединений и щелочной гидролиз ковалентных бинарных соединений.
Кислотный гидролиз ионных бинарных соединений
Со всеми перечисленными ионными бинарными соединениями, участвовавшими в реакциях обычного гидролиза водой, можно записать соответствующие уравнения их кислотного гидролиза. Возьмем в качестве примера водный раствор соляной кислоты:
Обратите внимание, что вместо водородного соединения в случае нитридов металлов образуется продукт его взаимодействия с соляной кислотой (NH3 + HCl = NH4Cl). Следует отметить, что нитриды металлов – единственный случай, когда при кислотном гидролизе ионного бинарного соединения не выделяется газообразное водородное соединение. Связано это с тем, что по сравнению с другими водородными соединениями неметаллов, только у аммиака основные свойства выражены в значительной степени.
Как можно заметить, кислотный гидролиз гидридов металлов также относится к окислительно-восстановительным реакциям. В результате этой реакции образуется простое вещество водород. Связано это с тем, что водород с кислотами не реагирует.
Щелочной гидролиз ковалентных бинарных соединений
Щелочному гидролизу среди ковалентных соединений подвержены все те же бинарные соединения, что и обычному гидролизу водой, то есть галогениды фосфора и кремния:
Щелочной гидролиз галогенидов фосфора III в ЕГЭ не встретится из-за специфических свойства фосфористой кислоты.
Тем не менее, для тех, кто хочет, ниже предоставляю пример такого рода уравнений с пояснением:
Поскольку фосфористая кислота является двухосновной, то несмотря на наличие трех атомов водорода, при ее реакции с щелочью на атомы металла способны заместиться только два атома водорода.
Источник
Тест на гидролиз бинарных соединений и взаимное усиление гидролиза.
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. Ca2Si
- 2. CaF2
- 3. CaBr2
- 4. Ba3N2
- 5. Mg3P2
Ответ: 145
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. NaI
- 2. NaH
- 3. K3P
- 4. K4Si
- 5. RbBr
Ответ: 234
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. SrH2
- 2. NaBr
- 3. CaC2
- 4. Al4C3
- 5. Na3N
Ответ: 1345
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. Ca3N2
- 2. Cs3P
- 3. RbF
- 4. Ba2Si
- 5. K2S
Ответ: 124
Какие из приведенных бинарных соединений необратимо гидролизуются в воде? Число верных ответов может оказаться любым
- 1. CaC2
- 2. K3N
- 3. Li3P
- 4. BeCl2
- 5. Ba3N2
Ответ: 1235
Какие из приведенных солей не могут образоваться в растворе? Число верных ответов может оказаться любым
- 1. FeI2
- 2. FeCl3
- 3. Fe2(SO4)3
- 4. Fe2(CO3)3
- 5. FeSO4
Ответ: 4
Какие из приведенных солей не могут образоваться в растворе? Число верных ответов может оказаться любым
- 1. CrCl2
- 2. CrBr3
- 3. Cr2S3
- 4. Cr2(SO4)3
- 5. Cr2(CO3)3
Ответ: 35
Какие из приведенных солей не могут образоваться в растворе? Число верных ответов может оказаться любым
- 1. Al(NO3)3
- 2. AlI3
- 3. Al2(CO3)3
- 4. Al2S3
- 5. Al2(SO3)3
Ответ: 345
Какие из приведенных солей не могут существовать в растворе? Число верных ответов может оказаться любым
- 1. Cr(NO3)3
- 2. AlBr3
- 3. Al2S3
- 4. FeSO4
- 5. FeBr2
Ответ: 3
Какие из приведенных солей не могут существовать в растворе? Число верных ответов может оказаться любым
- 1. Al2(CO3)3
- 2. Fe(NO3)2
- 3. Fe2(CO3)3
- 4. Cr2(SO3)3
- 5. AlCl3
Ответ: 134
В каких из приведенных пар веществ при взаимодействии будет выделяться газ? Число верных ответов может оказаться любым
- 1. Ca2Si + H2O
- 2. Na3P + HCl
- 3. Mg3N2 + H2O
- 4. KCl + HBr
- 5. NaCl + H2O
Ответ: 123
В каких из приведенных пар веществ при взаимодействии не будет выделяться газ? Число верных ответов может оказаться любым
- 1. MgH2 + HCl
- 2. CaH2 + H2O
- 3. Li3N + HCl
- 4. Cs2S + HCl
- 5. CaC2 + H2O
Ответ: 3
В каких из приведенных пар веществ при взаимодействии будет выделяться газ? Число верных ответов может оказаться любым
- 1. NaCl + HI
- 2. K3P + H2O
- 3. Al4C3 + HCl
- 4. Ca3N2 + H2O
- 5. Mg2Si + HCl
Ответ: 2345
В каких из приведенных пар веществ при взаимодействии не будет выделяться газ? Число верных ответов может оказаться любым
- 1. CaC2 + H2O
- 2. Na3N + H2O
- 3. Li3N + HCl
- 4. MgBr2 + H2O
- 5. KH + HCl
Ответ: 34
В каких из приведенных пар веществ при взаимодействии будет выделяться газ? Число верных ответов может оказаться любым
- 1. Ba3P2 + H2O
- 2. CaH2 + H2O
- 3. Mg3N2 + HCl
- 4. Al4C3 + H2O
- 5. Li3P + HCl
Ответ: 1245
Запишите уравнение взаимодействия хлорида фосфора(III) с водой. Используйте в качестве разделителя левой и правой частей знак равенства.
Запишите уравнение взаимодействия хлорида фосфора(V) с водой. Используйте в качестве разделителя левой и правой частей знак равенства.
Запишите уравнение взаимодействия хлорида фосфора(V) с избытком раствора гидроксида калия. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия бромида фосфора(V) с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия бромида фосфора(III) с раствором гидроксида лития. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: PBr3 + 5LiOH = Li2HPO3 + 3LiBr + 2H2O
Запишите уравнение взаимодействия бромида фосфора(V) с раствором едкого натра. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: PBr5 + 8NaOH = Na3PO4 + 5NaBr + 4H2O
Запишите уравнение взаимодействия хлорида кремния с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия бромида кремния с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия иодида кремния с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия хлорида кремния с раствором гидроксида лития. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: SiCl4 + 6LiOH = Li2SiO3 + 4LiCl + 3H2O
Запишите уравнение взаимодействия бромида кремния с избытком раствора гидроксида натрия. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: SiBr4 + 6NaOH = Na2SiO3 + 4NaBr + 3H2O
Запишите уравнение взаимодействия иодида кремния с раствором гидроксида калия. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида алюминия с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида алюминия с избытка раствора бромоводородной кислоты. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида алюминия с избытком водного раствора едкого натра. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида кальция с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия карбида кальция с разбавленной серной кислотой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия силицида магния с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия силицида магния с бромоводородной кислотой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: Mg2Si + 4HBr = 2MgBr2 + SiH4
Запишите уравнение взаимодействия нитрида натрия с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: Na3N + 3H2O = 3NaOH + NH3
Запишите уравнение взаимодействия нитрида калия с раствором соляной кислоты. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Ответ: K3N + 4HCl = 3KCl + NH4Cl
Запишите уравнение взаимодействия фосфида кальция с водой. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
Запишите уравнение взаимодействия фосфида кальция с избытком водного раствора бромоводородной кислоты. Используйте в качестве разделителя левой и правой частей уравнения знак равенства.
При смешении хлорного железа с избытком раствора карбоната натрия выпал бурый осадок. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении бромного железа с избытком раствора питьевой соды выделился бесцветный газ. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: FeBr3 + 3NaHCO3 = Fe(OH)3 + 3NaBr + 3CO2
При смешении сульфата хрома(III) с избытком раствора сульфида калия выпал серый осадок и выделился газ с резким запахом. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении нитрата хрома(III) с избытком раствора сульфита натрия выпал серый осадок и выделился газ с резким запахом. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении хлорида хрома(III) с избытком раствора карбоната натрия выпал серый осадок и выделился бесцветный газ без запаха. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении бромида хрома (III) с избытком раствора гидрокарбоната натрия выпал серый осадок и выделился бесцветный газ без запаха. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: CrBr3 + 3NaHCO3 = Cr(OH)3 + 3NaBr + 3CO2
При смешении сульфата алюминия с избытком раствора сульфида натрия выпал студенистый осадок и выделился ядовитый газ с неприятным запахом. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении раствора сульфата алюминия с избытком водного раствора сульфита калия выпал студенистый осадок и выделился газ с резким запахом. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении нитрата алюминия с избытком раствора поташа выпал студенистый осадок и выделился газ. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
При смешении бромида алюминия с избытком раствора питьевой соды выпал студенистый осадок и выделился газ. Запишите уравнение происходящей реакции, используя в качестве разделителя левой и правой частей знак равенства.
Ответ: AlBr3 + 3NaHCO3 = Al(OH)3 + 3NaBr + 3CO2
Запишите уравнение взаимодействия гидрида кальция с водой.
Запишите уравнение взаимодействия гидрида натрия с соляной кислотой.
Ответ: NaH + HCl = NaCl + H2
Запишите уравнение взаимодействия нитрида кальция с избытком раствора бромоводородной кислоты.
Определите объем газа, который можно получить при взаимодействии 15 г сульфида алюминия с водой. Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 6,72
Вычислите массу осадка, образовавшегося при взаимодействии 10 г сульфида хрома (III) с водой. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 10,3
Рассчитайте массу водорода, которую можно получить, исходя из 1,2 г гидрида натрия и избытка воды. Ответ приведите в миллиграммах и округлите до целых.
В поле ответа введите только число (без единиц измерения).
Ответ: 100
Определите массовую долю кислоты в растворе, полученную при смешении 20 г фосфида натрия и 200 г 18,25% раствора соляной кислоты. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 6,85
Вычислите суммарную массу солей, образовавшихся при взаимодействии 5 г нитрида магния с избытком раствора бромоводорода. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 37,4
Определите массу хлорида кальция, образовавшегося при взаимодействии 2,1 г гидрида кальция с 15 г 36% раствора соляной кислоты. Ответ приведите в граммах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 5,55
Навеску сульфида алюминия с массовой долей инертных примесей 10% обработали избытком раствора иодоводородной кислоты. Выделившийся газ имеет массу 5,1 г. Определите массу исходной навески. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 8,3
Смесь гидрида кальция и фосфида кальция массой 20,3 г обработали водой. Определите массовую долю гидрида в исходной смеси, если известно, что выделилось 4,48 л фосфина. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 10,34
Смесь фосфида магния и нитрида натрия массой 21,7 г обработали 200 мл воды. Определите массовую долю щелочи в образовавшемся растворе, если известно, что массовая доля нитрида в исходной смеси 38,25%. Считать, что в условиях эксперимента все газообразные продукты полностью улетучиваются из раствора. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 6,13
Пояснение:
Уравнения реакций:
Na3N + 3H2O = 3NaOH + NH3
m(Na3N) = ω(Na3N) · m(смеси)/100% = 38,25% · 21,7 г/100% = 8,3 г
ν(Mg3P2) = 13,4 г / 134 г/моль = 0,1 моль
Масса раствора всегда равна сумме масс того, что смешали минус массы того, что выпало на дно в виде осадка и/или улетело в виде газа.
Таким образом, масса полученного раствора будет равна:
Находим массы того, что нам пока неизвестно:
ν(Mg(OH)2) = 3·ν(Mg3P2) = 3 · 0,1 моль = 0,3 моль, следовательно, m(Mg(OH)2) = M(Mg(OH)2) · ν(Mg(OH)2) = 58 г/моль · 0,3 моль = 17,4 г
ν(NH3) = ν(Na3N) = 0,1 моль, следовательно, m(NH3) = M(NH3) · ν(NH3) = 17 г/моль · 0,1 моль = 1,7 г
ν(PH3) = 2 · ν(Mg3P2) = 2 · 0,1 моль = 0,2 моль, следовательно, m(PH3) = m(PH3) · ν(PH3) = 34 г/моль · 0,2 моль = 6,8 г
Тогда, масса раствора, будет равна:
m(р-ра) = m(смеси) + m(H2O) – m(Mg(OH)2) – m(NH3) – m(PH3) = 21,7 г + 200 г — 17,4 г – 1,7 г – 6,8 г = 195,8 г
ν(NaOH) = 3·ν(Na3P) = 3·0,1 моль = 0,3 моль
m(NaOH) = M(NaOH) · ν(NaOH) = 40 г/моль·0,3 моль = 12 г
ω(NaOH) = 100% · m(NaOH) / m(р-ра) = 100% · 12 г/195,8 г = 6,13 г
Навеску нитрида кальция массой 14,8 г растворили в 200 г 18,25% раствора соляной кислоты. Определите массовую долю кислоты в полученном растворе. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 3,4
Вычислите массовую долю фосфорной кислоты в растворе, полученном при смешении 43,1 г бромида фосфора (V) и 160 мл воды. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 4,83
Рассчитайте массу осадка, полученного при взаимодействии 34 г хлорида кремния (IV) и 36 мл воды. Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 15,6
Определите массовую долю хлорида натрия в растворе, полученном при взаимодействии 20,85 г хлорида фосфора (V) и 400 мл 10% раствора едкого натра (плотность 1,12 г/мл). Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 6,24
Вычислите массовую долю щелочи в растворе, полученном при взаимодействии 3,48 г бромида кремния (IV) и 35 мл 10% раствора гидроксида калия (плотность 1,12 г/мл). Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 1,31
При обработке 30 г раствора хлорида алюминия избытком сульфида натрия выпало 2,34 г осадка. Определите массовую долю хлорида алюминия в исходном растворе. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 13,35
Определите объем газа, который выделяется при обработке 16,25 г хлорида железа (III) избытком раствора поташа. Ответ приведите в литрах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 3,36
Рассчитайте массовую долю соли в растворе, полученном при смешении 13,35 г хлорида алюминия и 300 г 10% раствора гидрокарбоната калия. Ответ приведите в процентах и округлите до сотых.
В поле ответа введите только число (без единиц измерения).
Ответ: 7,64
Вычислите массу карбоната калия необходимую для полного осаждения металла из 99 мл 15% раствора хлорного железа (плотность 1,1 г/см 3 ). Ответ приведите в граммах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 20,7
Навеску гидрида кальция, содержащую примесь карбоната кальция, обработали водой. Выделившийся газ занимает объем 3,36 л. Если к полученной смеси добавить избыток соляной кислоты, то выделится еще 112 мл газа. Определите массовую долю гидрида в исходной смеси. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Ответ: 86,3
Навеску сульфида алюминия массой 45 г, содержащего примесь серы, обработали большим количеством воды. При этом выпал осадок, а выделившийся газ имел объем 18,144 л. Определите массовую долю серы в образовавшемся осадке. Ответ приведите в процентах и округлите до десятых.
В поле ответа введите только число (без единиц измерения).
Источник