Хлорид олова ii сульфид натрия вода
Для выполнения задания используйте следующий перечень веществ: перманганат калия, сульфат калия, сульфид натрия, хлорид натрия, сульфат олова(II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: перманганат калия, сульфат калия, сульфид натрия, хлорид натрия, сульфат олова(II). Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Запишем уравнение реакции:
Составим электронный баланс:
Сера в степени окисления −2 (сульфид натрия) является восстановителем. Марганец в степени окисления +7 (перманганат калия) — окислителем.
| Критерии оценивания выполнения задания | Баллы | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ответ правильный и полный, содержит следующие элементы: — выбраны вещества, и записано уравнение окислительно-восстановительной реакции; Источник Хлорид олова ii сульфид натрия водаДля выполнения задания используйте следующий перечень веществ: перманганат калия, сульфат калия, сульфид натрия, хлорид натрия, сульфат олова(II). Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением окраски раствора и выпадением осадков. Выделение газа в ходе реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель. Для выполнения задания используйте следующий перечень веществ: перманганат калия, сульфат калия, сульфид натрия, хлорид натрия, сульфат олова(II). Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена, приводящая к выпадению осадка. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции с участием выбранных веществ. Запишем молекулярные формулы данных веществ: Источник Хлорид олова II
Хлорид олова II (дихлорид олова, двухлористое олово) — бинарное химическое соединение олова и хлора с формулой SnCl2, солянокислая соль олова. При нормальных условиях представляет собой белый порошок. Плавится и кипит без разложения. При стоянии на воздухе постепенно гидролизуется влагой и окисляется O2. Хорошо растворяется в малом количестве воды, при разбавлении раствора выпадает в осадок. Образует кристаллогидрат SnCl2∙2H2O, который имеет строение [Sn(H2O)Cl2]∙H2O («оловянная соль»). Реагирует со щелочами, гидратом аммиака. Сильный восстановитель, слабый окислитель. СодержаниеФизические свойства
Получение
ХранениеВ сухом прохладном месте. Приготовление 10 % раствора: К 100 г SnCl2·2H2O добавить 100 мл концентрированной соляной кислоты, разбавить до 1 л водой и добавить немного олова. Источник Хлорид олова (II) — Tin(II) chloride
| SnCl 2 | |||||||||||||||||||||||||||||||||||||||||||
| Молярная масса | 189,60 г / моль (безводный) 225,63 г / моль (дигидрат) | |||||||||||||||||||||||||||||||||||||||||||
| Появление | Белое кристаллическое твердое вещество | |||||||||||||||||||||||||||||||||||||||||||
| Запах | без запаха | |||||||||||||||||||||||||||||||||||||||||||
| Плотность | 3,95 г / см 3 (безводный) 2,71 г / см 3 (дигидрат) | |||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 247 ° С (477 ° F, 520 К) (безводный) 37,7 ° С (дигидрат) | |||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 623 ° С (1153 ° F, 896 К) (разлагается) | |||||||||||||||||||||||||||||||||||||||||||
| 83,9 г / 100 мл (0 ° C) Гидролизуется в горячей воде | ||||||||||||||||||||||||||||||||||||||||||||
| Растворимость | растворим в этаноле , ацетоне , эфире , тетрагидрофуране нерастворим в ксилоле | |||||||||||||||||||||||||||||||||||||||||||
| Слоистая структура (цепочки из групп SnCl 3 ) | ||||||||||||||||||||||||||||||||||||||||||||
| Тригонально-пирамидный (безводный) дигидрат также трехкоординатный | ||||||||||||||||||||||||||||||||||||||||||||
| Бент (газовая фаза) | ||||||||||||||||||||||||||||||||||||||||||||
| Опасности | ||||||||||||||||||||||||||||||||||||||||||||
| Основные опасности | Раздражает, опасен для водных организмов | |||||||||||||||||||||||||||||||||||||||||||
| Паспорт безопасности | См .: страницу данных ICSC 0955 (безводный) ICSC 0738 (дигидрат) | |||||||||||||||||||||||||||||||||||||||||||
| Пиктограммы GHS |     | |||||||||||||||||||||||||||||||||||||||||||
| Сигнальное слово GHS | Опасность | |||||||||||||||||||||||||||||||||||||||||||
| | ||||||||||||||||||||||||||||||||||||||||||||
| Смертельная доза или концентрация (LD, LC): | ||||||||||||||||||||||||||||||||||||||||||||
| 700 мг / кг (крыса, перорально) 10000 мг / кг (кролик, перорально) 250 мг / кг (мышь, перорально) | ||||||||||||||||||||||||||||||||||||||||||||
| Родственные соединения | ||||||||||||||||||||||||||||||||||||||||||||
 N проверить ( что есть ?) N проверить ( что есть ?)  Y Y  N N | ||||||||||||||||||||||||||||||||||||||||||||
| Ссылки на инфобоксы | ||||||||||||||||||||||||||||||||||||||||||||
Хлорид олова (II) , также известный как хлорид олова , представляет собой белое кристаллическое твердое вещество с формулой Sn Cl 2 . Он образует стабильный дигидрат , но водные растворы имеют тенденцию к гидролизу , особенно если они горячие. SnCl 2 широко используется в качестве восстановителя (в растворе кислоты) и в электролитических ваннах для лужения . Хлорид олова (II) не следует путать с другим хлоридом олова; хлорид олова (IV) или хлорид олова (SnCl 4 ).
СОДЕРЖАНИЕ
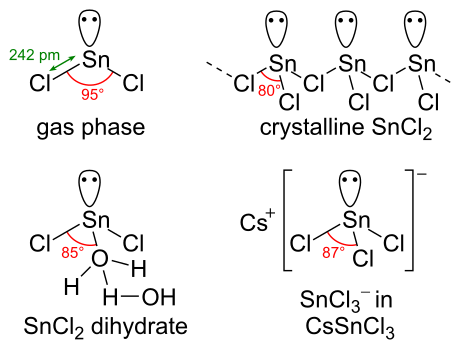
Химическая структура
SnCl 2 имеет одну пару из электронов , таким образом, что молекула в газовой фазе изогнута. В твердом состоянии кристаллический SnCl 2 образует цепи, связанные хлоридными мостиками, как показано. Дигидрат также является трехкоординатным: одна вода координируется с оловом, а вторая вода — с первой. Основная часть молекулы складывается в двойные слои в кристаллической решетке , а «вторая» вода находится между слоями.
Химические свойства
Хлорид олова (II) может растворяться в воде, меньшей, чем его собственная масса, без видимого разложения, но по мере разбавления раствора происходит гидролиз с образованием нерастворимой основной соли:
SnCl 2 (водн.) + H 2 O (l) ⇌ Sn (OH) Cl (s) + HCl (водн.)
Следовательно, если должны использоваться прозрачные растворы хлорида олова (II), он должен быть растворен в соляной кислоте (обычно той же или большей молярности, что и хлорид олова) для поддержания равновесия в левой части (с использованием формулы Ле Шателье. принцип ). Растворы SnCl 2 также неустойчивы к окислению воздухом:
6 SnCl 2 (водн.) + O 2 (г) + 2 H 2 O (l) → 2 SnCl 4 (водн.) + 4 Sn (OH) Cl (s)
Этого можно избежать, храня раствор над кусками металлического олова.
Есть много таких случаев, когда хлорид олова (II) действует как восстановитель, восстанавливая соли серебра и золота до металла, а соли железа (III) до железа (II), например:
SnCl 2 (водн.) + 2 FeCl 3 (водн.) → SnCl 4 (водн.) + 2 FeCl 2 (водн.)
Он также восстанавливает медь (II) до меди (I).
Растворы хлорида олова (II) также могут служить просто источником ионов Sn 2+ , которые могут образовывать другие соединения олова (II) посредством реакций осаждения . Например, реакция с сульфидом натрия дает коричневый / черный сульфид олова (II) :
SnCl 2 (водн.) + Na 2 S (водн.) → SnS (т. Е.) + 2 NaCl (водн.)
Если щелочи добавляют к раствору SnCl 2 , белого осадка гидратированного олова (II) оксида форм на начальном этапе; затем он растворяется в избытке основания с образованием соли станнита, такой как станнит натрия:
SnCl 2 (водн.) + 2 NaOH (водн.) → SnO · H 2 O (тв.) + 2 NaCl (водн.) SnO · H 2 O (тв.) + NaOH (водн.) → NaSn (OH) 3 (водн.)
Безводный SnCl 2 можно использовать для получения множества интересных соединений олова (II) в неводных растворителях. Так , например, литий — соль из 4-метил-2,6-ди-трет-бутилфенол реагирует с SnCl 2 в ТГФ с получением линейных желтому двухкоординатный соединение Sn (ОАР) 2 (Ar = арил ).
Хлорид олова (II) также ведет себя как кислота Льюиса , образуя комплексы с лигандами, такими как хлорид- ион, например:
SnCl 2 (водн.) + CsCl (водн.) → CsSnCl 3 (водн.)
Большинство этих комплексов являются пирамидными , и поскольку такие комплексы, как SnCl 3, имеют полный октет , тенденция к добавлению более чем одного лиганда незначительна. Однако неподеленная пара электронов в таких комплексах доступна для связывания, и поэтому сам комплекс может действовать как основание Льюиса или лиганд. Это наблюдается в продукте следующей реакции, связанной с ферроценом :
SnCl 2 можно использовать для получения множества таких соединений, содержащих связи металл-металл. Например, реакция с октакарбонилом дикобальта :
Подготовка
Безводный SnCl 2 получают действием сухого газообразного хлористого водорода на металлическое олово . Дигидрат получают по аналогичной реакции с использованием соляной кислоты :
Sn (т.) + 2 HCl (водн.) → SnCl 2 (водн.) + H
2 (грамм)
Затем воду осторожно выпаривают из кислого раствора с получением кристаллов SnCl 2 · 2H 2 O. Этот дигидрат можно обезвоживать до безводного с использованием уксусного ангидрида .
Использует
Раствор хлорида олова (II), содержащий небольшое количество соляной кислоты , используется для лужения стали, чтобы сделать жестяные банки . Приложен электрический потенциал, и металлическое олово образуется на катоде посредством электролиза .
Хлорид олова (II) используется в качестве протравы при крашении тканей, поскольку он дает более яркие цвета с некоторыми красителями, например кошенилью . Эта протрава также использовалась отдельно для увеличения веса шелка.
В последние годы все большее число торговых марок зубных паст добавляют хлорид олова (II) для защиты от эрозии эмали в свои формулы, например, Oral-B или Elmex .
Он используется в качестве катализатора при производстве полимерной полимолочной кислоты (PLA).
Он также находит применение в качестве катализатора между ацетоном и пероксидом водорода для образования тетрамерной формы пероксида ацетона .
Хлорид олова (II) также широко используется в качестве восстановителя . Это видно по его использованию для серебрения зеркал, когда металлическое серебро наносится на стекло:
Sn 2+ (водн.) + 2 Ag + → Sn 4+ (водн.) + 2 Ag (s)
Связанное с этим сокращение традиционно использовалось в качестве аналитического теста для Hg 2+ (водн.). Например, если SnCl 2 добавляют по каплям в раствор хлорида ртути (II) , сначала образуется белый осадок хлорида ртути (I) ; по мере добавления большего количества SnCl 2 он становится черным, так как образуется металлическая ртуть. Хлорид олова можно использовать для проверки наличия соединений золота . SnCl 2 становится ярко- пурпурным в присутствии золота (см. Пурпур Кассия ).
Когда ртуть анализируется с помощью атомно-абсорбционной спектроскопии, необходимо использовать метод холодного пара, а в качестве восстановителя обычно используется хлорид олова (II).
В органической химии SnCl 2 в основном используется при восстановлении по Стивену , при котором нитрил восстанавливается (через соль имидоилхлорида ) до имина, который легко гидролизуется до альдегида .
Реакция обычно лучше всего протекает с ароматическими нитрилами Aryl -CN. Родственная реакция (называемая методом Зонна-Мюллера) начинается с амида, который обрабатывают PCl 5 с образованием соли имидоилхлорида.
Восстановление Стивена сегодня используется реже, потому что оно в основном заменено восстановлением гидрида диизобутилалюминия .
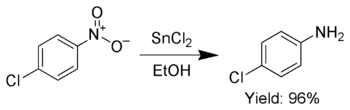
Кроме того, SnCl 2 используется для селективного восстановления ароматических нитрогрупп до анилинов .
SnCl 2 также восстанавливает хиноны до гидрохинонов .
Хлорид олова также добавляется в качестве пищевой добавки с номером E E512 в некоторые консервированные продукты и продукты в бутылках, где он служит средством сохранения цвета и антиоксидантом .
SnCl 2 используется в радионуклидной ангиографии для уменьшения содержания радиоактивного агента технеция- 99m- пертехнетата, способствующего связыванию с клетками крови.
Водный раствор хлорида олова используется многими любителями и профессионалами в области аффинажа драгоценных металлов в качестве индикатора золота и металлов платиновой группы в растворах.
Расплавленный SnCl 2 может окисляться с образованием высококристаллических наноструктур SnO 2 .
Источник