Хлорид свинца II
| Хлорид свинца II | |
|---|---|
| Систематическое наименование | Хлорид свинца |
| Традиционные названия | Хлористый свинец, дихлорид свинца |
| Хим. формула | PbCl2 |
| Рац. формула | PbCl2 |
| Состояние | прозрачные кристаллы |
| Молярная масса | 278,11 г/моль |
| Плотность | 5,85 г/см³ |
| Твёрдость | 2,5 |
| Температура | |
| • плавления | 498; 501 °C |
| • кипения | 950; 953; 954 °C |
| Мол. теплоёмк. | 77,0 Дж/(моль·К) |
| Энтальпия | |
| • образования | -360,0 кДж/моль |
| Растворимость | |
| • в воде | 0,978 20 ; 2,68 100 г/100 мл |
| Рег. номер CAS | 7758-95-4 |
| PubChem | 166945 |
| Рег. номер EINECS | 231-845-5 |
| SMILES | |
| RTECS | OF9450000 |
| ChEBI | 88212 |
| Номер ООН | 2291 |
| ChemSpider | 22867 |
| Токсичность | ядовит |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид свинца II — бинарное неорганическое соединение, соль металла свинца и соляной кислоты с формулой PbCl2, прозрачные кристаллы, слабо растворимые в воде.
Содержание
Получение
- В природе встречается редкий минерал коттунит — PbCl2 с примесями, часто с небольшой радиоактивностью.
- Действие хлора на металлический свинец:
Pb + Cl2 → 200−300oC PbCl2
- Растворение в соляной кислоте оксида, гидроксида или карбоната свинца:
PbO + 2 HCl → PbCl2 ↓ + H2O Pb(OH)2 + 2 HCl → PbCl2 ↓ + 2 H2O PbCO3 + 2 HCl → PbCl2 ↓ + CO2 + H2O
Физические свойства
Хлорид свинца II образует прозрачные кристаллы ромбической сингонии, пространственная группа P nam, параметры ячейки a = 0,7623 нм, b = 0,9048 нм, c = 0,4535 нм, Z = 4.
Диамагнитен, плохо растворяется в воде и этаноле на холоде. Токсичен, следует избегать попадания вещества внутрь орально либо ингаляционно. Это может привести к очень тяжёлым отравлениям.
Химические свойства
- В горячих водных растворах подвергается гидролизу до основной соли:
PbCl2 + H2O → 50oC Pb(OH)Cl + HCl
- Хорошо растворяется в концентрированной соляной кислоте:
PbCl2 + 2 HCl → H2[PbCl4]
- Разлагается щелочами:
PbCl2 + 2 NaOH → Pb(OH)2 ↓ + 2 NaCl PbCl2 + 4 NaOH → Na2[Pb(OH)4] + 2 NaCl
- Восстанавливается водородом:
PbCl2 + H2 → 300−350oC Pb + 2 HCl
- Вступает в обменные реакции:
PbCl2 + 2 KI → PbI2 ↓ + 2 KCl PbCl2 + H2S → PbS ↓ + 2 HCl
- В щелочной среде с карбонатами образует основную соль:
2 PbCl2 + Na2CO3 + 2 NaOH → Pb2(OH)2CO3 ↓ + 4 NaCl
Токсичность
Дихлорид свинца токсичен, как и все соединения свинца. Может привести к очень тяжёлым отравлениям свинцом.
Источник
Хлорид свинца (II) — Lead(II) chloride
 | |
 | |
| Имена | |
|---|---|
| Имена ИЮПАК |
- 7758-95-4
Y
- ЧЕБИ: 88212
N
- 22867
Y
- 4IL61GN3YI
N
не растворим в спирте
Растворим в горячей воде, а также в присутствии гидроксида щелочного металла.
Растворим в концентрированной HCl (> 6M)



 N проверить ( что есть ?)
N проверить ( что есть ?)  Y
Y  N
NХлорид свинца (II) (PbCl 2 ) представляет собой неорганическое соединение, которое в условиях окружающей среды представляет собой белое твердое вещество. Плохо растворяется в воде. Хлорид свинца (II) — один из важнейших реагентов на основе свинца . Он также встречается в природе в виде минерала котуннита .
СОДЕРЖАНИЕ
Структура и свойства
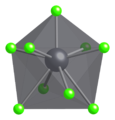
В твердом PbCl 2 каждый ион свинца координирован девятью ионами хлорида в образовании треугольной призмы с тремя вершинами — шесть лежат в вершинах треугольной призмы, а три лежат за центрами каждой прямоугольной грани призмы. 9 хлорид-ионов не равноудалены от центрального атома свинца, 7 лежат в области 280–309 пм, а 2 — в 370 пм. PbCl 2 образует белые ромбические иглы.
Координационная геометрия Cl —
Координационный многогранник Pb 2+
В газовой фазе молекулы PbCl 2 имеют изогнутую структуру с углом Cl – Pb – Cl , равным 98 °, и расстоянием между связями Pb – Cl , равным 2,44 Å. Такой PbCl 2 выделяется из двигателей внутреннего сгорания, в которых используются добавки хлористого этилена и тетраэтилсвинца для защиты от детонации .
PbCl 2 является умеренно растворим в воде, произведение растворимости К зр = 1,7 × 10 −5 при 20 ° C. Это один из только 5 , обычно нерастворимых в воде хлоридов, остальные 4 существа таллия (I) , хлорид , хлорид серебра (AgCl) с K зра = 1,8 · 10 −10 , хлорид меди (I) (CuCl) с K уд = 1,72 × 10 −7 и хлорид ртути (I) (Hg 2 Cl 2 ) с K sp = 1,3 × 10 −18 .
Вхождение
PbCl 2 встречается в природе в форме минерала котуннита . Бесцветный, белый, желтый или зеленый цвет, плотность 5,3–5,8 г / см 3 . Твердость по шкале Мооса 1,5–2. Кристаллическая структура является орторомбической дипирамидальной, а точечная группа составляет 2 / м 2 / м 2 / м. Каждый Pb имеет координационное число 9. Котуннит встречается около вулканов: Везувий , Италия; Тарапака , Чили; и Толбачик , Россия.
Синтез
Двойное смещение / Метатезис
Хлорид свинца (II) осаждается при добавлении водных источников хлорида (HCl, NaCl, KCl) к соединениям свинца (II).
Прямое сокращение
PbCl 2 может образовываться при восстановлении хлорида меди (II) металлическим свинцом:
Прямое хлорирование
PbCl 2 также образуется под действием газообразного хлора на металлический свинец:
Реакции
Добавление хлорид-ионов к суспензии PbCl 2 приводит к образованию растворимых комплексных ионов. В этих реакциях дополнительный хлорид (или другие лиганды ) разрушают хлоридные мостики, которые составляют полимерный каркас твердого (ых) PbCl 2 (ов) .
PbCl 2 реагирует с расплавленным NaNO 2 с образованием PbO:
PbCl 2 (л) + 3 NaNO 2 → PbO + NaNO 3 + 2 NO + 2 NaCl
PbCl 2 используется в синтезе хлорида свинца (IV) (PbCl 4 ): Cl 2 барботируют через насыщенный раствор PbCl 2 в водном NH 4 Cl, образуя [NH 4 ] 2 [PbCl 6 ]. Последний реагирует с холодной концентрированной серной кислотой (H 2 SO 4 ) с образованием PbCl 4 в виде масла.
Свинец хлорид (II) , является главным предшественником для металлоорганических производных свинца, такие как plumbocenes . Используются обычные алкилирующие агенты, включая реактивы Гриньяра и литийорганические соединения:
2 PbCl 2 + 4 RLi → R 4 Pb + 4 LiCl + Pb 2 PbCl 2 + 4 RMgBr → R 4 Pb + Pb + 4 MgBrCl 3 PbCl 2 + 6 RMgBr → R 3 Pb-PbR 3 + Pb + 6 MgBrCl
Эти реакции дают производные, которые больше похожи на кремнийорганические соединения, т.е. что Pb (II) имеет тенденцию к диспропорционированию при алкилировании.
PbCl 2 можно использовать для получения PbO 2 путем обработки его гипохлоритом натрия (NaClO), в результате чего образуется красновато-коричневый осадок PbO 2 .
Использует
- Расплавленный PbCl 2 используется в синтезе керамики титаната свинца и титаната свинца бария по реакциям замещения катионов: x PbCl 2 (l) + BaTiO 3 (s) → Ba 1 — x Pb x TiO 3 + x BaCl 2
- PbCl 2 используется в производстве стекла, пропускающего инфракрасное излучение, и декоративного стекла, называемого ауреновым стеклом . Стекло Aurene имеет радужную поверхность, образованную распылением PbCl 2 и повторным нагревом в контролируемых условиях. Хлорид олова (SnCl 2 ) используется с той же целью.
- Pb используется в HCl, хотя образующийся PbCl 2 слабо растворяется в HCl. Добавление 6–25% сурьмы (Sb) увеличивает коррозионную стойкость.
- Основной хлорид свинца, PbCl 2 · Pb (OH) 2 , известен как белый свинец Паттинсона и используется в качестве пигмента в белой краске. Свинцовая краска в настоящее время запрещена во многих странах Конвенцией 1921 года о свинце (окраске ) как опасность для здоровья .
- PbCl 2 является промежуточным продуктом при рафинировании висмутовой (Bi) руды. Руда, содержащая Bi, Pb и Zn, сначала обрабатывается расплавом едкого натра для удаления следов мышьяка и теллура . Затем следует процесс Паркса для удаления любого присутствующего серебра и золота. Теперь руда содержит Bi, Pb и Zn. Его обрабатывают газом Cl 2 при 500 ° C. Первым образуется ZnCl 2, который удаляется. Затем образуется PbCl 2, который удаляется, оставляя чистый Bi. BiCl 3 образуется последним.
Токсичность
Как и другие растворимые соединения свинца, воздействие PbCl 2 может вызвать отравление свинцом .
Источник