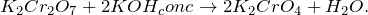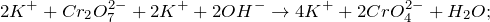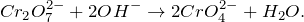- K2Cr2O7 + KOH = ? уравнение реакции
- Хромат калия гидроксид калия вода
- Хромат калия. Получение, химические и физические свойства. Применение
- Как получают хромат калия?
- Химические свойства хромата калия:
- Физические свойства хромата калия:
- Оптические свойства хромата калия
- Где применяется калий хромат?
- Калий дихромат (техническое название — хромпик)
- K2Cr2O7 + KOH = ? уравнение реакции
- Хромат калия
- Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
- Токсичность
K2Cr2O7 + KOH = ? уравнение реакции
Срочно нужна помощь! Какие продукты образуются в результате взаимодействия дихромата калия с гидроксидом калия (K2Cr2O7 + KOH = ?)? Запишите молекулярное, полное и сокращенное ионное уравнения, если это возможно. Укажите окислитель и восстановитель. Дайте определение окислительно-восстановительным реакциям.
В результате взаимодействия концентрированного раствора гидроксида калия с дихроматом калия (K2Cr2O7 + KOH = ?) происходит образование средней соли – хромата калия, а также воды. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что и вода на ионы не распадается, т.е. не диссоциирует.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Данная реакция не относится к окислительно-восстановительным, поскольку ни один химический элемент не изменяет свою степень окисления.
Окисление – это отдача электронов веществом, т.е. повышение степени окисление элемента. Вещества, отдающие свои электроны в процессе реакции, называются восстановителями.
Восстановление – это смещение электронов к веществу или понижение степени окисления элемента. Вещества, принимающее электроны, называется окислителем.
Источник
Хромат калия гидроксид калия вода
Для выполнения задания используйте следующий перечень веществ: гидроксид калия, силикат калия, хромат калия, гидроксид лития, нитрит натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: гидроксид калия, силикат калия, хромат калия, гидроксид лития, нитрит натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Силикат лития ведь растворимый
«Li2SiO3, бесцветные кристаллы, не растворяется в воде»
В учебнике Габриеляна в таблице растворимости силикат лития растворим в воде.
Запишем уравнение реакции:
Составим электронный баланс:
Азот в степени окисления +3 (нитрит натрия) является восстановителем. Хром в степени окисления +6 (хромат калия) — окислителем.
| Критерии оценивания выполнения задания | Баллы | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ответ правильный и полный, содержит следующие элементы: — выбраны вещества, и записано уравнение окислительно-восстановительной реакции; Источник Хромат калия. Получение, химические и физические свойства. ПрименениеХромат калия или хромовокислый калий (международные названия: Kalium chromicum, Kaliumchromat, Potassium chromate) — это неорганическое соединение, кристаллы желтого цвета ромбической системы, растворимые в воде. Относится к солям хромовой кислоты H2CrO4, которая в свободном состоянии не существует. У вещества хромат калия формула следующая: CrK2O4 Как получают хромат калия?Хромовокислый калий получают несколькими способами:
Химические свойства хромата калия:
Физические свойства хромата калия:
Оптические свойства хромата калияПоказатель преломления составляет 1,74. Где применяется калий хромат?
Калий дихромат (техническое название — хромпик)Представляет собой кристаллы красно-оранжевого цвета. Не образует кристаллогидратов, обладает плотностью 2,684 грамм на кубический сантиметр, плавится при температуре 397 градусов. При дальнейшем нагревании разлагается. Растворимость в воде при 20 градусах равна 12,48 грамм соли на 100 грамм воды. Дихромат калия получил широкое применение как окислитель в пиротехнике, спичечной промышленности и в хромаметрии как реагент. Источник K2Cr2O7 + KOH = ? уравнение реакцииСрочно нужна помощь! Какие продукты образуются в результате взаимодействия дихромата калия с гидроксидом калия (K2Cr2O7 + KOH = ?)? Запишите молекулярное, полное и сокращенное ионное уравнения, если это возможно. Укажите окислитель и восстановитель. Дайте определение окислительно-восстановительным реакциям. В результате взаимодействия концентрированного раствора гидроксида калия с дихроматом калия (K2Cr2O7 + KOH = ?) происходит образование средней соли – хромата калия, а также воды. Молекулярное уравнение реакции имеет вид: Запишем ионные уравнения, учитывая, что и вода на ионы не распадается, т.е. не диссоциирует. Первое уравнение называют полным ионным, а второе – сокращенным ионным. Источник Хромат калия
Хромат калия — неорганическое соединение, соль металла калия и хромовой кислоты с формулой K2CrO4, жёлтые кристаллы, растворимые в воде, окрашивает раствор, как и многие другие хроматы, в желтый цвет. СодержаниеПолучение
Cr2O3 + KClO3 + 2K2CO3 → 500−700oC 2K2CrO4 + KCl + 2CO2
CrO3 + 2KOH → K2CrO4 + H2O
4K2Cr2O7 → 500−600oC 4 K2CrO4 + 2Cr2O3 + 3O2
K2Cr2O7 + 2KOH → 2 K2CrO4 + H2O Физические свойстваХромат калия образует жёлтые кристаллы ромбической сингонии, пространственная группа P nam, параметры ячейки a = 0,761 нм, b = 1,040 нм, c = 0,592 нм, Z = 4. При 668°С переходит в гексагональную красную фазу. Хорошо растворяется в воде с гидролизом по аниону. Плохо растворим в этаноле. Химические свойства
2K2CrO4 + 2HCl → K2Cr2O7 + 2KCl + H2O
K2CrO4 + 2HCl → K[Cr(Cl)O3] + KCl + H2O
2 K2CrO4 + 16HCl → 90oC 2CrCl3 + 3Cl2↑ + 4KCl + 8H2O
K2CrO4 + 2AgNO3 → Ag2CrO4↓ + 2KNO3 K2CrO4 + Hg2(NO3)2 → Hg2CrO4↓ + 2KNO3 Применение
ТоксичностьХромат калия очень ядовит и канцерогенен, как и многие другие соединения шестивалентного хрома. Источник | |||||||||||||||||||||||||||||||||||||||||||||