- Хромат бария
- Содержание
- Физические и химические свойства
- Получение
- Токсичность
- Применение
- Примечания
- Полезное
- Смотреть что такое «Хромат бария» в других словарях:
- Хромат бария — Barium chromate
- СОДЕРЖАНИЕ
- История
- Подготовка и реакции
- Обычное использование
- Исследовательская работа
- Безопасность
- Хромат бария
- Содержание
- Физические и химические свойства
- Получение
- Токсичность
Хромат бария
| Хромат бария | |||||||
  | |||||||
| Общие | |||||||
|---|---|---|---|---|---|---|---|
| Систематическое наименование | Хромат бария | ||||||
| Химическая формула | BaCrO4 | ||||||
| Физические свойства | |||||||
| Состояние (ст. усл.) | твердый | ||||||
| Отн. молек. масса | 253,37 а. е. м. | ||||||
| Молярная масса | 253,37 г/моль | ||||||
| Плотность | 4,5 г/см³ | ||||||
| Термические свойства | |||||||
| Температура плавления | 1380 °C | ||||||
| Энтальпия образования (ст. усл.) | -1366,8 кДж/моль | ||||||
| Химические свойства | |||||||
| Растворимость в воде | (при 20 °C) 0,00028 г/100 мл | ||||||
| Классификация | |||||||
| Рег. номер CAS | 10294-40-3 | ||||||
| SMILES | [Ba+2].[O-][Cr]([O-])(=O)=O | ||||||
| RTECS | CQ876000 | ||||||
| Безопасность | |||||||
| Токсичность | |||||||
 | |
| Имена | |
|---|---|
| Другие имена |
- 10294-40-3
Y
- 23481
Y
- 7D7O9CF0IX
Y





 N проверить ( что есть ?)
N проверить ( что есть ?)  Y
Y  N
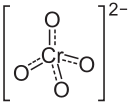
NХромат бария , названный ИЮПАК тетраоксохроматом (VI) бария , представляет собой желтый песок, похожий на порошок с формулой BaCrO 4 . Это известный окислитель, который при нагревании образует зеленое пламя из-за ионов бария.
СОДЕРЖАНИЕ
История
Первый встречающийся в природе хромат бария был обнаружен в стране Иордания. Коричневые кристаллы, обнаруженные на вмещающих скалах, были названы гашемитом в честь Иорданского Хашимитского Королевства. Цвет кристаллов хашемита варьируется от светло-желтовато-коричневого до более темного зеленовато-коричневого и обычно составляет менее 1 мм в длину.
Кристаллы гашемита не состоят из чистого хромата бария, но вместо этого также содержат небольшое количество серы. Различные кристаллы содержат ряд примесей серы, начиная от более чистых темных кристаллов Ba 1,00 (Cr 0,93 , S 0,07 ) 1,00 O 4 до менее чистых светлых кристаллов Ba 1,00 (Cr 0,64 , S 0,36 ) 1,00 O 4 .
Было обнаружено, что хашемит является изоструктурным хроматным аналогом барита BaSO 4 .
Подготовка и реакции
Его можно синтезировать путем реакции гидроксида бария или хлорида бария с хроматом калия .
BaCrO4(v)+2KOH>>>>»> Ба ( ОЙ ) 2 + K 2 CrO 4 ⟶ BaCrO 4 ↓ + 2 КОН <\ Displaystyle <\ ce <\ mathsf <
В качестве альтернативы его можно создать взаимодействием хлорида бария с хроматом натрия . Затем осадок промывают, фильтруют и сушат.
Он очень нерастворим в воде , но растворим в кислотах :
2 BaCrO 4 + 2 H + → 2 Ba 2+ + Cr 2 O 7 2− + H 2 O K уд = [Ba 2+ ] [CrO 4 2− ] = 2,1 × 10 −10
Он может реагировать с гидроксидом бария в присутствии азида натрия с образованием хромата бария (V) . В результате реакции выделяются кислород и вода.
[<\ce 
Обычное использование
Было обнаружено, что хромат бария полезен во многих сферах. Соединение часто используется в качестве носителя для ионов хрома. Одним из таких случаев является использование хромата бария в качестве поглотителя сульфата в ваннах для гальваники хрома. Со временем концентрация хрома в ванне будет уменьшаться до тех пор, пока ванна не перестанет работать. Добавление хромата бария увеличивает срок службы ванны за счет увеличения концентрации хромовой кислоты.
Хромат бария является окислителем, что делает его полезным в качестве модификатора скорости горения в пиротехнических композициях. Это особенно полезно в композициях задержки, таких как предохранители задержки.
Хромат бария используется в качестве антикоррозионного пигмента при гальванике поверхностей из цинкового сплава.
При смешивании с твердой фумаровой кислотой хромат бария может использоваться для удаления примесей и остаточной влаги из органических растворителей для химической чистки или из нефтяного топлива.
Хромат бария также используется в составе катализатора дегидрирования алканов.
Барий также использовался для окрашивания красок. Пигмент, известный как лимонно-желтый, часто содержал хромат бария, смешанный с сульфатом свинца. Лимонно-желтый из-за его умеренной окраски не очень часто использовался в масляной живописи. Известно, что Пьер-Огюст Ренуар и Клод Моне рисовали лимонно-желтым цветом.
Исследовательская работа
В 2004 году был найден способ изготовления монокристаллических наностержней типа ABO 4 . Этот метод состоял из модифицированного метода синтеза матрицы, который первоначально использовался для синтеза органических микротрубочек. Наночастицам позволяют расти в порах мембран из оксида алюминия различного размера. Различные размеры пор позволяют контролировать рост и воспроизводить формы. Затем оксид алюминия растворяется, оставляя наночастицы нетронутыми. Синтез можно проводить при комнатной температуре, что значительно снижает стоимость и ограничения по условиям.
В 2010 году было проведено исследование четырех соединений шестивалентного хрома для проверки канцерогенного действия хрома. Ионы хрома накапливаются в местах бифуркации бронхов, оседая в ткани и вызывая опухоли. Используя хромат цинка в качестве стандарта, было обнаружено, что хромат бария генотоксичен и цитотоксичен . Было установлено, что цитотоксичность, скорее всего, является результатом генотоксичности, но причина генотоксичности пока неизвестна.
Безопасность
Хромат бария токсичен . Хроматы при измельчении и вдыхании являются канцерогенами .
Источник
Хромат бария
| Хромат бария | |
|---|---|
 | |
| Систематическое наименование | Хромат бария |
| Хим. формула | BaCrO4 |
| Состояние | твердый |
| Молярная масса | 253,37 г/моль |
| Плотность | 4,5 г/см³ |
| Температура | |
| • плавления | 1380 °C |
| Энтальпия | |
| • образования | -1366,8 кДж/моль |
| Растворимость | |
| • в воде | (при 20 °C) 0,00028 г/100 мл |
| Рег. номер CAS | 10294-40-3 |
| PubChem | 25136 |
| Рег. номер EINECS | 233-660-5 |
| SMILES | |
| RTECS | CQ876000 |
| ChemSpider | 23481 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хромат (VI) бария — бариевая соль хромовой кислоты, имеющая химическую формулу BaCrO4.
Содержание
Физические и химические свойства
Хромат бария представляет собой ярко-жёлтое кристаллическое вещество плохо растворимое в воде (ПР=1,2⋅10 −10 ). Низкая растворимость этого соединения используется в аналитической практике для отделения и определения солей бария.
В растворах сильных неорганических кислот растворяется с образованием бихромата:
Плохо растворим в уксусной кислоте, что используется для отделения бария от ионов стронция.
При прокаливании в смеси с Ba(OH)2 и присутствии азида натрия превращается в хромат(V) бария. При этом выделяется кислород и вода:
Получение
Взаимодействием растворов Ba(OH)2 или BaS с хроматом натрия или калия:
Токсичность
Хромат бария — ядовит, особенно при попадании внутрь организма человека вследствие его перехода под действием кислоты желудка в растворимую форму. ПДК 0,01 мг/м³ (в пересчете на CrO3).
Источник










