Вода и электрический ток
Чтобы вещество смогло проводить электрический ток, в нем должны присутствовать заряженные частицы, способные свободно перемещаться через весь его объем под действием приложенного электрического поля. В металлических проводниках, например, такими заряженными частицами выступают свободные электроны, а в электролитах — положительно и отрицательно заряженные ионы.
Диэлектрики вовсе не проводят постоянный электрический ток, поскольку заряженные частицы в их структуре хотя и есть, однако они связаны друг с другом, и не могут свободно перемещаться, образуя ток.
Но переменный ток пропускают даже диэлектрики, это называется током смещения, например конденсатор в цепи переменного тока на определенной частоте будет проводить ток так, словно является проводником.
Обычная неочищенная вода
Что касается обычной воды (речной, водопроводной, особенно — морской и т. д.), то в ней всегда присутствуют растворенные минеральные вещества, которые под действием приложенного электрического поля распадаются на ионы, способные двигаться как в электролите.
По этой причине обычная неочищенная вода проводит ток, ведя себя подобно слабому электролиту. Если через такую воду попытаться пропустить ток, то в течение небольшого времени он будет через нее идти, хотя и слабо.
Теоретически идеально чистая вода
Теоретически, если воду полностью очистить от примесей, то есть удалить из ее объема абсолютно все вещества, включая соли, газы, остатки кислот, то она станет диэлектриком, и будет вести себя как изолятор.
В ней не будет ионов, способных двигаться под действием электрического поля и образовывать ток, а сами молекулы воды — электрически нейтральны. Такую воду можно было бы использовать, например, в качестве диэлектрика между пластинами конденсатора.
Реальная дистиллированная вода
Но в реальности даже дистиллированная вода (вода, очищенная путем испарения с последующей конденсацией пара) не бывает абсолютно чистой.
Есть российский ГОСТ 6709-72, определяющий массовую концентрацию остатка примесей в такой дистиллированной воде — не более 5 мг на литр, и минимальное удельное сопротивление не менее 2 кОм*м.
То есть куб дистиллированной воды со стороной длиной в 1 метр, с приложенными к нему по краям электродами, будет иметь сопротивление минимум 2 кОм. А если представить разлитую по полу дистиллированную воду, скажем, в объеме одного стакана (200 мл), то ее сопротивление в лучшем случае окажется 200 кОм. Можно сказать, что это практически — диэлектрик.
Нет смысла пытаться использовать такую воду как проводник постоянного тока. С этой точки зрения дистиллированная вода не проводит электрический ток. Ее обычно используют для коррекции плотности электролитов.
Почему стоит опасаться контакта любой воды с электричеством
Однако люди не зря боятся контакта любой воды с электричеством, особенно — с переменным напряжением из розетки. Даже сетевое напряжение с провода, упавшего в лужу воды, на которую может случайно наступить человек, способно вызвать миллиамперный переменный ток, которого будет достаточно для причинения организму вреда.
Человеческое тело и фаза из розетки, соединенные через лужу разлитой воды, образуют цепь с реактивными элементами, и если человек в такой ситуации случайно коснется заземленного предмета, то его ударит током. Вот почему необходимо избегать контакта электричества с водой. Как вы понимаете, с дистиллированной водой риск причинения вреда меньше, но он все равно остается. Поэтому лучше избегать попадания любой воды на электрические приборы.
Источник
Ионы вода электрический ток
Жидкости, как и твердые тела, могут быть проводниками и диэлектриками. Растворы и расплавы солей, кислот, оснований являются проводниками электрического тока второго рода. Тип проводимости таких проводников – ионный.
Проводники второго рода – такие проводники, в которых при протекании тока происходят химические процессы.
Описание:
В стакан с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока взяли лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит.
Но если в стакан добавить некоторое количество NaCl – поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в стакане между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы (рис. 1).
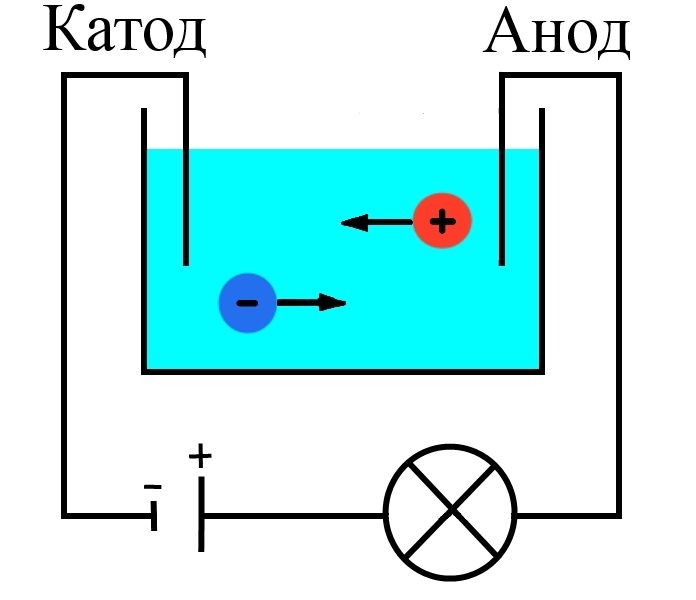
Рисунок 1. Схема опыта
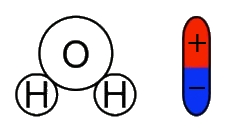
Откуда во втором случае (в соленой воде) берутся свободные заряды для протекания тока? Дело в том, что вода имеет полярные молекулы (рис. 2).
Рисунок 2. Полярность молекулы воды
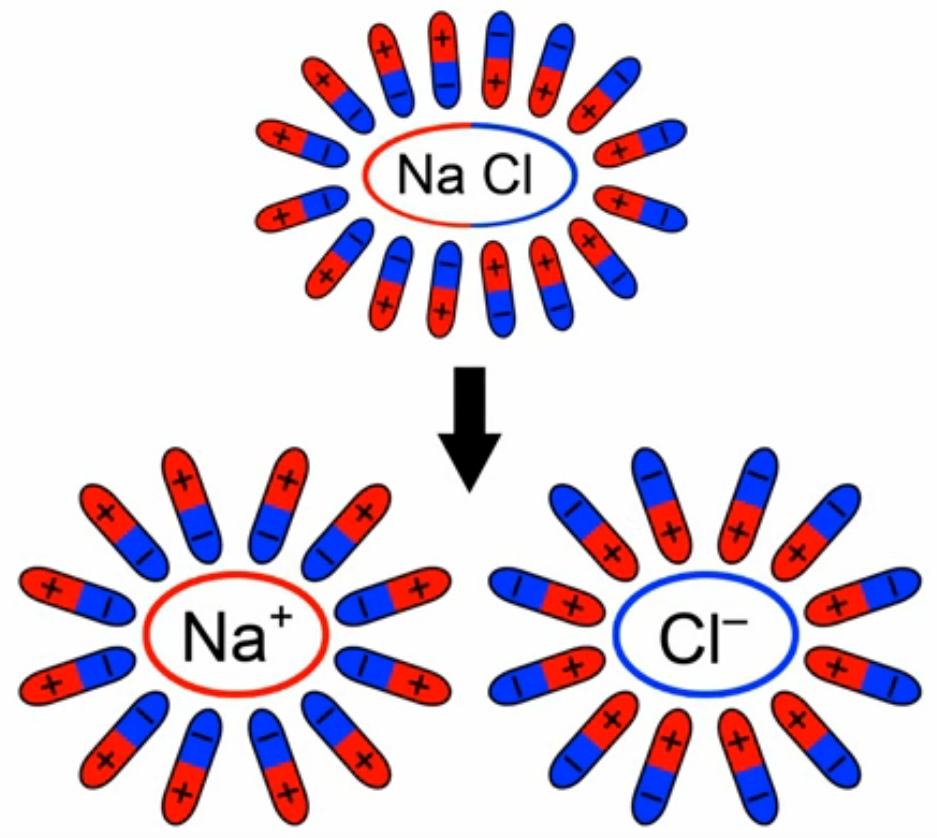
При добавлении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные – возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных ионов. Ион натрия имеет положительный заряд, ион хлора – отрицательный (рис. 3). Именно эти ионы и будут двигаться между электродами под действием электрического поля.
Рисунок 3. Схема образования свободных ионов
При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои. Протекает электрический ток – лампочка горит.
Источник
Электролиз воды

Средняя оценка: 4.4
Всего получено оценок: 168.
Средняя оценка: 4.4
Всего получено оценок: 168.
Процесс электролиза – это окислительно-восстановительная реакция, возможная только под действием электричества. Электролиз протекает в расплавах и растворах. В лабораториях для получения чистых газов – водорода и кислорода – проводят электролиз воды.
Что такое электролиз
Для осуществления процесса электролиза в раствор или в расплав помещают два электрода, подключённых к противоположным полюсам источника тока. В качестве электродов чаще всего используется металл или графит, так как эти материалы пропускают электрический ток.
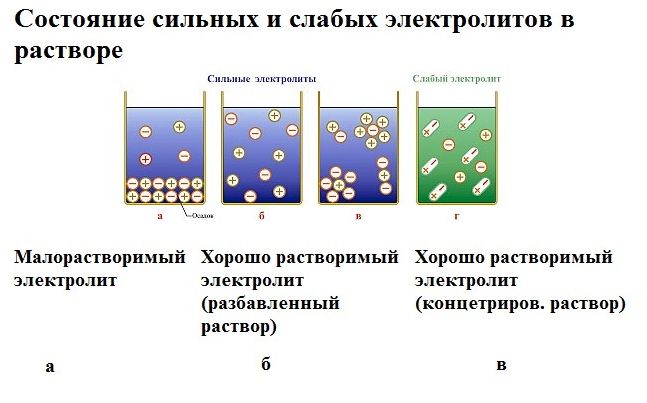
Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду – отрицательно заряженные анионы.
Катод является окислителем, на нём происходит процесс восстановления катионов. На аноде протекает процесс окисления: анод восстанавливает анионы и окисляется.
Процесс электролиза можно разделить на два этапа. Сначала происходит диссоциация – распад электролита (раствора или расплава) на ионы. Затем протекают реакции на электродах.
Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
Схема электролиза воды:
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H + ). В противном случае водород не будет произведён. Чтобы исключить конкуренцию, необходимо подобрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H + воды. На роль катиона электролита подходят:
Для исключения конкуренции анионов, наоборот, подбирают электролит с анионами большего электродного потенциала, чем анион OH – воды. В качестве такого электролита применяется щелочь для образования гидроксильного иона OH – .
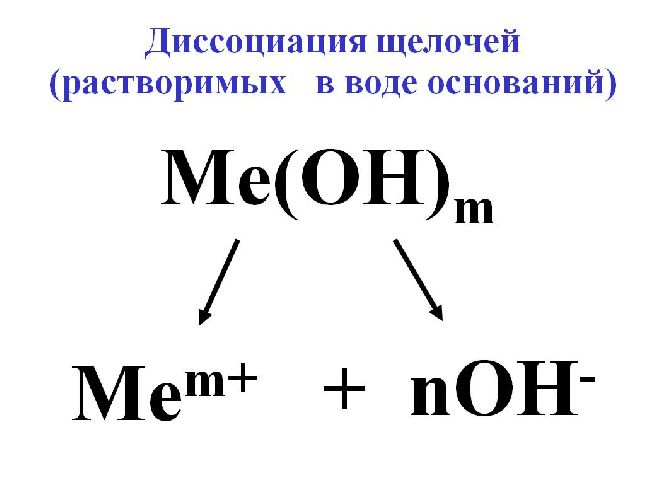
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Источник
Физики раскрыли секрет того, почему вода проводит ток
МОСКВА, 2 дек – РИА Новости. Ученые впервые проследили за тем, как одна молекула воды передает протоны своей «соседке», и раскрыли секрет того, почему вода пропускает ток, а другие похожие на нее вещества – не обладают таким свойством, говорится в статье, опубликованной в журнале Science.
«Когда через воду проходит ток, атомам кислорода при этом почти не приходится двигаться. Этот процесс можно сравнить с знаменитой «колыбелью» Ньютона, набором подвешенных шариков, выстроенных в линию. Если поднять один из них и ударить им по линии, только концевые шарики будут двигаться, а остальные будут стоять на месте», — рассказывает Марк Джонсон (Mark Johnson) из Йельского университета (США).
Дистиллированная вода, как и многие другие вещества, состоящие из двух неметаллических элементов, является изолятором, почти не пропускающим электрический ток. Но если в воду добавить даже очень небольшое число ионов, ее электропроводность резко вырастает и она становится полноценным проводником. О том, почему вода проводит ток, ученые спорят уже более двух столетий.
В начале 19 века немецкий химик Теодор Гротгус предложил теорию, которая объясняла то, почему вода пропускает через себя ток и почему электричество может разлагать ее на водород и кислород. Он посчитал, что молекулы воды могут захватывать лишние протоны и передавать их друг другу, подобно палочке в эстафете, благодаря формированию новых водородных и ковалентных связей и их быстрому распаду.
Источник
Механизм электрического тока в растворах. Просто о сложном.
Итак, начнем с того, что возьмем обычный аккумулятор и присоединим к его клеммам с помощью проводов две металлические пластины (электроды). Пластины опустим в воду. У нас получится электрическая цепь по которой не будет идти электрический ток. Цепь окажется разорванной и вода будет изолятором, если воду взять химически чистую. Значит, не содержащую в себе растворенных примесей.
Но как только мы добавим в такую чистую воду, к примеру соляную кислоту или щепотку соли, тотчас в цепи возникнет ток. Вода, в которой растворена кислота, соль или щёлочь уже не диэлектрик, а хороший проводник.
В чем отличие механизма тока в металлах и растворах. Отличий много, главное — носителями заряда в растворах являются ионы, а в металлах — электроны. Ионы — это атомы, у которых есть недостаток или избыток электронов. Рассмотрим процесс подробнее на примере растворенной в воде соляной кислоты. Молекулы воды разрывают молекулу кислоты HCl на два иона, положительный ион водорода и отрицательный ион хлора. Этот процесс называется электролитической диссоциацией.
Ионы — заряженные частицы, и под действием электрического поля (напомню у нас есть аккумулятор) они начинают двигаться. Отрицательный хлор начнет движение к положительно заряженной пластине — аноду, а положительные ионы водорода к отрицательной — катоду.
Другое большое различие в том, что вместо легких электронов ток создают ( то есть движутся) в десятки тысяч раз более тяжелые ионы. При этом образуется два потока — к аноду и к катоду.
Приблизившись к катоду, ионы водорода забирают у него электроны, которых им не хватает, и превращаются в нейтральные атомы. Хлор отдает лишние для него электрончики аноду и тоже становится нейтральным.
Получается своеобразный круговорот электронов. Электроны, которые из источника тока попадают на катод, с катода попадают в раствор, а анод наоборот забирает электроны из раствора. Ионы — это как метро или маршрутка для электронов. Правда «пассажиры» разные. На анод попадает совсем не тот электрон, который «сел» на водород на станции «Катод»)).
Фишка в том, что все электроны одинаковы, и сколько их в секунду высаживается с катода в раствор, столько же покидает из раствора на положительно заряженной пластине.
Следующее важное отличие, в растворе постоянно идет химическая реакция, в нем выделяется два газа — хлор и водород. Механизмы электрического тока в других растворах или расплавах аналогичны рассмотренному примеру с соляной кислотой.
Надо отметить, что ионы могут переносить заряд (создавать ток) также и в расплавах, и даже в твердых телах. Но в твердом теле движение больших и тяжелых ионов очень затруднено, заметные ионные токи возникают в твердых телах при высоких температурах.
Такие вещества, в которых под действие температур и вследствие теплового движения отрываются ионы называются ионными полупроводниками. Поваренная соль — типичнейший ионный полупроводник.
Источник