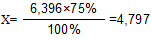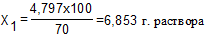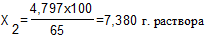Лабораторная работа №2
Тема: Взаимная ограниченная растворимость двух жидкостей
Цель: 1) Построение диаграммы растворимости системы фенол-вода
2) Определение типа системы двух взаимно ограниченно растворимых жидкостей
3) Определение критической температуры растворимости системы фенол-вода
Для изучения взаимной растворимости двух жидкостей используют метод В.Ф. Алексеева. На рисунке 13 представлена схема прибора для изучения взаимной растворимости двух жидкостей. Метод заключается в следующем: в ампулах готовят смеси с известным различным содержанием фенола и воды (см. таблицу 3) и запаивают.
Таблица 3 – Опытные данные
Состав смеси, весовые
Температура, t 0 С
Сред-няя из шести
Готовят водяную баню, которую нагревают на электроплитке до температуры примерно 80 0 С.
Опыт проводят с запаянной ампулой а (см. рисунок 13), содержащей смесь фенола и воды, и пробиркой б. В пробирку б наливают дистиллированную воду в таком же объёме, как объём смеси в ампуле а, с учётом объёма воды, вытесняемой термометром, погружённым в пробирку с водой. Пробирку закрывают пробкой с термометром. Ртутный шарик термометра должен быть погружён в воду. Ампулу и пробирку одновременно погружают в водяную баню. Смесь в ампуле а и вода в пробирке б должны иметь одинаковую температуру, потому что температуру в опыте измеряют по термометру, находящемуся в пробирке с водой. Ампулу и пробирку одновременно непрерывно встряхивают в водяной бане и постоянно наблюдают за смесью в ампуле.
а – запаянная ампула со смесью фенола и воды; 1 – слой раствора воды в феноле; 2 – слой раствора фенола в воде; б – пробирка с водой и термометром; 3 – вода; 4 – термометр; 5 –пробка
Рисунок 13 – Схема прибора для изучения фазового равновесия в системе с ограниченной растворимостью двух жидкостей
Отмечают температуру, при которой смесь становится прозрачной (однофазной, гомогенной). После этого баню с водой медленно охлаждают, ампулу и пробирку встряхивают в бане и отмечают температуру, при которой смесь становится мутной (двухфазной, гетерогенной). Температура гомогенизации и температура гетерогенизации различаются на один градус. С каждой смесью опыт проводят три раза и определяют три температуры гомогенизациии и три температуры гетерогенизации. Для построения диаграммы растворимости берут температуру, среднюю из шести значений температуры, полученных в опыте (см. таблицу данных опыта).
Ограниченная взаимная растворимость жидкостей означает, что растворимость их зависит от соотношения жидкостей в смеси и от температуры. Поэтому в опыте нужно быть внимательным и иметь в виду, что каждая смесь фенола и воды имеет свою температуру гомогенизации. Перед проведением опыта со следующей смесью (ампулой) в пробирку б следует налить холодную воду.
По полученным в опыте данным строят диаграмму растворимости системы фенол-вода. По оси y откладывают температуру в градусах Цельсия, по оси х – состав системы в весовых процентах.
График строят на миллиметровой бумаге.
По виду диаграммы растворимости делают вывод о том, к какому из трёх типов систем с взаимной ограниченной растворимостью относится система фенол-вода; по диаграмме определяют критическую температуру растворимости, характерную для смеси фенол-вода.
Посуда и приборы
1. Термометр на 100 0 С – 1 шт.
2. Прибор для определения взаимной растворимости жидкостей – 1 шт.
3. Баня водяная – 1шт.
Контрольные вопросы для защиты лабораторной работы
Фазовые равновесия. Общие понятия: фаза, компонент, число независимых компонентов, число термодинамических степеней свободы.
Общие термодинамические условия равновесия в гетерогенных системах и критерий направления процессов в гетерогенных системах.
Правило фаз Д. У. Гиббса, вывод.
Классификация систем по числу фаз, по числу компонентов, по числу термодинамических степеней свободы.
Типы двухкомпонентных систем жидкость – жидкость с ограниченной взаимной растворимостью. Примеры.
Диаграммы растворимости (диаграммы с расслаиванием) для трех типов двухкомпонентных систем жидкость – жидкость с ограниченной взаимной растворимостью. Критическая температура растворимости.
Диаграмма с расслаиванием для двухкомпонентной системы фенол – вода с верхней критической температурой растворимости. Бинодальная кривая, коннода, правило рычага.
Расчет числа термодинамических степеней свободы в разных точках на диаграмме с расслаиванием.
Источник
Построение диаграммы растворимости системы вода-фенол



Приборы и реактивы: Фенол 75%, термометр (0-100ºС), пробирки, водяная баня, стаканчики.
Готовится 70% раствор фенола в воде. Наливаем его в широкую пробирку, опускаем термометр.
70% раствор фенола готовится из 75% раствора фенола, разбавлением его водой. Т.к. плотность 75% раствора фенола равна 1,066, то 6 мл раствора весят 6,396 г.(6х1,066=6,396г.). В 6 мл 75% раствора содержится чистого фенола 4,797 г.
Х – 75%
Количество воды, которое необходимо добавить для получения 70% раствора, рассчитывается следующим образом: 70 г. фенола содержится в 100 г раствора,
(общая масса раствора)
6,853 – 6,396 = 0,457 г. (масса воды), т.е. для получения 70% р-ра фенола необходимо к 6 мл 75% р-ра добавить 0,457 мл воды
В приготовленном 70% растворе определяем температуру гомогенизации. Для этого нагреваемпробирку с раствором на водяной бане, при помешивании и отмечаем температуру исчезновения мути. После этого пробирку вынимаем из бани и охлаждаем на воздухе, также помешивая. Теперь отмечаем температуру появления мути. (Нагревание и охлаждение раствора фенола проводят 2-3 раза, для получения точного значения температуры).
Далее готовят 65% раствор фенола разбавляя 70% раствор. Необходимое количество воды рассчитывается следующим образом:
65 г. фенола содержится в 100 г. раствора
7,380 – 6,852 = 0,527 г. воды
Следовательно, в пробирку нужно добавить 0,527 мл воды. Приготовив таким образом, раствор фенола 65% раствор фенола, определяем аналогичным образом температуру гомогенизации. Затем готовим последовательно 60%, 50% и 35% растворы фенола в воде и находим температуру гомогенизации для каждого раствора.
Для получения значений температуры гомогенизации на второй ветви кривой, готовим сначала 20% раствор фенола в воде. Наливаем в пробирку 1,5 мл 75% раствора и добавляем к нему такое количество воды, чтобы получился 20% раствор. Расчеты проводим таким образом, как было описано выше. После этого определяем для 20% раствора температуру гомогенизации. Затем последовательно готовим 14%, 10% и 8,5% растворы фенола, каждый раз добавляя необходимое количество воды, и находим температуры гомогенизации для каждого раствора.
По полученным данным строим диаграмму фенол-вода, откладывая на оси ординат температуру гомогенизации, а на оси абсцисс – состав. После этого по графику находим температуру и состав критической точки.
- Кратко описать содержание работы.
- Рассчитать количество воды, которое необходимо добавить к исходному 75% раствору фенола в воде для 70%, 65%, 60%, 50%, 35%, 20%, 14%,10% и 8,5% растворов.
- Записать значения температур гомогенизации для растворов фенола в таблицу:
1. Понятия: системы (гомогенная, гетерогенная), фаза, компонент, термодинамические параметры, термодинамическая степень свободы?
2. Правило фаз Гиббса. Вывод. Анализ.
3. Диаграмма состояния воды. Анализ диаграммы.
4. Физико-химический анализ. Суть. Принцип непрерывности, принцип соответствия.
5. Система с эвтектикой. Анализ. Кривые охлаждения.
6. Диаграмма состояния с химическим соединением, плавящимся конгруэнтно. Анализ. Кривые охлаждения.
7. Правило рычага.
8. Диаграмма состояния системы с химическим соединением, плавящимся инконгруэнтно. Анализ. Кривые охлаждения.
9. Диаграмма состояния системы с неограниченной растворимостью компонентов в твердом состоянии.
10. Ограниченно растворимые жидкости:
а) с верхней критической температурой растворения, анализ.
б) с нижней критической температурой растворения, анализ.
в) с верхней и нижней критическими температурами растворения,
11. Правило Алексеева.
Список литературы
1. Киреев В. А. Курс физической химии. 1975г.
2. Стромберг А. Г. , Семченко И. К. Практикум по физической

3. Шаталов А. Я. , Маршаков И. К. Практикум по физической
4. Краткий справочник физико-технических величин. /Под.ред.
А А. Равделя и А. М. Пономаревой. 1983г.
5. Евстратова К. И.. Купина И. А. . Малахова Е. Е.
Физическая к коллоидная химия. 1980г.
6. Голиков Г. А. Руководство по физической химии. 1998г.
7. Глазов В. М. Основы физической химии. 1982г.
Источник
Физико-химические свойства бинарной смеси с частично взаиморастворимыми компонентами
1) Порядок определения свойств.
Существуют бинарные смеси с переменными свойствами растворимости. В этом случае содержание летучего компонента вычисляется в две стадии:
а) в области растворимости – по закону Рауля
б) в области нерастворимости – по закону Дальтона
2) Диаграмма растворимости:
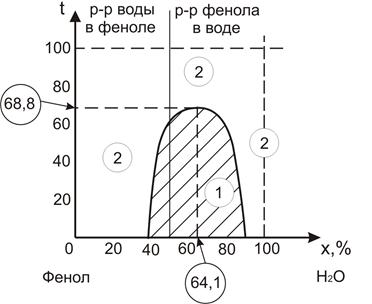
Рис.12 Диаграмма растворимости фенол – вода
1 – область полной нерастворимости
2 – область полной растворимости
— Если в растворе больше воды, то раствор называется раствором фенола в воде.
— Если в растворе больше фенола , то раствор называется раствором
Дистилляционные установки.
1. Схема простейшей 2 х -ступенчатой дистилляционной установки.
1- подогреватель смеси
2- перегонный куб первой ступени
4- перегонный куб второй ступени
5- конденсатор (дефлегматор)
6- сепаратор для разделения влажного пара на сухой насыщенный и жидкость при температуре кипения.
8,9- емкости с готовыми продуктами
Рис.13 Схема простейшей 2х ступенчатой дистилляционной установки
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Занятия 4 — 5. Определение критической температуры растворения системы «фенол-вода»
Цель работы: Определение критической температуры растворения (КТР) системы «фенол — вода».
Целевые задачи : Овладение техникой термического анализа; построение фазовой диаграммы системы «фенол — вода»; графическое определение КТР; выяснение прикладных возможностей фазовых диаграмм.
Домашнее задание к занятию 4
Занятие 4 — Фенол вода_1
Оснащение рабочего места:
Навеска фенола (отметьте точный вес)
Пробирка на 20 мл
Ртутный термометр (до 100 о С)
Пипетка на 1 мл (фото 1)

(фото 1, оснащение рабочего места)
Техника безопасности:
Во время работы будьте предельно внимательны! Фенол – летучее и токсичное вещество.
Фото 2 — Вы готовы к работе

Фото 3 — Как держать пробирку и термометр во время работы

Фото 4 — Расположение термометра

Фото 5 – Моем руки с мылом

Фото 6 – Протираем руки спиртом

Фото 7 — Слив фенола
Ход работы:

Фото 8 — Включаем водяную баню в розетку

Фото 9 — Включённая водяная баня

Фото 10 — Установка термометра

Фото 11 — Процесс плавления чистого фенола

Фото 12 — Расплавленный фенол, нагретый до температуры 50°C

Фото 13 — При помощи секундомера фиксируем температуру каждые 0,5 минут
Обратите особое внимание на точность количества воды! Ошибившись в отмеривании, вы испортите опыт, и придётся начинать всё сначала.
В пипетку при помощи груши (только не ртом!) насасывается ровно 1 мл дистиллированной воды. При внесении воды в пробирку, сливаем столько воды, сколько указанно в таблице (в первый раз — 0,25 мл).
Очень важно — не перепутайте 0,05 мл и 0,5 мл. Разница, как вы видите, очень большая. (фото 14, 15, 16, 17, 18, 19)

Фото 14 — В пипетке 1 мл дистиллированной воды

Фото 15 — В пипетке 0,25 мл

Фото 16 — В пипетке 0,5 мл

Фото 17 — В пипетке 0,05 мл – ещё раз сравните с 0,5

Фото 18 — В пипетке 0,1 мл

Фото 19 — В пипетке 0,2 мл

Фото 20 — Приоткрываем пробирку

Фото 21 — Вносим в пробирку воду
(пусть, один студент так же держит термометр с пробиркой, а другой вносит воду)
После гомогенизации (взаимного растворения воды и фенола) вынимаем её из воды и охлаждаем на воздухе до гетерогенизации (помутнения). (фото 23, 24, 25)
Для равномерного охлаждения жидкости её можно перемешивать термометром.

Фото 22 — Пробирка снова в горячей воде

Фото 23 — Гомогенная система — прозрачная

Фото 24 — Постепенно возникает помутнение
(Перемешивая раствор, придерживайте резиновую прокладку)

Фото 25 — Гетерогенная система — мутная
Сверяем результаты у преподавателя и заносим их в таблицу.

Фото 26 — Сливаем раствор с фенолом в специальный слив

Фото 27 — Моем пустую пробирку и термометр под проточной водой

Фото 28 — Чистое рабочее место
Благодарим за внимание!
Лабораторную работу выполнили студенты 1 курса 29 группы:
Источник