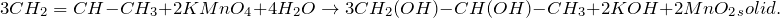- Химические свойства алкадиенов
- Химические свойства сопряженных алкадиенов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Галогенирование алкадиенов
- 1.3. Гидрогалогенирование алкадиенов
- 1.5. Полимеризация
- 2. Окисление алкадиенов
- 2.1. Мягкое окисление алкадиенов
- 2.2. Жесткое окисление
- 2.3. Горение алкадиенов
- C3H6 + KMnO4 + H2O = ? уравнение реакции
- Мягкое окисление алкенов. Пошаговый алгоритм составления уравнений.
Химические свойства алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
| Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода. |
1.1. Гидрирование
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
| При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2). |
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2: |
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:

1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. |
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
При полимеризации изопрена образуется природный (натуральный) каучук:
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
Источник
C3H6 + KMnO4 + H2O = ? уравнение реакции
Составьте химическое уравнение по схеме C3H6 + KMnO4 + H2O = ? Расставьте стехиометрические коэффициенты. Дайте краткую характеристику классу органических соединений алкены: укажите основные физические и химические свойства, а также способы их получения.
Алкенами называются ненасыщенные углеводороды, молекулы которых содержат одну двойную связь. Общая формула гомологического ряда алкенов 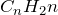
Важным химическим свойством алкенов является их способность легко окисляться уже при обычной температуре. При этом окислению подвергаются оба атома углерода, соединенные двойной связью. Если пропен пропускать через водный раствор перманганата калия (C3H6 + KMnO4 + H2O = ?), то характерная фиолетовая окраска последнего исчезает, происходит окисление пропена перманганатом калия. Молекулярное уравнение реакции имеет вид:
В связи с тем, что органические соединения при окислении образуют наряду с основными ряд побочных продуктов, возникают трудности в уравнивании этих реакций. Поэтому в органической химии сложилась традиция записывать эти реакции в виде схем с обозначением процесса окисления символом [O] (над стрелкой), и обозначать обратный процесс – восстановления – символом [H].
При окислении перманганатом калия в кислой среде или хромовой смесью происходит полный разрыв двойной связи с образованием продуктов окисления. Эту реакцию называют окислительным расщеплением двойной связи. Из молекулы прпена в результате окислительного расщепления образуются молекулы муравьиной и уксусной кислот:
Источник
Мягкое окисление алкенов. Пошаговый алгоритм составления уравнений.
Под мягким окислением алкенов подразумевают действие на них нейтрального холодного водного раствора перманганата калия. В результате такого окисления образуются, так называемые вицинальные диолы – двухатомные спирты с двумя ОН-группами при соседних атомах углерода в молекуле.
Поскольку среда нейтральная, в качестве продуктов восстановления перманганата калия образуются диоксид марганца — MnO2 и щелочь.
Вывод о том, что вода также является реагентом (будет входить в левую часть уравнения реакции), можно легко сделать хотя бы по тому, что в молекуле органического вещества появляются дополнительные атомы водорода, которых в перманганате нет.
Таким образом, схема реакции будет выглядеть так:
Расставим коэффициенты в этой схеме методом электронного баланса. Для этого сначала нужно определить степени окисления у тех атомов углерода, при которых изменилось окружение (в нашем случае у тех атомов углерода, к которым прикрепятся ОН группы). Отметим, что при окислении органических веществ степень окисления водорода не меняется и равна +1.
Для расстановки степеней окисления атомов углерода в органических веществах можно использовать так называемый метод блоков. В данном методе мы должны мысленно «изолировать» друг от друга фрагменты молекулы органического вещества по углерод-углеродным связям и рассматривать такие фрагменты условно как нейтральные молекулы. В частности, формулу пропена можно разбить на условно нейтральные блоки таким образом:
Далее, приняв заряд каждого блока за 0 и помня, что водород в органических веществах всегда имеет степень окисления, равную +1, несложно посчитать степени окисления всех атомов углерода.
Обозначим степени окисления первого, второго и третьего атомов С как х, у, и z соответственно. Тогда, подписав степени окисления для каждого элемента в формуле, мы получим:
Таким образом, составив уравнения и решив их, получаем:
Проведем аналогичную манипуляцию с формулой органического продукта окисления. Разбиваем мысленно его молекулу на нейтральные блоки по углерод-углеродным связям. Пусть степени окисления первого, второго и третьего атома С также будут равны x, y и z соответственно. Атомы водорода в органике всегда имеют степень окисления +1, а кислорода практически всегда -2 (за исключением редких случаев — органических пероксидов, которые в ЕГЭ не рассматриваются). Поэтому, подписав степени окисления для каждого элемента, получим:
Далее, составим уравнения, помня, что условно заряд каждого блока равен нулю, и решим их:
y + 1 −2 +1 = 0 => y = 0
z + 2·1 − 2 +1 = 0 => z = −1
Таким образом, мы видим, что степень окисления первого атома углерода не изменилась, что и логично, ведь не изменилось его окружение.
Степень окисления второго атома С была равна -1, стала равна 0.
Степень окисления третьего атома С была равна -2, стала равна -1.
Также в этой окислительно-восстановительной реакции изменяется степень окисления марганца. Изначально она была равна +7 (в перманганате калия), после реакции стала равна +4 (в диоксиде марганца).
Запишем еще раз схему реакции и составим для нее электронный баланс, используя в балансе только те атомы С, степень окисления которых изменилась:
3·| С −1 С −2 − 2е − → С 0 С −1
2·| Mn +7 + 3e − → Mn +4
(вывод о том, что от двух атомов С слева нужно отнять 2 электрона делаем на основании того, что суммарный заряд двух «атомов» С слева равен -3, а справа -1)
Перенесем коэффициенты из электронного баланса в схему:
Далее, мы видим, что в левой части схемы уже точно известно количество атомов калия, поскольку перед единственным калийсодержащим веществом левой части известен коэффициент. Таким образом, очевидно, что перед KOH в правой части схемы нужно поставить коэффициент 2. Получаем:
Далее, мы видим, что в левой части уравнения уже известно точное количество атомов кислорода, поскольку перед всеми кислородсодержащими веществами правой части коэффициенты известны. Всего в правой части уравнения 12 атомов кислорода. В левой части (не считая воды) – 8 атомов кислорода. Таким образом, чтобы в левой части тоже было 12 атомов кислорода, перед водой нужно поставить коэффициент 4. Таким образом, конечное уравнение окисления пропилена нейтральным холодным раствором перманганата будет иметь вид:
Следует отметить, что абсолютно такие же коэффициенты в уравнении реакции будут при мягком окислении любого другого органического вещества с одной двойной связью (при условии, что в молекуле будут отсутствовать другие фрагменты, способные к окислению).
Для демонстрации того, что коэффициенты будут идентичными, давайте рассмотрим мягкое окисление 2-фенилпропена
Схема окисления 2-фенилпропена будет выглядеть следующим образом:
Учитывая опыт примера с мягким окислением пропена, мы будем определять степени окисления не всех атомов углерода, а только тех, у которых изменилось окружение. Поэтому в молекуле 2-фенилпропена мы выделим только два условно нейтральных блока. Обозначив степени окисления атомов углерода как x и y, а также не забывая, что степень окисления водорода в органических веществах равна +1, подпишем степени окисления для каждого элемента в выделенных блоках:
Таким образом, составив и решив уравнения получаем:
x = 0
Аналогично поступим с продуктом окисления:
x −2 + 1 = 0 => x = 1
y +2·1 −2 + 1 = 0 => y = −1
Запишем повторно схему окисления 2-фенилпропена нейтральным раствором перманганата и составим электронный баланс:
3|С 0 С −2 − 2е − → С +1 С −1
2|Mn +7 + 3e − → Mn +4
Перенесем коэффициенты из электронного баланса в схему реакции:
Далее мы видим, что калия в левой части схемы 2, значит коэффициент 2 нужно поставить перед KOH. Получаем:
В правой части мы видим 12 атомов кислорода, в связи с чем для получения такого же количества атомов кислорода в левой части перед водой необходимо поставить коэффициент 4. Таким образом, конечное уравнение мягкого окисления 2-фенилпропена холодным нейтральным раствором перманганата калия будет иметь вид:
Как можно видеть, коэффициенты в этом уравнении полностью совпали с коэффициентами уравнения реакции мягкого окисления пропилена.
Источник