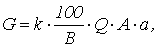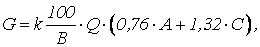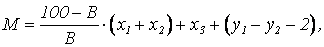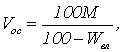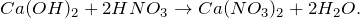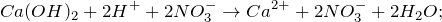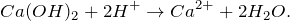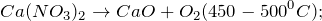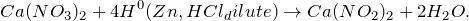- Нейтрализация путем добавления реагентов
- Ca(OH)2 + HNO3 = ? уравнение реакции
- Нейтрализация сточных вод
- Материалы для нейтрализации сточных вод
- Расчет процесса нейтрализации
- Соли, образующиеся в процессе реакции
- Фильтрация азотной и соляной кислоты
- Вертикальные фильтры
- Горизонтальные фильтры
- Комплекты оборудования для станции нейтрализации
Нейтрализация путем добавления реагентов
Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
H2SO4+Ca (OH)2 = CaSO4+2H2O,
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м3; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
| Щелочь, кг | Серная кислота | Соляная кислота | Азотная кислота | Уксусная кислота |
| Известь: |
гашеная
0,76/1,32
1,01/0,99
0,59/1,7
0,62/1,62
каустическая
0,82/1,22
1,1/0,91
0,64/1,57
0,67/1,5
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2. Сn – концентрации металлов в сточных водах, кг/м; b1, b2. bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
| Металл | Реагент СаО | Реагент Са(ОН)2 | Реагент Na2CO3 | Реагент NaOH |
| Цинк | 0,85 | 1,13 | 1,6 | 1,22 |
| Никель | 0,95 | 1,26 | 1,8 | 1,36 |
| Медь | 0,88 | 1,16 | 1,66 | 1,26 |
| Железо | 1 | 1,32 | 1,9 | 1,43 |
| Свинец | 0,27 | 0,36 | 0,51 | 0,38 |
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
где А – содержание серной кислоты, кг/м3; С – содержание железа, кг/м3.
Количество сухого вещества, которое образуется при нейтрализации 1м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
где Wвл – влажность осадка, %.
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
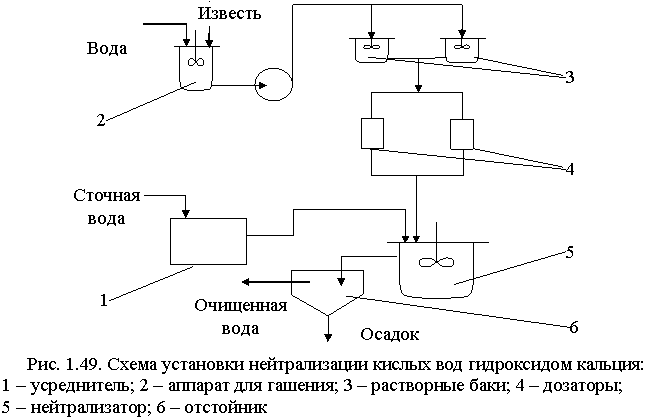
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.
Источник
Ca(OH)2 + HNO3 = ? уравнение реакции
Срочно нужна помощь! Какие продукты образуются в результате взаимодействия гидроксида кальция с азотной кислотой (Ca(OH)2 + HNO3 = ?)? Запишите молекулярное и ионное уравнения реакции. Охарактеризуйте полученное соединение: укажите основные физические и химические свойства, способы получения.
В результате взаимодействия гидроксида кальция с азотной кислотой (Ca(OH)2 + HNO3 = ?) происходит образование средней соли – нитрата кальция и воды (обмен). Эту реакция также принято называть реакцией нейтрализации, поскольку она протекает между щелочью и кислотой. Молекулярное уравнение реакции имеет вид:
Запишем ионные уравнения, учитывая, что вода и гидроксид кальция на ионы не распадаются, т.е. не диссоциируют.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Нитрат кальция (известковая / норвежская селитра) представляет собой твердое вещество белого цвета, кристаллы которого при плавлении разлагаются. Хорошо растворяется в воде (не гидролизуется). Растворяется в азотной кислоте. В кислом растворе восстанавливается только атомным водородом. Вступает в реакции обмена.
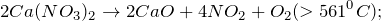
В промышленности нитрат кальция получают путем действия азотной кислоты на известняк. Он также является побочным продуктом процесса Оддо, применяющегося при добыче фосфата кальция:
Источник
Нейтрализация сточных вод
Нейтрализация сточных вод проводится с целью получить показатель pH равным 7 ед. Процесс основан на взаимодействии кислот или щелочей, содержащихся в жидкости с веществами, приводящими концентрации к нужным показателям. Данная реакция практически осуществляется двумя способами: добавление в жидкость химикатов или фильтрация через нейтрализующие материалы.
Материалы для нейтрализации сточных вод
Для нейтрализации сточных вод с большим включением кислот используется: известь, доломит, мрамор. Для приведения к нужным показателям стоков с высоким содержанием щелочей – техническая серная кислота. Самым доступным реагентом является известь, чаще ее используют в виде известкового молочка, но актуальны материалы в виде пасты или сухого порошка.
Расчет процесса нейтрализации
Расчеты процесса нейтрализации заключаются в установлении нужных объемов реагента. Удобнее пользоваться выражениями г-экв/л. Если концентрация выражена в г/л, ее легко перевести в соответствие так:
- обозначаем 1/Э = a,
- получаем b = aC г-экв/л.
Актуален показатель d, он равен 10 a. В таблице ниже приведены показатели a и d для некоторых реагентов.
Значение коэффициентов a и d для пересчета весовых (в г/л) и процентных концентраций некоторых кислот и щелочей в г·экв/л
Наименование кислот и щелочей
Количество реагентов для нейтрализации устанавливаются на основании стехиометрических соотношений. Ниже приведены расчетные данные для наиболее популярных кислот.
Расход химически чистых щелочей в г на 1 г кислоты
В следующей таблице приведены показатели для часто применяемых щелочей.
Расход кислоты в г на 1 г щелочи
Данные таблиц приведены для реагента в формате сухого порошка, и требуют корректировок. Например, для известкового молочка и пасты, используемой для удаления окиси кальция, реагенты берутся 105% или 95% — соответственно.
Соли, образующиеся в процессе реакции
В процессе нейтрализации образуются соли с различными показателями растворимости. Этот фактор нужно учитывать для установления остаточной их концентрации в жидкости и объемов осадка.
Растворы некоторых солей
Растворимость в г на 1 л воды при температуре в град
Сернокислый натрий, гидрат
Сернокислый кальций (гипс)
Азотнокислый кальций, гидрат
практически не растворим (1,45*10 -2 при t=25°)
Сернокислый магний, гидрат
Суммарный объем солей, образующийся при нейтрализации 1 грамма кислоты, приведен в таблице ниже:
Количество образующихся солей и углекислот при нейтрализации серной, соляной и азотной кислоты
Растворимость в г на 1 л воды при температуре в град
Фильтрация азотной и соляной кислоты
Этот способ эффективен при содержании азотной и соляной кислоты в сточных водах в пределах от 6 до 8 г/л. При более высоких показателях нейтрализующий материал загипсовывается и непригоден к работе. Кроме этого, в водах не должно быть тяжелых солей.
Вертикальные фильтры
На вертикальном фильтре минимальная высота загрузочного материала рассчитывается по формуле Вознесенского:
H = KD n ( 3 + lg b ) √v, где:
- H – высота загрузки фильтра в см;
- D – диаметр зерен загрузочного материала в мм;
- b – концентрация кислоты в г-экв/л;
- v – скорость фильтрации в м/час;
- K и n – эмпирические константы, n – относительно постоянна и равна значению в 1,47, а K – варьируется в пределах от 0,62 до 1,31, и зависит от сорта доломита.
Это справедливо для серной кислоты, для других кислот нужно экспериментально устанавливать эмпирические константы.
Показатели скорости фильтрации обычно располагаются в пределах от 4 до 8 м/ч. Точное значение зависит от высоты загрузочного слоя и концентрации примеси.
Длина горизонтального фильтра определяется по формуле:
- l – длина фильтра в метрах;
- v – скорость движения потока в фильтре в м/сек;
- t – продолжительность контакта загрузочного материала и сточной воды в сек.
Стандартные показатели v находятся в пределах: от 0,01 до 0,03 м/сек. Длительность контакта t определяется по формуле:
t = 6KD1,5/ √v ( 3 + lg b ), где
- D – средний диаметр зерен загрузочного материала в см;
- b – концентрация кислоты в г-экв/л;
- K – коэффициент, характеризующий активность реагента – доломита.
Горизонтальные фильтры
Горизонтальный фильтр должен располагаться под уклоном, его значения i определяются по формуле:
i = v 2 /DS 2 p0 2 , где:
- v – скорость потока воды в см/сек;
- D – крупность зерен загрузочного материала в см;
- p0 – порозность загрузки, стандартные показатели: от 0,35 до 0,45;
- S – коэффициент, находящийся в зависимости от D в пропорции, рассчитываемой по формуле Избаша: S = 20 – 14/ D.
Соотношение между B – шириной и H – высотой фильтра определяются для каждого конкретного случая индивидуально.
Суммарные потери напора в фильтре устанавливаются по формуле:
Площадь поперечного сечения фильтра рассчитывается таким уравнением:
- q – приток сточных вод в м 3 /сек;
- v – скорость фильтрации в м 3 /сек.
Для установления расхода загрузочного материала за 1 сутки определяется формула:
- Q – количество нейтрализуемых стоков в сутки в м 3 /сутки;
- C – концентрация кислоты в стоках в г/л или кг/м 3 ;
- m – коэффициент стехиометрического соотношения, его значения берутся из таблиц выше.
Поскольку 100-процентное использование загрузочного материала невозможно, то фактическое Mф превышает расчетное M. Например, при использовании доломита Mф = 1,5 M.
Расчетная работа фильтра без перезагрузки определяется по формуле:
- P – вес загрузочного материала на фильтр.
Рассмотрим пример расчета. Количество нейтрализуемых стоков в сутки составляет 100 м3/сутки. Они загрязнены соляной кислотой в концентрации 5 г/л. Загрузочный материал – известняк с активностью 50%. Требуется определить расход нейтрализатора.
M = 100 х 1,37 х 5 = 685 кг/сутки.
Увеличив на 5% (о чем сказано выше) получим:
M = 685 х 5 = 720 кг/сутки.
Но поскольку активность известняка составляет 50%, делается еще один расчет:
M = 720 / 0,5 = 1440 кг/сутки.
Комплекты оборудования для станции нейтрализации
Станции для нейтрализации сточных вод состоят из многих рабочих модулей: песколовки, резервуары-усреднители, склады реагента, аппараты для приготовления реагента, дозаторы, смесители, камеры реакции, отстойники, накопители, шламовые площадки. Каждый из агрегатов интегрируется в систему по необходимости. Так, если в стоках есть песок – устанавливается песколовка.
Если на предприятии есть и кислотные, и щелочные стоки – минимальное количество усреднителей должно быть не менее двух. И они, согласно нормативам, должны быть доступны для чистки
Подача извести в пределах предприятия должна быть механизирована. Гашение реагента выполняется в специальных машинах, конструкции Руссола и Полякова. Крупные фракции извести должны предварительно дробиться. Известковое молочко приготовляется в мешалках с оборотами лопастей не менее 40 об/минуту. Его концентрация определяется по активности окиси кальция в пределах от 5 до 10%.
Для стоков, содержащих только соляную кислоту продолжительность контакта с реагентом должна быть 5 минут. Если в составе жидкости есть тяжелые металлы, время увеличивается до 30 минут. При повышенной мощности мешалки – уменьшается до четверти часа.
Объемы накопителей зависят от количества осадка при нейтрализации сточных вод. В таблице ниже приведены показатели для нейтрализации стоков известковым молочком с 50-процентной активностью окиси кальция.
Количество осадка, накапливаемого за 1 год от 1м 3 нейтрализованной воды
Концентрация кислоты и ионов тяжелых металлов в кг * м 3
Источник